宁波市某人工泻湖浮游生物变化特征及影响因素分析
2018-09-17孙丽梅汪文东高凤曹昌丽唐剑锋
孙丽梅,汪文东,3,高凤,曹昌丽,*,唐剑锋
1. 中国科学院城市环境研究所,城市环境与健康重点实验室,厦门 361021 2. 中国科学院宁波城市环境观测研究站,宁波 315830 3. 中国科学院大学,北京 100049 4. 安徽师范大学生命科学学院,芜湖 241000
湖泊生态系统在水循环过程中起着重要的作用,在生物圈循环中也有不可替代的作用,并具有独特的结构特征[1]。近年来,随着人们生活水平的提高和生态可持续发展理念的推广,在城市规划和景观设计过程中,景观水体的开发应用愈发广泛。除具有景观功能的天然湖泊水体外,人们还在原有自然水体的基础上,通过人工改造形成人工泻湖等景观水体。人工泻湖是湖泊生态系统的重要组成部分,对于人类的生产、生活、社会经济以及城市景观文化功能的提升具有重要的意义[2]。近年来,随着城市化的快速发展,人们对湖泊生态系统的过渡干扰日益加重,导致部分区域水质恶化,形态结构破坏,水文动力学条件改变,生境退化以及重要敏感生物消失,使得其生态系统健康受损[3]。人工泻湖生态系统健康已经成为许多国家和地区重点关注的环境问题之一。
在水生态系统中,浮游植物和浮游动物是食物链的重要组成成分,承担了生产者和初级消费者的作用,对水生态系统具有重要的作用。浮游生物是水体营养等级的重要指示生物,其群落结构、生物多样性指数等常常被作为水环境评价的重要指标[4]。浮游植物和浮游动物相互影响、共同存在。浮游植物个体小,生活周期短而易受环境变化的影响,可在短时间内对环境变化做出反应,其随营养水平、盐度等环境条件的不同,在形态、结构和种群组成上存在较大差异[1]。因此,浮游植物的群落结构能较好地反映水体环境状况,也是评价水质和水体健康的重要手段。浮游动物是食物链的另一个重要环节,其种类和数量也与水环境质量密切相关,同时在生态系统的结构和功能中起着重要的调控作用[5]。浮游生物群落结构在水环境,尤其是湖泊环境中,对污染物环境行为的反应非常重要[6]。
因此,了解浮游生物的群落结构特征是进一步深入认识其生态环境效应的关键。长期以来,对于拦坝建库截流形成的水库型湖泊,被认为是污染物环境行为较为活跃的热点地区[7],朱广伟等[8]对太湖流域水库型水源地硅藻水华发生特征及对策进行了分析,浮游生物在其中的核心地位不容忽视。基于此,本文以宁波市某人工拦坝工程形成的人工泻湖为例,深入研究在拦坝过程中人工泻湖内浮游生物群落结构特征及其影响因素。为受人工拦坝及其水文情况变化下人工泻湖的浮游生物结构特征及其水质影响机制的研究奠定基础,为人工泻湖优化调控提供理论基础和科学依据。
1 材料与方法 (Materials and methods)
1.1 研究区域概况
梅山水道为人工泻湖,位于宁波市北仑区梅山岛与穿山半岛之间,全长17 km,两侧分别为梅山港区和穿山港区,平时潮差较大,日潮差约3 m。水道宽度在0.5~1.6 km之间,水深在5~10 m之间。2014年为综合考虑渔港、航道等相关规划,宁波市北仑区政府通过梅山港抗超强台风渔业避风锚地工程对梅山水道采用双头拦截的方式建设2条海堤,其中南堤长1 200 m,堤顶宽度7 m;北堤长900 m,堤顶宽度30 m,兼做交通道路;建设水闸2座,总净孔80 m。其中南、北堤闸均为8 m×5孔;建设500吨级海船闸一座,尺寸120 m×12 m×3.36 m;营造岸线长30 km、水面宽度400~1 100 m、水域面积10.85 km2的景观水域[9]。2016年5月,梅山水道合龙,合龙后梅山湾海域成一个闭合的人工泻湖。
研究区域属亚热带季风气候,受海洋气候影响较大,冬季盛行西北风,气候干燥寒冷;春季气温开始回升,雨量增多,东风渐占优势;夏季主要以东南风为主,降水集中在梅汛期和台汛期;秋季日夜温差较大,盛行西南风。多年平均气温为16.7 ℃[10]。
1.2 样点分布与采样时间
根据梅山水道人工泻湖的水域情况,设置S1、S2、S3、S4共4个采样点,分别位于北堤、南堤人工泻湖内外,如图1所示;采样期间北堤已合拢,南堤尚在建设。根据梅山水道季节变化在不同季节(2015年3月、6月、9月、12月)开展采样。

图1 梅山水道采样点分布Fig. 1 Distribution of sampling sites in Meishan Channel
1.3 采集和分析方法

1.4 数据处理与分析
1.4.1 水质生物评价
采用Shannon-Wiener多样性指数(H′)、Margalef丰富度指数(D)、Pielou均匀度指数(J)进行浮游生物多样性评价;采用物种优势度Y计算浮游生物优势种;采用Jaccard相似性指数(Jc)来反映群落的β-多样性。计算公式如下:

式中,ni为第i个分类单元的个体数,N为样品中所有物种的总个体数,S为样品分类单元数;a、b分别为不同采样点的浮游植物的总种数,c表示其共有种数。
1.4.2 富营养化指数法
采用富营养化指数法(EI)对采样点水质进行分析评价:


1.4.3 统计分析方法
利用SPSS 22.0对数据进行Pearson相关系数计算,采用Origin 8.0分析处理数据。
2 结果(Results)
2.1 浮游植物分布特征
样品中共鉴定出浮游植物5门66种,其中硅藻门44种,占总种数的67.7%;甲藻门7种,蓝藻门6种,绿藻门7种,裸藻门2种。
浮游植物密度变化如图2所示。从种类看,绝大部分点位均可检测到硅藻和甲藻,除夏季S2外其他点位硅藻占藻密度76.5%以上,裸藻和蓝藻在部分点位可检测到,绿藻仅在夏季S2及秋季各点检出,其中夏季S2绿藻占藻密度百分比达43.0%,其余点位绿藻占比较小;总体表现为夏秋季种类多春冬季种类少,夏季检出5门31种,秋季5门33种,春季3门29种,冬季仅检出硅藻和甲藻共22种,其中S2夏季种类最多为5门16种。从藻细胞密度看,S2夏秋季藻密度远大于春冬季,S1夏季密度最大,S3、S4秋季密度最大;S2藻密度远高于其他样点且季节差别最大,春、秋季密度分别为2.95×105、2.51×103cells·L-1。

图2 各采样点浮游植物密度变化Fig. 2 Variation of algae density of samples
夏冬两季浮游植物优势种见表1,Jaccard物种相似指数见图3。除夏季S2以绿藻门中的小球藻为优势种(优势度0.43)外,其他点位均以硅藻为优势种;S2、S3在夏秋季单一种群优势度大于S1、S4,春冬季优势度趋于相似,表明S2、S3在温度适于藻类生长时易出现单一优势种。比较各点Jc值可看出,S2与其他点位之间的Jc值相较于其他点位之间的Jc值小,夏季最低,表明S2与其他点位之间的种群分布差异较大,夏季尤甚。综上,S2植物种群与其他点位差别显著,夏季差异最大。
浮游植物的生物多样性见图4。夏秋季3项生物评价指数均为S2、S3小于S1、S4,春冬季各采样点生物评价指数差异减小;同时浮游植物的3项生物评价指数具有相同的趋势。S2浮游植物的丰度最高,同时生物多样性较低;植物丰度最低的S4生物多样性较高。与水质生物多样性指数评价标准[12]比较可知,H′、D值显示水体为α-中污染水平,J值为轻污染或清洁水平。
2.2 浮游动物分布特征
浮游动物种类及密度分布见图5。4个样点共鉴定出浮游动物25种。其中,节肢动物门中的桡足类17种、轮虫7种、原生动物1种,分布呈现时空差异。
春、夏、秋季分别鉴定出16、15、11种,主要为桡足类及少量轮虫,冬季共鉴定出10种,以网纹虫为主要优势种;物种数春夏季多于秋冬季。夏秋季桡足类及轮虫密度比春冬季高,例如S2冬季为4.8×103cells·L-1,夏季为2.3×105cells·L-1。四季浮游动物密度最高值均出现在S2,其中夏季为其他点位密度的6倍以上,冬季高达35倍;其他点位浮游动物密度春夏秋季差异较小,冬季S3显著大于S1、S4。从种群优势度看,夏秋季S1、S3、S4均以桡足类水蚤为优势种,S2则出现了优势种疣毛轮虫和晶囊轮虫;冬季网纹虫优势度达0.52以上,S2为最大值0.99。

图3 各采样点之间浮游植物的Jaccard物种相似指数Fig. 3 Jaccard indices of phytoplankton of samples

表1 各采样点浮游植物优势种Table 1 Composition of dominant species phytoplankton of samples
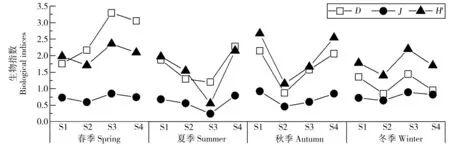
图4 各采样点浮游植物生物评价指数Fig. 4 Biodiversity indices of phytoplankton of samples

图5 各采样点浮游动物种类及密度分布Fig. 5 Species and density of zooplankton of samples

图6 各采样点之间浮游动物的Jaccard物种相似指数Fig. 6 Jaccard indices of zooplankton of samples
各采样点之间浮游动物的Jaccard物种相似指数见图6。春秋冬3季各点位间的Jc值为0.37~0.67,夏季S2 与其他点位之间的Jc值相较于其他点位之间的Jc值小。说明S2夏季与其他点位的浮游动物种群分布差别显著,其他季节则趋于相似。
浮游动物各项生物评价指数见图7。各项指数在夏、秋冬两季均呈U形,即S1、S4的指数值大于S2、S3;S2夏季J值最低,秋、冬季3项评价指数均为最低;春季各项指数数值相近。参照水质生物多样性指数评价标准[12],D值显示春季各点及夏季S1、S2为α-中污染,夏季S3、S4及秋冬季各样点为重污染;J值显示仅冬季S2、S3为重污染,其余各点为轻污染或清洁水平;H′值显示冬季S2、S3为重污染,其余各点为α或β-中污染。综合各点间生物评价指数大小差异及水质类型评价,S2水质污染水平最高,S3次之,且两者均可能存在重污染;S1、S4水质较好。
2.3 水质参数分析
参照海水水质标准(GB3097—1997)对采样点水质进行分析评价。其中,夏秋季水温均值分别为23.5 ℃、25.4 ℃,春冬季分别为13.4 ℃、12.7 ℃,夏、秋季水温较适宜浮游生物生长;pH、溶解氧在第一类水质范围内,且各点间无明显差异;S2盐度均值为24.2,其他点位盐度均值为25.1,S2盐度低于其他点位,水质淡化趋势明显;悬浮物S1、S2明显低于S3、S4;化学需氧量为0.78~1.86 mg·L-1,也在第一类水质范围内;无机氮除春季各点为1.39 mg·L-1以上之外,其他季节波动范围为0.14~0.45 mg·L-1,夏季为0.35~0.45 mg·L-1在第三、四类水质范围内,秋冬季S3、S4为一类水质,S1、S2为二、三类水质;活性磷酸盐含量较高均为四类水质;EI指数各点为中度富营养化,冬季仅S2为中度富营养化,其他点为轻度富营养化。
2.4 影响浮游生物时空变化的因子相关性分析
采用SPSS 20.0对盐度、悬浮物、溶解氧、化学需氧量、无机氮、活性磷酸盐共6项水质参数与浮游生物密度、生物多样性进行Pearson相关性分析,分析结果见表2。盐度与浮游动物密度呈显著负相关(P<0.05),与浮游动物D值、J值、H′值、浮游植物D值均呈显著正相关,说明盐度是浮游生物生长的潜在重要影响因子;悬浮物与浮游植物D值、J值呈显著正相关(P<0.05);化学需氧量与动物D值、J值、浮游植物D值呈显著负相关(P<0.01、P<0.05、P<0.01);此外无机氮与浮游植物J值呈显著正相关(P<0.05),但本研究中营养盐含量丰富不是浮游植物生长的限制因子,对浮游植物生长影响较小,虽然两者呈显著正相关但并无因果关系[13]。
3 讨论(Discussion)
3.1 生物多样性分析与评价
梅山水道人工泻湖自建堤后,其北堤内侧采样点S2浮游生物密度显著上升,生物评价指数下降,并产生了区别于其他样点的优势种群;南堤外侧采样点S4表现为浮游生物密度低但生物评价指数高。2个采样点的结果对比表明,北堤合龙后浮游生物密度上升、生物多样性下降且群落结构改变,与文献中研究结果一致[14]。夏季北堤内侧出现优势种绿藻,这是流动型水域转化为湖泊型水域的生态特征[15]。桡足类中的水蚤在各采样点均可检出,而该类群作为广温广盐物种广泛分布于近海陆架交汇混合水域[16],轮虫是淡水浮游动物的重要组成部分[17]仅在S2中为优势种,这也说明拦坝后水道已淡水化。
浮游植物生物评价指数显示,各采样点水体为α-中污染水平;浮游动物生物评价指数显示水道内侧为重污染水平,外侧为重污染或中污染水平。两套指数评价结果存在差异,说明了单纯依靠某一指数评价水质具有一定局限性;但各类指数的评价趋势一致,即水道北堤内侧水质最差、南堤内侧其次、外侧较好。

图7 各采样点浮游动物生物评价指数Fig. 7 Biodiversity indices of zooplankton of samples

表2 梅山水道环境因子与浮游生物多样性相关性分析Table 2 The correlation of biodiversity indices with environmental factors in Meishan Channel
注:**,在0.01 水平上显著相关;*,在0.05 水平上显著相关。
Note:**P<0.01;*P<0.05.
3.2 理化参数分析与评价
水库蓄水会导致水动力条件改变而带来一系列物理、化学变化,如营养盐、悬浮物等[18]。梅山水道在北堤合龙后淡化趋势明显,北堤较南堤悬浮物浓度显著降低透明度上升,化学需氧量下降;这是因为北堤合龙后,堤坝两侧流速减慢悬浮物发生沉降,化学需氧量亦随之降低[19],而北堤内侧与外侧海水交换减少则盐度下降。Bilous等[20]的研究发现,人工泻湖存在氮素富集的现象,是农业源污染的地下水引起的;梅山水道内外侧氮、磷营养盐含量丰富但内部并不富集,可能是因为该地区地下水无明显污染。
本次监测pH、溶解氧、化学需氧量均在第一类水质范围内;同时各采样点营养盐含量大部分处于三、四类水质范围内,有益于浮游生物生长;EI指数夏季各点为中度富营养化,冬季仅S2为中度富营养化,其他点为轻度富营养化,且仅S2为EI指数上升其他点为下降。综合上述指标结果,梅山水道处于中度或轻度富营养化水平,拦坝后北堤内侧富营养水平有所上升。
3.3 生物多样性及理化参数相关性分析
各项水质理化因子的变化必然会影响到浮游生物[21],下面从浮游植物、浮游动物两方面探讨其影响因素。
浮游植物方面,其密度增加在拦坝过程中经常出现[22],如三峡库区在蓄水后藻类数量大幅上升[21]。本研究中悬浮物浓度低的北堤其密度显著大于悬浮物浓度较高的南堤,是由于在营养盐丰富的情况下光照是浮游植物生长的限制因子,而北堤悬浮物浓度受水动力因素影响降低,使得光照增强有利于浮游植物生长,这与鄱阳湖的研究结果类似[13]。盐度、悬浮物浓度与浮游植物评价指数显著正相关,有海域相关研究发现盐度和悬浮物是影响浮游植物群落的主要因素[23],说明悬浮物和盐度的降低均可能致浮游植物生物多样性降低。
浮游动物方面,本研究中盐度既影响了浮游动物密度又影响了均匀度指数,是浮游动物生长的重要影响因子,这与渤海、东海等大量相关研究结果一致[24-25]。化学需氧量与生物评价指数呈显著负相关,曾阳等[26]的研究中化学需氧量与H′值变化趋势呈现明显的相关性,这可能是由于化学需氧量作为水质污染程度的重要因子,其值增大水质变差而使得生物多样性降低[27]。
将浮游生物分布及水质理化参数结合来看,北堤合龙后使得水道内海水淡化、悬浮物含量下降,导致浮游生物密度上升、生物多样性下降、出现淡水优势种群;浮游生物评价指数与理化参数结合分析,水道处于中污染水平。
