佐剂性关节炎大鼠血小板微粒、血小板参数及滑膜组织的变化
2018-09-17刘磊刘健黄传兵万磊谌曦
刘磊,刘健,黄传兵,万磊,谌曦
(安徽中医药大学第一附属医院风湿病科,合肥 230031)
类风湿关节炎(RA)是一种可致多系统受累的、慢性、侵袭性自身免疫性疾病,以关节滑膜慢性炎症为基本病理特征。滑膜组织血管增生形成血管翳对关节软骨的侵蚀,是造成RA关节功能障碍的最主要原因。近年来血小板参数及血小板微粒的异常表达[1-2]、促血管生长因子/抑制血管生长因子的表达失衡[3-4]成为RA关节病变发病机制研究的热点。本研究通过观察AA大鼠外周血血小板微颗粒(PMPs)、血小板参数(PLT、PCT、PDW、MPV)、滑膜组织血管内皮生长因子(VEGF)、内皮抑素(ES)及滑膜微血管密度(MVD)的变化,以探讨PMPs、血小板参数及VEGF、ES在RA病变中的作用机制。
1 材料与方法
1.1 动物及饲喂 雄性清洁级SD大鼠24只,购于安徽省实验动物中心[动物许可证号:SYXK(皖)2015-06],大鼠体质量(200±20) g,饲喂于安徽中医药大学实验中心动物房,动物房环境保持安静,温度18~26℃,相对湿度40%~70%,保持通风排气10~20 次/小时。
1.2 试剂 弗氏完全佐剂购自美国Sigma公司;CD31检测试剂盒、SP试剂盒和DAB试剂免疫组织化学染色试剂盒购自北京中杉金桥生物有限公司;Trizol购自INVITROGEN公司提供(批号:15596-026);逆转录试剂盒购自美国Thermo公司(批号:K1622);荧光定量试剂购自北京康为世纪生物科技有限公司(批号:CW0956);引物由INVITROGEN公司合成;藻红蛋白(PE)标记的CD41、异硫氰酸荧光素(FITC)标记的CD61抗体购自美国Biolegend公司,批号为B188064、B181084。标准荧光微珠购自美国Sigma公司,yellow-green 1um,批号:MKBT2841V。
1.3 主要仪器 足趾容积测量仪:北京吉安得尔科技有限公司,型号:YLS-7B;电子天平:上海力衡仪器仪表有限公司,型号 MXX-5001;Sysmex XT-2000i 全自动血细胞分析仪器;组织石蜡包埋机:德国徕卡(LEICA)公司,型号:A130395;石蜡切片机:德国LEICA公司,型号:RM2245;组织脱水机:德国LEICA公司,型号:ASP300S;漂片机:美国伯明斯顿(Bloomington)公司,型号:MP-220;烘片机:德国LEICA公司,型号:HI1220;染色机:德国赛利(SLEE)公司,型号:MAS。显微镜:日本奥林巴斯 (OLYMPUS)公司,型号:T-Gradient Thermoblock 96 PCR扩增仪:德国Biometra公司;Epics XL 型流式细胞仪:美国Beckman-coulter公司。
1.4 方法
1.4.1 模型复制及指标检测 大鼠适应性饲养7 d后,按照随机数字表法分为健康对照(NC)组、模型对照(MC)组,每组12只。向模型组大鼠右后足跖皮内注射弗氏完全佐剂致炎,注射量为0.1 mL/100 g,制成佐剂性关节炎(AA)模型。致炎后30 d用10%的水合氯醛(0.35 mL/100 g)腹腔注射麻醉,无菌环境下取大鼠膝关节滑膜组织,免疫组织化学法检测滑膜组织CD31表达计算滑膜MVD值、PCR法检测滑膜组织VEGF mRNA、ESmRNA表达;取外周血流式细胞术检测血小板微粒表达。
1.4.2 足趾肿胀度、关节炎指数测定 足趾肿胀度(E):分别在模型复制前1天、致炎后30天测量各组大鼠足跖容积,计算各组大鼠足跖肿胀度。足跖肿胀度[5]=(Vt-Vn)/Vn×100%(Vn、Vt分别代表致炎前后足跖容积)。
关节炎指数(AI):致炎后第30天观察并记录全身关节病变程度,根据未注射佐剂的其余3只肢体的病变程度累积积分,计算出各组大鼠AI。0分:无红肿;1分:小趾关节红肿;2分:趾关节和足跖肿胀;3分:踝关节以下的足爪肿胀;4分:包括踝关节在内的全部足爪肿胀[6]。把各个关节的积分累计起来,即为每只大鼠的AI分值。
1.4.3 大鼠滑膜JPI、MVD、ES、VEGF的检测 关节病理损伤指数(JPI)评定:末次用药24 h后将动物处死,切开大鼠右侧足趾关节。各组大鼠取后足远端趾间关节,用4%多聚甲醛固定24 h后,10%乙二胺四乙酸(EDTA)脱钙5周;脱钙完全后,石蜡包埋,切片,HE染色。采用HE染色方法进行分级评定[7]。即为每只大鼠的JPI值。
MVD的检测:末次用药24 h后将动物处死,无菌环境取膝关节滑膜组织,固定、包埋、切片后行免疫组织化学学染色。CD31抗体按1∶100稀释,显色后封片,以细胞胞浆或胞核中出现黄色或棕褐色颗粒为阳性反应。免疫组织化学染色的半定量判定:采用图像分析软件(美国Image-Pro Plus专业图像分析软件系统,美国Media Cybernetics公司)进行图像分析,按照Weidner的方法[8]进行着色的微血管计数即为微血管密度(MVD)值。
滑膜VEGF、ES mRNA检测:PCR法检测大鼠滑膜ES、VEGF的表达。取大鼠滑膜组织用匀浆器匀浆,用Trizol试剂盒提取总RNA按照M-Mulv反转录试剂盒说明书提供的方法进行反转录。引物序列:VEGF序列:Forward 5′-CGG TTC CAG AAG GGA GAG GA -3′,Reverse 5′- CTG GGA CCA CTT GGC ATG G-3′;ES 序列Forward 5′- CGG GTC ATG CGG ACA GTTC GC-3′,Reverse 5′-CCG GAC TGT TCG GCT GAG GT-3′;采用实时荧光定量PCR法进行mRNA表达量分析,数据分析计算方法为 2-△△Ct,计算目的基因相对表达量。
1.4.4 外周血血小板参数、血小板微粒的检测 血小板参数的检测:采用Sysmex XT-2000i 全自动血细胞分析仪器检测大鼠血小板参数。
血小板微粒的检测:末次用药24 h后,腹腔注射10%水合氯醛溶液(0.35 mL/100 g)麻醉,打开腹腔,行腹主动脉采血2 mL,以枸橼酸钠抗凝,800 r/min室温离心20 min,分离血浆,上层液为富血小板血浆(PFP),每管取PFP 50 μL,加入1 μL标准荧光微珠,CD61-FICT和CD41-PE各5 μL,加样后室温避光孵育30 min,使荧光单抗与血小板微粒特异性结合,检测前用PBS溶液将容积调整至0.5 mL,上机检测前取0.5 mL PBS中加入1 μL标准荧光微球以直径1 μm标准荧光微球进行定位对照及设门,对门内颗粒(微颗粒直径在0~1 μm) 进行分析,CD61-FITC和CD41-PE双阳性颗粒为PMPs。结果经FACSAria流式细胞仪FlowJo软件进行分析后输出。
2 结果
2.1 AA大鼠外周血PMPs及血小板参数的变化 与NC组比较,MC组PMPs、血小板参数PLT、PCT明显升高(P<0.05)。见表1,图1。

图1 AA大鼠外周血CD61+CD41+PMPs的表达
2.2 各组大鼠足趾肿胀度、关节炎指数的变化 致炎30天,与NC组相比较,MC组大鼠E、AI显著升高(P<0.05)。见表2。
表2 各组大鼠足趾肿胀度、关节炎指数的变化
2.3 各组大鼠JPI、MVD、VEGF、ES的变化 与NC组相比较,MC组大鼠JPI、MVD显著升高,滑膜VEGF mRNA显著升高,滑膜ES mRNA显著降低,VEGF mRNA /ES mRNA显著升高。见表3及图2。
表1 AA大鼠外周血PMPs及血小板参数的变化
注:AA为佐剂性关节炎,PMPs为血小板微粒,下表同

表3 各组大鼠JPI、MVD、VEGF、ES的变化
注:JPI为关节病理损伤指数,MVD为微血管密度,VEGF为血管内皮生长因子,ES为内皮抑素
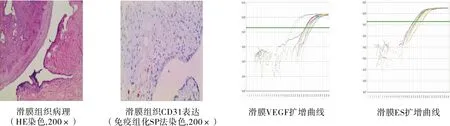
图2 滑膜组织病理、CD31的表达及VEGF、ES溶解曲线
2.4 各组大鼠PMPs与实验指标的相关性分析 Spearman相关性分析结果表明,CD61+CD41+PMPs(%)与血小板参数PLT、PCT呈正相关;CD61+CD41+PMPs(%)与E、AI及JPI、MVD、VEGF mRNA、VEGF mRNA/ES mRNA呈正相关;血小板参数PLT与足趾肿胀度、MVD呈正相关;血小板参数PCT与E、AI呈正相关(P<0.05)。见表4。

表4 各组大鼠血小板微粒与实验指标相关性分析
注:表中为r值,aP<0.05
3 讨论
RA滑膜组织血管新生、血管翳的形成,可破坏关节软骨面,导致关节功能障碍。有研究发现RA血小板细胞的异常变化与RA疾病活动密切相关[9-10]。传统的观点认为血小板活化、聚集可发挥凝血、止血、参与炎性反应等作用,而最近的研究表明血小板活化后可通过分泌PMPs参与免疫调节、血管新生[10-11]等重要生理病理学进程。而在RA的滑膜病变中,血管新生相关生长因子的表达失衡尤为显著。血小板活化及血小板微颗粒表达异常、血管生长因子的分泌失衡,可诱发一系列免疫平衡的紊乱引起滑膜血管增生。
佐剂性关节炎大鼠模型是现在较为认可的RA动物模型,弗氏完全佐剂造模后,动物关节的持续、慢性病变与人RA病变相类似。本研究观察到AA大鼠滑膜组织CD31表达显著升高,MVD明显上调,表明AA大鼠滑膜组织出现血管增生及血管翳的形成。同时本研究发现模型组大鼠滑膜VEGF mRNA显著升高,滑膜VEGF mRNA显著降低,VEGF mRNA /ES mRNA显著升高,提示AA大鼠滑膜组织的微血管增生与VEGF的表达升高,ES表达降低及VEGF/ES的表达升高有关。
促血管生长因子/抑制血管生长因子失衡是RA血管增生的重要因素[12]。在多种以血管病理性增生为发病特征的疾病中VEGF与ES之间的表达失衡被认为是诱导血管增生的发病机制之一[13-14]。VEGF可磷酸化胞内酪氨酸残基,诱发内皮细胞周围局部基底膜分解。在缺氧环境下VEGF可增加血管通透性,调控血管内皮细胞形成血管芽诱导血管新生[15]。ES是已知研究发现的最有力的内源性血管生成抑制因子,可抑制内皮细胞增殖、降低迁移及血管芽成管,诱导内皮细胞凋亡进发挥抗血管新生作用[16-17]。本研究中AA大鼠滑膜VEGF表达升高,ES表达降低,表明AA大鼠滑膜组织促血管生长因子/抑制血管生长因子状态失衡,进而促进了内皮细胞增殖,导致滑膜血管增生。
相关性分析表明PMPs与血小板参数PLT、PCT存在正相关;前期的研究证明AA大鼠存在血小板参数(PLT、PCT)及血小板活化因子(PAF)的异常升高,表明AA大鼠存在血小板异常活化[10-18]。本次研究中AA大鼠血小板参数(PLT、PCT)及PMPs表达率CD61+CD41+PMP%显著高表达,表明AA大鼠血小板活化后血小板微粒释放增多。进一步的研究表明CD61+CD41+PMPs与E、AI、MVD、VEGF mRNA、VEGF mRNA/ ES mRNA呈正相关,提示PMPs的高表达导致AA滑膜组织VEGF/ES的平衡失衡。
PMPs是血小板细胞在活化后细胞膜向外伸展变形以出芽方式形成囊泡而释放或伪足断裂脱落进入微循环所形成的小囊泡,其直径一般小于1 μm[19]。PMPs具有整套的血小板膜蛋白和膜脂质等结构,其膜表面可表达血小板膜糖蛋白、血小板活化因子、粘附分子、整合蛋白等。有研究表明血小板微粒PMPs可促进血管内皮生长因子分泌增多[20]。而在多种血管病理性增生疾病中PMPs均存在异常表达[21-23]。因此AA大鼠PMPs表达升高可上调VEGF表达,导致促血管生成因子VEGF/抑制血管生成抑制ES平衡失衡,诱导滑膜组织血管新生及关节损伤。
