康莱特联合索拉非尼对晚期肝癌患者T细胞亚群及生存质量的影响*
2018-09-17
(河南中医药大学第二附属医院 肿瘤一区,河南 郑州 450002)
肝癌在早期无典型的临床症状,隐匿性较高,确诊时大多数患者已处于局部晚期,而仅有少数患者有机会进行外科手术根治性治疗。肝癌的恶性程度较高,预后普遍较差,仅10%左右患者能达到5年生存期,临床治疗难度较大[1]。近年来,索拉非尼治疗肝癌的疗效得到了普遍认可,能显著阻止病情恶化,延长晚期肝癌患者的生存期,开启了靶向治疗肝癌的新时代[2]。随着中医药在癌症研究的深入,中医药的整体理念、辨证论治的优势逐渐受到医师的重视。康莱特注射液是由中药薏苡仁中提取的有效物质,具有益气养阴、散结消癓的功效,适用于临床原发性肝癌及原发性非小细胞肺癌的治疗[3]。本研究对54例晚期肝癌患者采用康莱特联合索拉非尼治疗,获得了良好的治疗效果,现报道如下。
1 资料与方法
1.1 临床资料
选取2016年1月-2017年6月河南中医药大学第二附属医院收治的晚期肝癌患者108例,按照随机数字表法分为观察组54例患者和对照组54例患者。观察组男性41例,女性13例;年龄39~73岁,平均(52.09±3.68)岁;病程2~8年,平均(4.03±1.21)年;肝动脉化疗栓塞术(transhepatic arterial chemotherapy and embolization,TACE)次数1~4次,平均(2.09±0.35)次;肝功能Child-pugh分级为A级21例,B级33例;临床分期为Ⅲ期20例,Ⅳ期34例;合并肝硬化41例,远处转移12例,乙型肝炎50例。对照组男性38例,女性16例;年龄38~72岁,平均(52.11±3.70)岁;病程2~8年,平均(3.98±1.17)年;TACE次数1~4次,平均(2.03±0.39)次;肝功能Child-pugh分级为A级24例,B级30例;临床分期为Ⅲ期23例,Ⅳ期31例;合并肝硬化39例,远处转移11例,乙型肝炎48例。两组患者性别、病程、TACE次数、肝功能、临床分期、合并症比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准
①患者经病理学检测确诊为晚期肝癌,符合《原发性肝癌诊疗规范》中相关诊断标准[4];②患者不可进行手术治疗;③无放化疗治疗史;④美国东部肿瘤协作组行为状态分级ECOG评分<2分;⑤预计生存期>6个月;⑥患者了解本研究所有研究措施,签订同意书。
1.3 排除标准
①心脑血管、肾功能、营养不良等严重病变者;②血栓栓塞患者,需抗凝治疗;③对本文使用药物过敏者;④合并自身免疫系统感染、急慢性感染病变;⑤依从性差,未完成整个疗程者。
1.4 治疗方法
1.4.1 对照组 给予索拉非尼治疗,口服甲苯磺酸索拉非尼片(德国拜耳公司,规格:200 mg,批准文号:H20130137,生产批号:20151108),2 次 /d,400 mg/次,以28 d为1个周期,连续治疗3个周期。
1.4.2 观察组 在对照组基础上,给予静脉滴注康莱特注射液(浙江康莱特药业有限公司,规格:100 ml,批准文号:国药准字Z10970091,生产批号:20150928)治疗,1次/d,200 ml/次,连续治疗21 d,暂停7 d,以28 d为1个周期,连续治疗3个周期。
1.5 疗效标准
按照实体瘤治疗疗效评价标准(RECIST)评价标准拟定[5],①完全缓解(CR),肿瘤病变完全消失,持续至少4周,无新病灶产生;②部分缓解(PR),肿瘤病灶体积缩小≥50%,持续至少4周,无新病灶产生;③稳定(NC),肿瘤病灶体积缩小<50%,或增大<25%;④进展(PD),肿瘤病灶体积增大≥25%,有新病灶出现。有效率=(CR例数+PR例数)/总例数×100%。
1.6 观察指标
于治疗前后,采集患者空腹肘静脉血5~8 ml,采用流式细胞仪(美国贝克曼CytoFLEX S型)检测T细胞亚群的水平,包括 CD3+、CD4+、CD4+/CD8+、NK细胞、Treg细胞。采用健康调查量表(SF-36)评估患者生存质量的变化[6],包括生理功能、情感职能、生理职能、精神健康、社会功能、躯体疼痛、活力、总体健康共8个项目36个小条目,总分100分,分值越大代表生存质量越高。记录两组的不良反应(皮痒、腹泻、脱发、血小板降低)发生情况。
1.7 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验,计数资料采用例(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组疗效比较
观察组的有效率高于对照组,差异有统计学意义(χ2=4.696,P=0.030)。见表1。
2.2 两组T淋巴细胞比较
如表2所示,治疗后与治疗前比较,观察组的CD3+、CD4+、CD4+/CD8+、NK 细胞升高,Treg细胞降低,差异有统计学意义(P<0.05);治疗后观察组的CD3+、CD4+、CD4+/CD8+、NK高于对照组,Treg细胞低于对照组,差异有统计学意义(t=5.086、7.214、5.073、5.159、11.228,均P=0.000)。
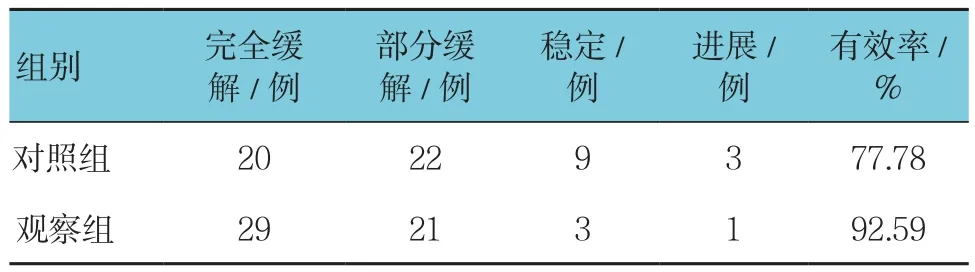
表1 两组疗效比较 (n =54)
表2 两组治疗前后 CD3+、CD4+、CD4+/CD8+、NK 细胞比较 (n =54,±s)

表2 两组治疗前后 CD3+、CD4+、CD4+/CD8+、NK 细胞比较 (n =54,±s)
组别 CD3+/% CD4+/% CD4+/CD8+ NK细胞/% Treg细胞/%对照组治疗前 61.14±5.81 31.03±3.38 1.10±0.33 18.02±4.31 9.37±2.80治疗后 59.76±6.39 30.71±3.92 1.07±0.29 17.84±5.09 9.04±2.53 t值 1.600 1.164 1.338 0.419 1.032 P值 0.113 0.247 0.184 0.676 0.261观察组治疗前 60.93±5.75 30.84±3.51 1.08±0.31 17.83±4.20 9.54±2.71治疗后 66.02±6.40 36.25±4.06 1.40±0.38 23.51±6.27 4.68±1.32 t值 3.920 7.134 4.495 5.433 12.335 P值 0.000 0.000 0.000 0.000 0.000
2.3 两组生存质量比较
观察组治疗后SF-36的各项评分较治疗前升高,且高于对照组,差异有统计学意义(t=2.259、3.774、4.219、3.712、2.441、2.950、3.449、2.615 和 3.762,P=0.000、0.000、0.000、0.000、0.016、0.004、0.001、0.010和0.000)。见表3。
2.4 两组不良反应比较
治疗过程中,观察组出现皮痒3例、腹泻5例、脱发2例、血小板降低1例,不良反应的发生率20.37%;对照组出现皮痒4例、腹泻11例、脱发4例、血小板降低2例,不良反应的发生率38.89%;观察组的不良反应发生率低于对照组,差异有统计学意义(χ2=4.441,P=0.035)。
表3 两组的生存质量比较 (n =54,±s)

表3 两组的生存质量比较 (n =54,±s)
组别 生理功能 情感职能 生理职能 精神健康 社会功能 躯体疼痛 活力 总体健康 SF-36评分对照组治疗前 59.01±9.83 60.93±8.52 53.06±6.81 63.70±8.54 58.54±9.51 61.24±7.81 59.74±8.81 56.03±9.11 59.94±8.70治疗后 58.92±9.14 59.43±7.46 51.99±6.16 62.81±7.40 57.98±8.60 60.95±6.93 58.06±9.15 55.49±9.73 58.14±7.92 t值 0.597 1.622 1.657 1.229 0.894 0.908 1.550 0.849 1.499 P值 0.552 0.108 0.101 0.222 0.373 0.366 0.124 0.398 0.068观察组治疗前 58.24±9.93 60.32±8.76 52.71±6.50 63.24±8.37 57.91±9.24 60.83±7.55 59.04±8.60 55.60±9.03 59.40±8.62治疗后 62.81±8.75 65.01±7.90 57.36±7.04 68.30±7.96 62.05±8.73 65.02±7.40 64.15±9.20 60.14±8.72 63.95±8.13 t值 3.093 3.545 4.333 3.855 2.971 3.608 3.565 3.243 3.442 P值 0.003 0.000 0.000 0.000 0.004 0.000 0.001 0.002 0.001
3 讨论
新生血管在肝癌的发病、发展、转移、侵袭、复发中具有重要作用,血管内皮生长因子(VEGF)是新生血管生长和转移的主要细胞因子,成纤维细胞生长因子(FGF)能与VEGF发挥协同作用,进一步促进血管生成[7]。索拉非尼是种多激酶抑制剂,能靶向作用于恶性肿瘤细胞及肿瘤血管上的苏氨酸激酶、丝氨酸、受体酪氨酸激酶等,一方面可抑制Fms样酪氨酸激酶3、干细胞因子受体及RAF/MEK/ERK途径,抑制恶性肿瘤细胞增殖;一方面可抑制血管内皮生长因子受体活性,抑制丝氨酸、苏氨酸激酶的生成,从而抑制肿瘤血管的生成,发挥抗肿瘤作用[8]。
康莱特注射液主要是由薏苡仁油组成,能阻滞肿瘤细胞G2+M时相细胞,降低G0、G1时相细胞,减轻S期细胞,抑制肿瘤细胞有丝分裂及增殖,还能上调肿瘤细胞P53基因的表达,及下调Bcl-2基因的表达,以诱导肿瘤细胞凋亡;还能通过血管的生成发挥抗癌作用;还能逆转肿瘤细胞对多种化疗药物的耐受性,与抗肿瘤药物发挥协同作用,进一步杀死肿瘤细胞;还能下调MCF7细胞MCU1基因的表达,发挥抗肿瘤转移作用。康莱特注射液对癌症化疗具有增效减毒作用。唐翠萍等[9]通过体外培养研究表明,康莱特注射液能提高紫杉醇治疗人乳腺癌的疗效,抑制VEGF相关因子的表达,阻止肿瘤血管的生成,降低肿瘤的侵袭能力。
晚期肝癌存在一定的免疫功能缺陷,血清中CD3+、CD4+、CD4+/CD8+、NK细胞的水平明显低于健康人群,而Treg细胞的水平明显升高[10]。Treg细胞是种抑制性T细胞,具有免疫抑制的特性,其机制包括Treg细胞能通过细胞毒T淋巴细胞相关抗原4(CTLA-4)、转化生长因子(TGF-β)、糖皮质激素诱导的肿瘤坏死因子受体(GITR)等作用于靶细胞上的受体,抑制IL-2的表达,发挥抑制效应T淋巴细胞增殖;还能分泌抑制性细胞因子(IL-4、IL-10、TGF-β等),参与免疫抑制作用[11]。本研究结果显示,观察组治疗后CD3+、CD4+、CD4+/CD8+、NK细胞提高,且高于对照组治疗后的水平,Treg细胞的水平明显降低。结果提示,康莱特注射液能有效改善晚期肝癌患者的T淋巴细胞的水平,有助于改善患者的免疫功能,与付鹏等[12]研究结果相似,付鹏等[12]研究对中晚期非小细胞肺癌患者在NP化疗治疗基础上,给予康莱特注射液治疗,改善了患者的T细胞亚群、免疫球蛋白、白细胞计数的水平,显著提高化疗的疗效。
随着分子生物技术的不断进步,患者的生存期明显延长,带瘤生存的生存质量逐步受到医患及社会的广泛关注。本研究结果发现,观察组治疗后SF-36评分明显改善,且高于对照组治疗后的水平,结果表明,康莱特注射液能有效提高晚期肝癌患者的生存质量,其可能的机制与康莱特注射液改善免疫功能相关。王艳等[13]研究对老年中晚期结直肠癌患者在替吉奥治疗基础上,给予康莱特联合治疗,发挥明显的增效减毒作用,改善患者的生存质量及免疫功能,与本研究具有相似的效果,进一步肯定康莱特注射液在肝癌治疗中的价值。
综上所述,康莱特能显著改善晚期肝癌患者T细胞亚群的水平,提高生存质量,提高临床治疗效果。
