硫化氢对顺铂诱导近端肾小管上皮细胞凋亡的干预研究*
2018-09-17杨波倪倩朱艳赵欢顺杨成段绍斌蒋云生
杨波,倪倩,朱艳,赵欢顺,杨成,段绍斌,蒋云生
(1.南华大学附属第一医院 肾内科,湖南 衡阳 421001;2.长沙医学院 临床系,湖南 长沙 410219;3.中南大学湘雅二医院 肾内科,湖南 长沙 410011)
硫化氢(sulfuretted hydrogen,H2S)目前被誉为除一氧化氮和一氧化碳的体内第3种气体分子,其在多种生理病理过程中担任着重要的角色,具有调节突触活动、舒张血管及抑制红细胞氧化等重要生理功能。H2S可直接清除过氧化氢和超氧阴离子,具有强大的抗氧化功能。在机体内,H2S的功能多样,包括对抗化学性损伤,抑制化学性损伤所致心肌细胞和神经细胞的凋亡作用[1]。
顺铂(Cisplatinum,DDP)是广泛用于人类肿瘤化疗的一种药物,其抗肿瘤细胞作用主要是因为其与增值细胞DNA的结合特性。然而顺铂又与许多正常细胞有亲和性,从而导致毒性,比如肾毒性、神经毒性、耳毒性、催吐性[2-3],故其在化疗治疗中因其诸多的副作用被限制使用。而在这些副作用中,肾毒性被认为是限制其临床应用的主要方面[4-5]。使用高剂量顺铂化疗患者,20%出现肾功能不全,顺铂导致的肾毒性主要表现在小管间质性损害[2-3]。在动物模型中,顺铂主要损害近端小管。由于顺铂在肿瘤化疗中的重要地位,有很多研究寻找相应保护方法以减轻其肾毒性。在临床前期研究中,提示抗氧化剂可以减少顺铂导致的肾毒性。
H2S对于顺铂导致的近端肾小管上皮细胞(human renal tubular epithelial cell,HK-2细胞)是否有保护作用,目前尚未见报道。本实验用H2S进行干预,探索其对HK-2细胞是否有抗凋亡的作用,以寻求抗细胞凋亡的新途径。
1 材料与方法
1.1 材料
正常人近端肾小管上皮细胞株(HK-2细胞)(美国ATCC公司),胎牛血清为四季青(浙江天杭生物科技股份有限公司),DMEM/F12培养基(美国Hyclone公司),二甲基亚砜(Dmethyl sulfoxide,DMSO)(美国Sigma公司),顺铂为诺欣(江苏豪森药业股份有限)公司,硫氢化钠NaHS(上海紫一试剂厂)。噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT](美国Amresco公司),Annexin V-FITC/PI试剂盒(上海前程生物科技有限公司),4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色试剂盒(上海碧云天生物技术有限公司),6、24和96孔细胞培养板(美国Coring公司)。
1.2 方法
1.2.1 DDP、NaHS的配置 将DDP配制成1 mg/ml溶液,过滤除菌分装,置入-20℃冰箱冷冻保存备用。将NaHS配制成16 mmol/L溶液,过滤除菌分装,-20℃冰箱保存备用。
1.2.2 MTT实验 ①阴性对照组:加入等体积培养基;DDP组:0、1、2、5、10、20和40 mg/L;DDP+NaHS组:0 mg/L DDP+0 mmol/L NaHS、20 mg/L DDP+0 mmol/L NaHS、20 mg/L DDP+0.2 mmol/L NaHS、20 mg/L DDP+0.4 mmol/L NaHS、20 mg/L DDP+0.5 mmol/L NaHS、20 mg/L DDP+0.8 mmol/L NaHS、20 mg/L DDP+1.0 mmol/L NaHS、20 mg/L DDP+2.0 mmol/L NaHS。②将生长至对数期HK-2细胞调整密度为1×104个/ml。③加入96孔板,每孔100 μl,阴性对照组(加入等体积培养基)设置调零孔,对照孔,边缘使用PBS填充。④在5%二氧化碳CO2,37℃培养,至细胞单层铺满孔底(24 h),加入上述梯度浓度药物,每孔100 μl,设立5个复孔。⑤每孔加入10 μl MTT溶液(5 mg/ml),继续培养4 h。⑥终止培养,吸弃孔内培养液,使用PBS清洗2、3遍。⑦每孔加入100 μl DMSO,酶联免疫检测仪测量各孔的光密度(optical density,OD)值。细胞存活率(%)=(实验孔OD均值-空白孔OD均值)/(对照孔OD均值-空白孔OD均值)×100%。
1.2.3 DAPI、Annexin V/PI染色检测HK-2细胞形态学变化 ①调整HK-2细胞密度为1×105个/ml,接种于24孔板(板底铺盖玻片),每孔1 ml。②待细胞贴壁后,根据实验分组,予以不同干预,设3个复孔,培养24 h。③吸弃上清,使用PBS清洗3遍。④使用双蒸水稀释,将5×Binding Buffer稀释为1×Binding Buffer工作液,每孔加500 μl工作液重悬细胞。⑤每孔加入 2.5 μl Annexin V-FITC 和 5 μl PI,1 μl DAPI。⑥轻柔涡旋混匀,室温避光5 min。⑦使用荧光显微镜观察。
1.2.4 Annexin V-FITC/PI流式细胞术检测细胞凋亡率 ①调整HK-2细胞密度为5×105个/ml,接种于6孔板,每孔2 ml。②待细胞贴壁后,根据实验分组,予以不同干预,并设置不加干预因素的流式对照,一组无染色剂,一组只有Annexin V-FITC,一组只加PI,每组设3个复孔,培养24 h。③培养结束,使用胰酶消化,1 000 r/min离心5 min,弃上清,使用PBS清洗2遍。④使用双蒸水稀释,将5×Binding Buffer稀释为1×Binding Buffer工作液,每管加500 μl工作液重悬细胞,调整细胞密度为5×105个/ml。⑤每管加入2.5 μl Annexin V-FITC和5 μl PI。⑥轻柔涡旋混匀,室温避光5 min。⑦进行流式细胞术分析。
1.3 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,采用单位因素方差分析,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组的OD值比较
使用0~40 mg/L顺铂对细胞进行处理,结果显示:各组的OD值比较,差异有统计学意义(F=7.969,P=0.000)。20 mg/L DDP组与阴性对照组比较,差异有统计学意义(t=3.640,P =0.007)。而加用NaHS后,细胞的OD值有所上升,呈剂量改变,在NaHS为0.5 mmol/L时差异有统计学意义(t=-4.741,P =0.001)。但当NaHS浓度为0.5~1.0 mmol/L,3组间OD值差异无统计学意义(t=0.024,P =0.977)。当NaHS为2.0 mmol/L时,OD值较1.0 mmol/L下降(t=3.785,P =0.005)。
2.2 各组HK-2细胞凋亡比较
荧光显微镜下,20 mg/L DDP和HK-2细胞作用24 h后,出现凋亡小体,表现为核固缩,核碎裂,形成大小不等的染色小体,但其包膜完整。DAPI染色即显示出染色加深,Annexin-V FITC将凋亡细胞细胞膜染色成绿色(早期凋亡),PI可将核染色成红色(晚期凋亡)。当加入NaHS后,与DDP组比较,凋亡细胞减少,成剂量依赖性,浓度越大,凋亡细胞越少。20 mg/L DDP组平均凋亡细胞,与阴性对照组比较差异有统计学意义(t=-14.130,P =0.000)。加入NaHS后,随浓度上升凋亡细胞减少,1.0 mmol/L NaHS+20 mg/L DDP组与20 mg/L DDP组比较差异有统计学意义(t=11.121,P =0.000)。见图1、2和表1。
2.3 各组细胞凋亡率比较
活细胞FITC/PI均为低染(位于左下区),凋亡细胞FITC高染而PI低染(位于右下区),坏死细胞FITC/PI均高染(位于右上区)。DDP组凋亡率与阴性对照组比较,差异有统计学意义(t=11.121,P =0.000)。DDP组高于阴性对照组。加NaHS后,凋亡率下降,差异有统计学意义(t=9.320,P =0.001)。随着NaHS浓度增大,凋亡率降低,20 mg/L DDP+1.0 mmol/L NaHS组与20 mg/L DDP+0 mmol/L NaHS组比较,凋亡率差异有统计学意义(t=4.568,P =0.010)。见表2和图3。

图1 NaHS、DDP对HK-2细胞凋亡的影响 (DAPI染色×400)
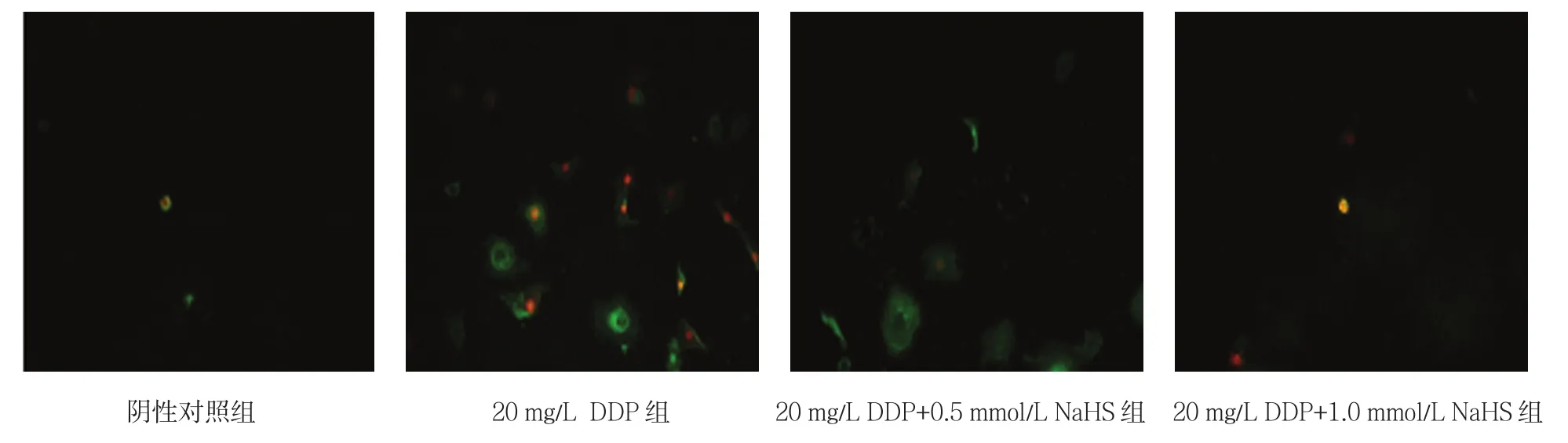
图2 NaHS、DDP对HK-2细胞凋亡的影响 (Annexin V/PI染色×400)
表1 DDP、NaHS对HK-2细胞凋亡的影响(n=8,个,±s)
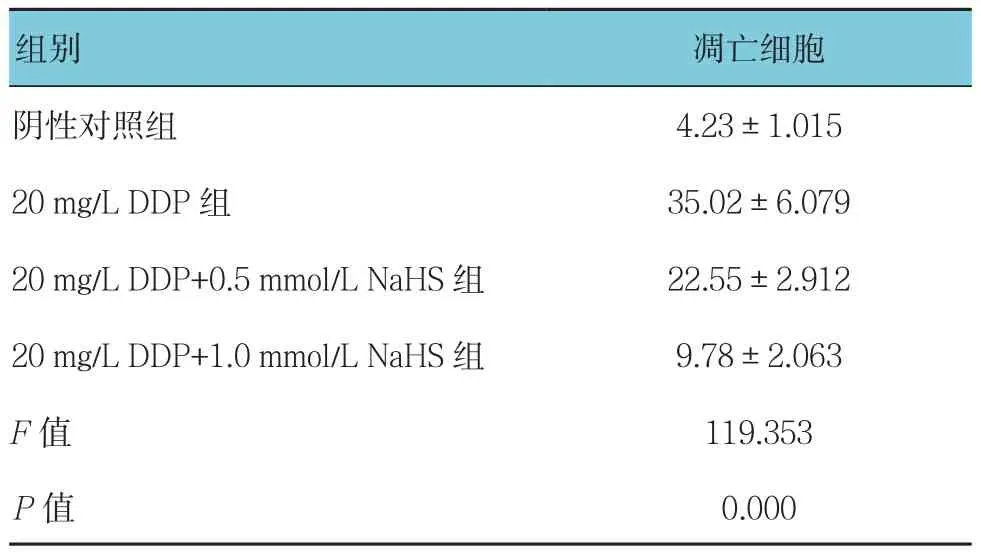
表1 DDP、NaHS对HK-2细胞凋亡的影响(n=8,个,±s)
组别 凋亡细胞阴性对照组 4.23±1.015 20 mg/L DDP组 35.02±6.079 20 mg/L DDP+0.5 mmol/L NaHS组 22.55±2.912 20 mg/L DDP+1.0 mmol/L NaHS组 9.78±2.063 F值 119.353 P值 0.000
表2 NaHS、DDP对HK-2细胞增殖的影响(n=3,±s)

表2 NaHS、DDP对HK-2细胞增殖的影响(n=3,±s)
组别NaHS/(mmol/L)凋亡率/%阴性对照组 0 5.167±0.612 20 mg/L DDP组 0 31.598±1.014 20 mg/L DDP+0.5 mmol/L NaHS组 0.5 18.375±2.239 20 mg/L DDP+1.0 mmol/L NaHS组 1.0 11.636±1.233 F值 193.344 P值 0.000

图3 NaHS、DDP对HK-2细胞凋亡的影响
3 讨论
肾脏疾病作为多发病和常见疾病,有很高的患病率。有最新的流行病学资料显示,我国慢性肾脏病(chronic kidney disease,CKD)患病率为10.8%。原发或继发性因素引起急性或慢性肾损伤。当病程超过3个月,则变为不可逆的慢性肾衰竭。WHO称每年新增肿瘤患者1 400万。20世纪70年代以来,DDP已被广泛用于治疗多种恶性肿瘤,其中包括睾丸癌、膀胱癌、宫颈癌、卵巢癌、头颈部恶性肿瘤,以及小细胞和非小细胞肺癌等,是治疗实体肿瘤最有效和常用的临床药物之一。但由于对正常组织中的严重不良反应常限制了其临床应用。DDP不良反应有肾毒性、耳毒性、骨髓抑制、胃肠道毒性、变态反应等[6-7],其中肾毒性最常见,约1/3患者出现急性肾损伤[6,8-9],其剂量相关的肾毒性极大限制了临床应用。肾脏毒性主要发生在肾脏近端小管上皮细胞,神经毒性主要影响神经上下级,耳毒性主要影响耳蜗中掌握机械感觉的外毛细胞。这些都大大限制了DDP的应用。肾脏损伤常常发生于使用标准处方量的DDP治疗几天后[10-14],血清肌酐和血清尿素氮水平有所增加。这种肾脏损害可以导致阳离子的浪费,进而发生糖尿和蛋白尿。DDP治疗过程中最常发生的并发症是低镁血症。在持续DDP治疗中,可能会发生进展性和永久性肾脏损害。目前有不少学者正在研究DDP的肾毒性发生机制,寻找防治方法及药物。
H2S是一种有毒气体,其无色、易溶于水,带有特殊气味。其在1777年由一个年轻的瑞典药商命名,在后来的几百年都被认为是一种有毒的气体。它的最大暴露值(PEL)为10 ppm,当浓度<400 ppm时可以导致人骤然死亡。现在H2S被认为是第3种气体分子。半胱氨酸的脱巯基酶是哺乳动物H2S的主要来源。该过程是被CBS和CSE催化。CBS在大脑中的很多区域表达,特别是中枢神经系统[15-16]。而CSE主要在循环系统表达[17]。文献指出,H2S对神经系统保护[18-19]、循环系统保护[20-21]都有很多作用。H2S被认为的主要机制是抗氧化作用,这也是研究的一大热点。H2S是强大抗氧化剂,可保持内环境稳定,有时也是强大的促氧化剂,可以通过ROS活化杀灭肿瘤细胞[22]。它被发现有两个截然不同的分子机制,抗氧化性和促氧化性,而表现出哪个方面,取决于当时的内环境。简单归纳说,H2S可以表现出很多益处,比如对心血管系统的保护作用。而更深层次地说,还可以表现出毒性/细胞毒性效应。
通过研究发现,H2S参与氧化应激效应并不是通过单纯的机制,其中有多种信号通路参与。H2S可以通过多种酶类或者非酶类的抗氧化剂清除自由基。H2S也会抑制线粒体ROS产生,通过抑制p66Shc巯基。也可以通过它的化学特性减少氧自由基,其机制十分复杂。
本实验MTT比色法检测DDP的浓度与HK-2细胞培养,随DDP浓度上升,OD逐渐下降,示细胞凋亡增加,发现在DDP为20 mg/L时,细胞生长被抑制,显示DDP对HK-2细胞的毒性作用,随剂量增加而加重,与剂量呈正相关。在DDP为20 mg/L联合使用NaHS后,细胞凋亡减少,并且NaHS上升后,细胞凋亡逐渐减少。提示H2S可以减轻DDP对细胞的毒害,并且与浓度有关。但在NaHS<1 mmol/L时,对HK-2细胞的保护作用下降,NaHS保护作用下降的机制有待进一步研究。
在DAPI染色和Annexin V-FITC/PI染色,早期凋亡会出现细胞膜被染成绿色,晚期凋亡则是胞核也可以被染成红色。实验显示见DDP组的细胞凋亡率高于阴性对照组,在加用NaHS后,凋亡率有所下降,并且与剂量相关。Annexin V-FITC/PI流式细胞术可更准确地反映凋亡情况,可在不同象限更直观精确地反映。在流式细胞术中,可以明显看见DDP组凋亡,而加用NaHS后,凋亡明显减少,呈剂量依赖性。
氧化还原系统的平衡,对细胞的生存能力和功能有至关重要的作用,是由两个抗氧化系统组成(谷胱甘肽系统和硫氧还蛋白系统)组成的。活性氧系列是细胞新陈代谢正常副产物,比如线粒体新陈代谢或者蛋白质折叠均可产生。硫氧还原蛋白系统,包括硫氧还原蛋白、硫氧还蛋白还原酶(TrxR)和烟酰胺腺嘌呤二核苷酸磷酸(NADPH),在细胞氧化还原信号转导里扮演着一个重要的角色生长和细胞凋亡。除了氧化还原调控胞内信号,系统也发挥其直接抗氧化防御氧化应激,包括清除活性氧(ROS),减少过氧化物和内源性抗氧化剂回收。DDP导致的细胞凋亡和ROS导致的p53活化有关,而H2S也会抑制线粒体ROS产生,通过抑制p66Shc巯基。但是H2S是否是通过这个通路来抑制DDP对细胞的毒性,仍需进一步研究。当NaHS浓度<1 mmol/L时,对细胞的保护作用下降,可能与此有关。
DDP导致的肾损伤机制涉及多种途径,如炎症介质、氧化应激、坏死及凋亡、自噬等,目前仍不清楚这些因素最终整合导致肾损伤的具体机制。本实验显示H2S对DDP导致的HK-2细胞凋亡有保护作用,但是在人体内,机制仍不清楚。且需要考虑内源性H2S的作用及药物的分布等。因此对于其进一步应用,须继续大量体外及体内实验观察。进一步研究既保护正常组织,又不影响DDP抗肿瘤治疗的方法,将有助于DDP在临床抗肿瘤治疗中的广泛应用。
