FGF2通过MAPK信号通路影响奶牛乳腺分支形态变化
2018-09-15崔英俊于广璞汤云飞
崔英俊,于广璞,汤云飞,孙 喆,张 莉
(东北农业大学生命科学学院,哈尔滨 150030)
乳房腺体由具有分支形态的腺体小叶构成。妊娠早期乳腺分支阶段短侧枝形成,为分泌腺泡提供发育平台[1]。妊娠期腺泡细胞数量和功能分化决定后续产奶能力,分支形态发生是腺泡发育和泌乳前提。
乳腺分支体外研究普遍使用三维培养,有利于研究乳腺组织体内发育、形态发生和细胞外基质信号传导。Ⅰ型胶原是细胞外基质主要成分,在三维培养时为组织提供力学环境,参与细胞信号传导,增加相关乳蛋白合成持续性,还可保存和运输细胞外基质分泌的生长因子以应对组织损伤修复[2]。碱性成纤维细胞生长因子(Fibroblast growth factor 2,FGF2)作为公认的诱导分支形态发生的细胞因子,广泛用于三维培养。
20世纪90年代,学者利用雌性小鼠乳腺类器官,使用I型胶原并添加相关细胞因子作三维培养,在体外重现乳腺导管发育后,该培养模型广泛用于研究肺、唾液腺、肾脏、血管和乳腺导管发育[3]。在国内研究中,该培养模型多应用于肺[4]、胰腺[5]、骨髓间充质干细胞培养[6],关于乳腺组织应用鲜有报道。以往乳腺分支研究多以小鼠为主,无法代替反刍动物乳腺分支情况。为明确FGF2诱导奶牛乳腺分支过程中涉及信号通路,本文利用青春期奶牛乳腺类器官作三维培养,利用FGF2诱导类器官分支,确定FGF2在奶牛乳腺分支过程中起作用的信号通路。
1 材料与方法
1.1 材料
1.1.1 乳腺组织
采集无菌新鲜健康青春期荷斯坦奶牛乳腺组织,无菌生理盐水保存并迅速带回实验室。
1.1.2 主要试剂
Ⅳ型胶原酶购自VETEC公司;鼠尾Ⅰ型胶原购自Solarbio公司;DMEM/F12,FGF2,PD173074(FGFR1受体抑制剂), LY-294002(PI3K/AKT通路抑制剂),U0126(MAPK/ERK通路抑制剂),ITS,DnaseⅠ内切酶等购自Gibco公司;一抗p-AKT、 AKT、p-ERK、 ERK、 GAPDH 购 自 CELL SIGNALING公司,RIPA(强)裂解液购自上海碧云天公司。
1.2 方法
1.2.1 奶牛乳腺类器官获得及三维培养
将新鲜健康青春期荷斯坦奶牛乳腺组织剪成小块,加入DMEM/F12溶液(含1 mg·mL-1Ⅳ型胶原酶),37℃消化3 h,过滤。将滤液分装在预铺好2.5%BSA离心管中,1 500 r·min-1离心15 min,沉淀中加入2 000 U·mL-1的DnaseⅠ混匀静置5 min,重悬细胞沉淀,放入离心机中1 500 r·min-13~4 s,收集沉淀,对类器官计数。
在24孔板上预铺Ⅰ型胶原(pH 7.0~7.5),待Ⅰ型胶原完全凝固后,将类器官与Ⅰ型胶原(终浓度为3 mg·mL-1)混匀(1 000个类器官·mL-1Ⅰ型胶原),加入预铺24孔板。待完全凝固后,按照不同组别加入培养基。对照组培养基为含1%双抗,1%ITS的DMEM/F12培养基;FGF2组培养基在对照组基础上加入FGF2(终浓度50 ng·mL-1)。FGF2+PD173074组、FGF2+LY-294002组及FGF2+U0126组培养基则在FGF2组基础上分别加入PD173074(FGFR1抑制剂,10μmol·mL-1)、LY-294002(PI3K 抑制剂,10 μmol·mL-1)、U0126(MAPK/ERK抑制剂,10μmol·mL-1),置于37℃、5%CO2培养箱中培养84 h。随后用DFC280倒置相差显微镜观察类器官形态并拍照,每组随机挑选放大倍数为40倍的3个视野,每个视野内类器官总数均大于50个,计数。分支率计算公式:分支形态类器官/类器官总数×100%。
1.2.2 Western blot检验通路蛋白
D'Hank清洗孔板,每孔加RIPA裂解液100μL,4℃摇床过夜,之后14 000 r·min-1离心15 min,取上清。加入上样缓冲液,100℃加热10 min后超声3次,每次15 s。样品置于-80℃保存。SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)后,将蛋白湿转至NC膜。用TBST洗膜,5%脱脂乳封闭。一抗4℃孵育过夜;二抗37℃孵育1~1.5 h。超敏发光液曝光。
1.2.3 数据分析
使用Image Pro Plus 6.0图像分析软件对Western Blot结果扫描并作灰度分析;采用SPSS19.0软件对数据作单因素方差分析和显著性检验,每组3次重复,结果用“平均值±标准误(Mean±SEM)”表示,不同小写字母表示差异显著(P<0.05)。
2 结果与分析
2.1 奶牛乳腺三维培养形态学观察
对照组、FGF2组、FGF2+PD173074组、FGF2+LY-294002组、FGF2+U0126组作形态学观察,发现对照组、FGF2+PD173074组和FGF2+U0126组在84 h时无明显分支形态变化(见图1A、C、E)而FGF2组和FGF2+LY-294002组在培养84 h时具有分支形态学变化(见图1B、D箭头处)。
2.2 奶牛乳腺三维培养中分支率计算
计算各组分支率后,可知FGF2组在84 h时,分支率显著高于对照组(P<0.05);FGF2+LY294002组在84 h时,分支率显著高于对照组但低于FGF2组(P<0.05);对照组、FGF2+PD193074组和FGF2+U0126组在84 h时分支率无显著差异(P>0.05)(见图2)。

图1 84 h时奶牛乳腺类器官在三维培养中形态学变化Fig.1 Morphogenesischangeof dairy cow mammary organoidsin three-dimensional cultureat 84 h
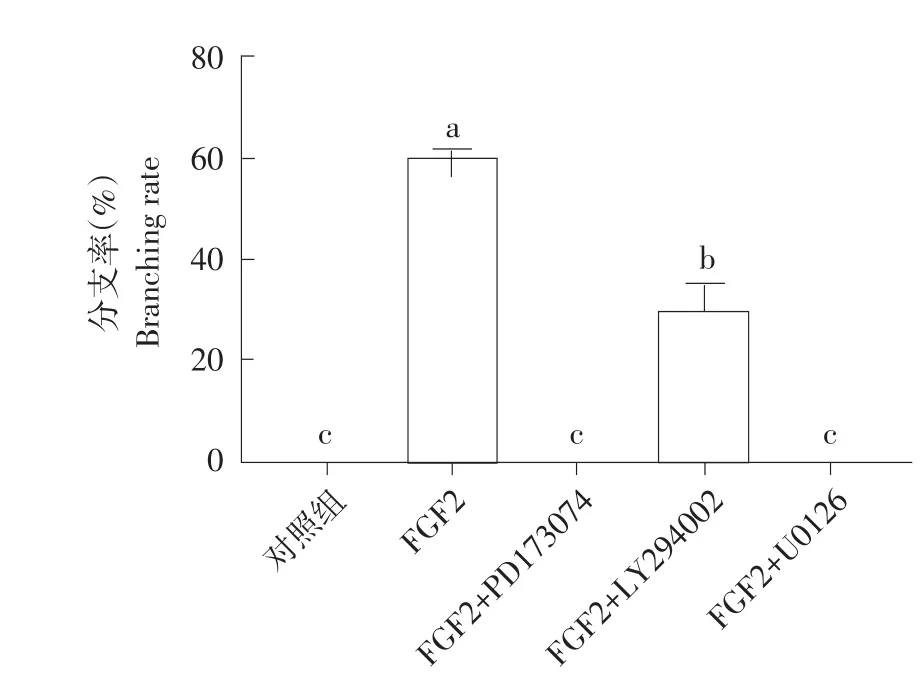
图2 奶牛乳腺类器官在三维培养中84 h时分支率Fig.2 Branching rateof dairy cow mammary organoids in three-dimensional cultureat 84 h
2.3 信号通路蛋白表达
0、15、60、240和600 min时各组AKT和ERK蛋白表达如图3、4、5所示,各组在各检测点AKT和ERK蛋白总量无显著差异(P>0.05)。p-ERK和p-AKT蛋白表达如图6、7所示。Western blot结果表明,FGF2组p-AKT和p-ERK蛋白在0 min均未表达,但随培养时间延长p-AKT和p-ERK蛋白表达不断升高(见图6、7)。与FGF2组相比,FGF2+PD173074组p-ERK蛋白在0、15和60 min时无显著差异,240和600 min时p-ERK蛋白表达显著降低(P<0.05)(见图7);而p-AKT蛋白各时间点表达均显著降低(P<0.05)(见图6)。与FGF2组相比,FGF2+LY-294002组p-ERK蛋白随培养时间延长,表达均显著降低(P<0.05);但在600 min时表达量显著高于FGF2+U0126组和FGF2+PD173074组(P<0.05)(见图7)。FGF2+LY-294002组p-AKT相对表达水平在各时间点均显著低于FGF2组(P<0.05)(见图6)。与FGF2组相比,FGF2+U0126组p-ERK蛋白表达在各时间点均显著降低(P<0.05)(见图7);FGF2+U0126组p-AKT蛋白表达在各时间点均显著低于FGF2组(P<0.05),但均显著高于FGF2+LY-294002组和FGF2+PD173074组(P<0.05)(见图6)。

图3 AKT和MAPK信号通路主要蛋白表达Fig.3 Expression of major proteinsin AKT and MAPK signaling pathways
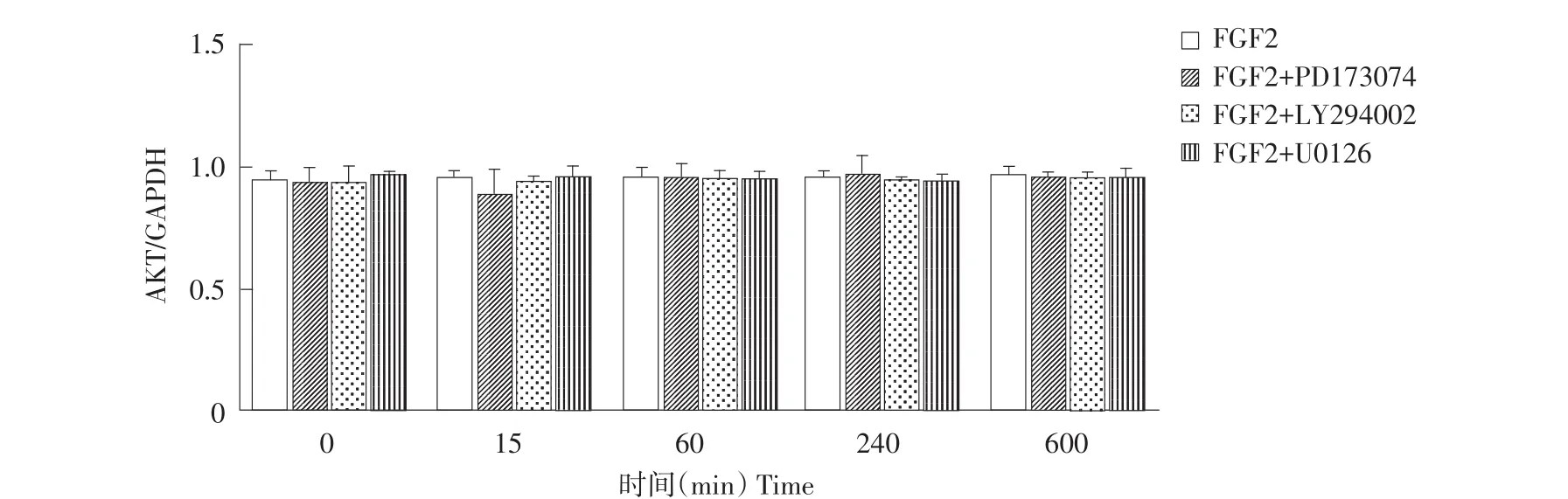
图4 不同时间点AKT蛋白相对表达量Fig.4 Protein expression of AKT in different time point

图5 不同时间点ERK蛋白相对表达量Fig.5 Protein expression of ERK in different timepoint
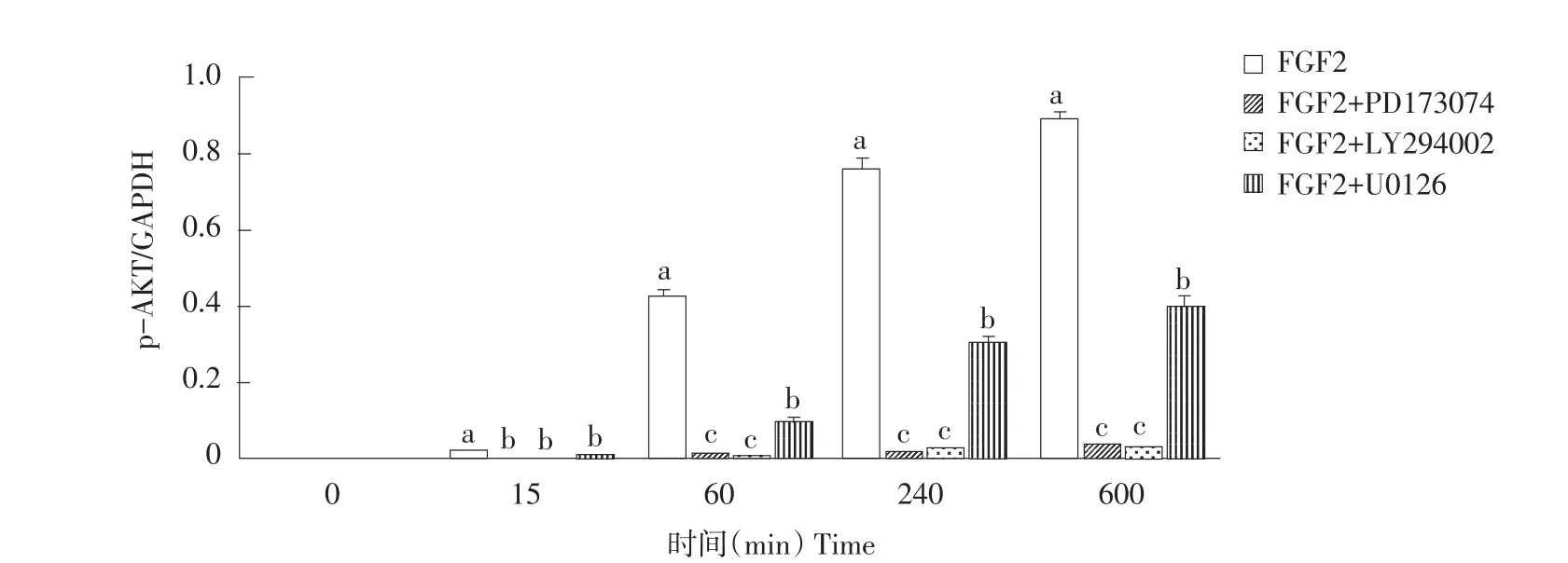
图6 不同时间点p-AKT蛋白相对表达量Fig.6 Protein expression of p-AKT in different timepoint
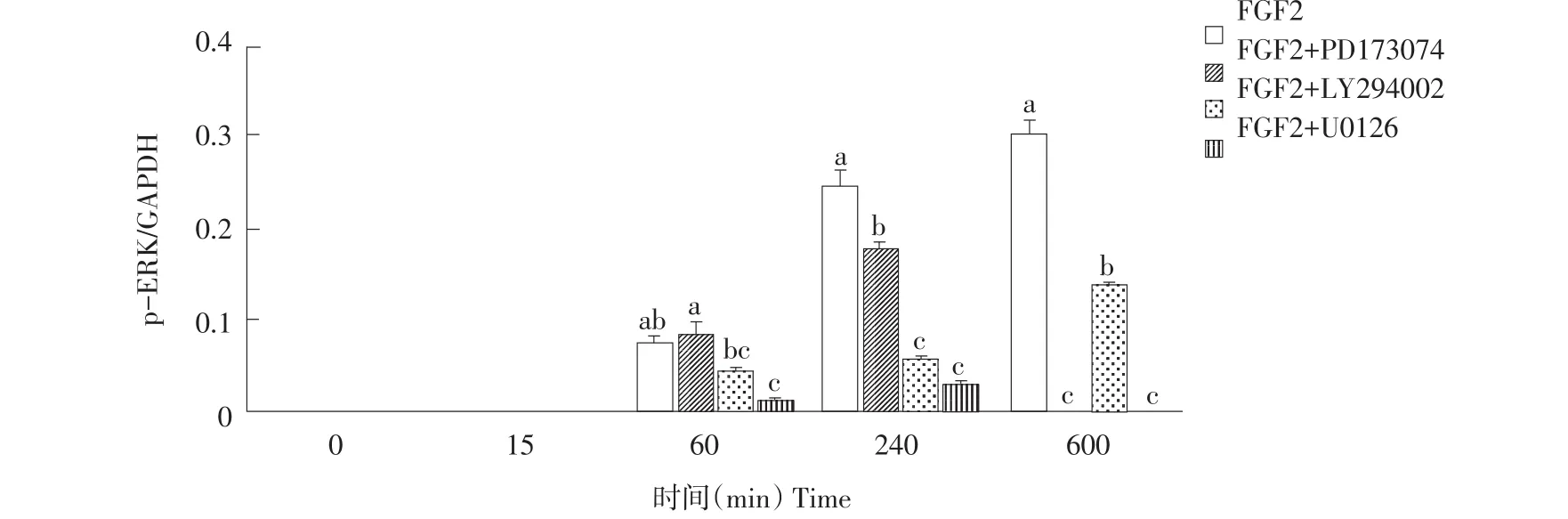
图7 不同时间点p-ERK蛋白相对表达量Fig.7 Protein expression of p-ERK in different time point
3 讨论
3.1 FGF2对奶牛乳腺分支作用
FGF2可促进细胞分裂增殖[7],参与包括小鼠乳腺上皮[8]、肺上皮[9]、唾液腺上皮[10]等多种组织分支形态发生。FGF2在乳腺导管上皮细胞、肌上皮细胞和腺泡上皮细胞中均有表达[11]。FGF2与乳腺分支形成密切相关,可控制小鼠乳腺导管延长,促进乳腺发育过程中细胞增殖和乳腺上皮扩张[12]。但FGF2对奶牛乳腺上皮分支作用未见报道。
本研究利用鼠尾Ⅰ型胶原镶嵌法对奶牛乳腺类器官三维培养,发现在FGF2作用下,与对照组相比,奶牛乳腺类器官84 h发生明显分支形态学变化,且分支率显著高于对照组,说明FGF2可使奶牛乳腺分支形成,与Kashimata等利用小鼠乳腺作三维培养结果一致[13]。
3.2 FGFR1对FGF2调节奶牛乳腺分支形态发生作用
FGF2受体为四种FGF受体酪氨酸激酶:FGFR1、FGFR2、FGFR3、FGFR4。在青春期小鼠末端乳芽和乳腺导管上皮切片中,通过原位杂交可检测Fgfr1和Fgfr2RNA,但无Fgfr3和Fgfr4RNA表达[14]。Pond等研究表明,FGF受体(FGFR1和FGFR2)缺失导致有缺陷乳腺分支形态发生[15]。本研究在添加PD193074(FGFR1抑制剂)后,发现84 h时FGF2+PD193074组无明显分支形态发生,分支率显著低于FGF2组。通路蛋白检测中同样发现,FGF2+PD193074组p-ERK和p-AKT蛋白表达显著低于FGF2组。因此推断,FGF2在调节奶牛乳腺分支形态发生过程中,以FGFR1为主要结合受体。
3.3 MAPK通路对FGF2调节奶牛乳腺分支形态发生作用
FGF2与其受体结合后,一种途径是激活Raf/MAPK,Raf将信号转递给ERK1/2,活化ERK1/2将信号传递给核糖体激酶P90S6K和P70S6K,活化核糖体S6入核参与蛋白合成;另一个途径是激活AKT,将信号传递给JNK和ERK1/2,同样刺激核糖体活化,参与蛋白合成[16]。MAPK信号通路调节细胞增殖,分化,凋亡和细胞迁移[17];AKT信号通路调节细胞存活、代谢、增殖、迁移[18]。在果蝇气管形成、小鼠颌下腺分支形态发生及小鼠乳腺试验中均证实MAPK信号通路与形态学发生有关[19]。可见在不同组织中,MAPK通路在分支形态形成过程中均为保守重要节点。目前MAPK通路调节分支延伸具体机制尚不清楚。本研究结果表明,在U0126抑制p-ERK蛋白表达时,84 h时FGF2+U0126组奶牛乳腺类器官分支率显著低于FGF2组和FGF2+LY-294002组,但与对照组相比差异不显著,证明MAPK/ERK信号通路是决定奶牛乳腺分支形态发生主要途径。
AKT和AKT下游JNK促进ERK1/2活化[20],由此推断PI3K/AKT信号通路可能通过影响ERK活化影响奶牛乳腺分支形态。本研究结果发现,当LY-294002抑制p-AKT蛋白表达时,FGF2+LY-294002组的p-ERK蛋白表达显著高于FGF2+U0126组但低于FGF2组,表明LY-294002可能影响ERK磷酸化;形态学观察发现,FGF2+LY-294002组奶牛乳腺分支率显著高于对照组但低于FGF2组,表明PI3K/AKT信号通路可能影响奶牛乳腺分支形态。当U0126发挥作用时,即使p-AKT蛋白表达显著高于FGF2+LY-294002组,此时培养的奶牛乳腺类器官在形态学上并未观察到明显分支,说明PI3K/AKT信号通路并非奶牛乳腺分支形态产生主要途径,推测其单独作用难以影响奶牛乳腺分支形成。
4 结论
综上所述,利用FGF2在Ⅰ型胶原中成功刺激奶牛乳腺类器官产生分支结构。通过形态学观察和信号通路蛋白检测,明确FGF2通过FGFR1受体激活MAPK/ERK信号通路,对奶牛乳腺分支形成发挥作用。MAPK信号通路为FGF2调节奶牛乳腺分支形态发生主要信号通路。
