胃肠道手术后肠内营养支持与肠外营养支持应用效果比较
2018-09-14饶思琪重庆医科大学附属第一医院胃肠外科重庆400016
饶思琪(重庆医科大学附属第一医院胃肠外科,重庆400016)
随着我国经济技术的快速发展,居民生活水平得到不同程度的改善,与此同时,人们的生活节奏不断加快,生活压力不断增大,饮食不规律、休息欠佳、暴饮暴食等屡见不鲜,受各种原因的综合影响,胃肠道疾病患者越来越多[1]。胃肠道疾病的种类较多,而受患者病情严重性和复杂性影响,临床需要采用手术治疗的患者比例不断增长。胃肠道手术患者围手术期营养支持对患者术后恢复具有重要作用,对此,需选择一种安全、有效的营养支持,以保障患者的治疗效果[2-3]。目前,肠内、外营养支持均可有效改善患者的营养状况[4],本研究对胃肠道手术患者采取肠内营养支持与肠外营养支持的应用效果进行比较,现报道如下。
1 资料与方法
1.1 一般资料 选取本院2015年2月至2017年2月收治的胃肠道手术患者160例作为研究对象,将其随机分为研究组和对照组,每组80例。研究组中女32例,男 48例;年龄 19~74岁,平均(57.5±3.4)岁;疾病类型胃癌40例,结直肠癌30例,其他类型疾病10例。对照组中女35例,男45例;年龄18~75岁,平均(58.3±3.6)岁;疾病类型胃癌42例,结直肠癌29例,其他类型疾病9例。2组患者均无肝肾等脏器功能异常情况,也没有严重的心肺等脏器疾病情况。2组患者在性别、年龄等一般资料方面比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 营养支持方法
1.2.1.1 对照组 对照组患者应用肠外营养支持,采取静脉滴注方式补充营养,常规控制饮食,食用低盐、低磷、高蛋白食物。其肠外营养支持的非蛋白热量约为25 kcal/(kg·d),氮水平约为0.2 g/(kg·d);胰岛素水平约为 6~8 g/U,糖和脂肪的比例约为(1~2)∶1,选择长链脂肪乳、氨基酸注射液作为氮源,在其中加入适量的微量元素和维生素对患者进行补充。以静脉注射的方式对患者进行缓慢注射,用药同时可按照患者实际情况进行营养元素的略微调整。
1.2.1.2 研究组 研究组患者应用肠内营养支持,其营养支持量基本和对照组相同,于手术后6 h内开始实施,上消化道手术患者放置空肠穿刺造口管,下消化道手术患者放置鼻胃管或鼻肠管,利用肠内营养泵输入营养剂。每天给予患者的营养量大约为食物纤维7.5 g,矿物质 3.0 g,氮 3.2 g,碳水化合物 61.5 g,脂肪 19.5 g;手术后第1天给予1/3量约500 mL营养剂,手术后第2天给予一半量约1 000 mL,手术后第3天及之后可给予全量;此期间不需要辅助肠外营养。患者生命体征平稳后,给予患者氨基酸型肠内营养制剂;术后4 d给予患者素型肠内营养制剂;术后5~6 d给予整蛋白型肠内营养制剂;术后8 d给予患者半流质饮食。
1.2.2 评价标准 (1)观察、对比2组患者总胆固醇、前清蛋白、总蛋白、高密度脂蛋白、低密度脂蛋白、淋巴细胞、肌酐、尿素、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-10、IL-6、IL-1β 等临床指标;按照组别对 2组患者营养支持前,营养支持后1、3、5 d的指标水平进行统计,并进行组间比较。(2)观察、对比2组患者胃肠功能恢复时间、退热时间、通气时间及术后住院时间[5]。(3)观察2组出现院内感染的例数,并对其比例进行统计比较[6]。
表1 2组患者治疗前、后临床指标比较(±s)
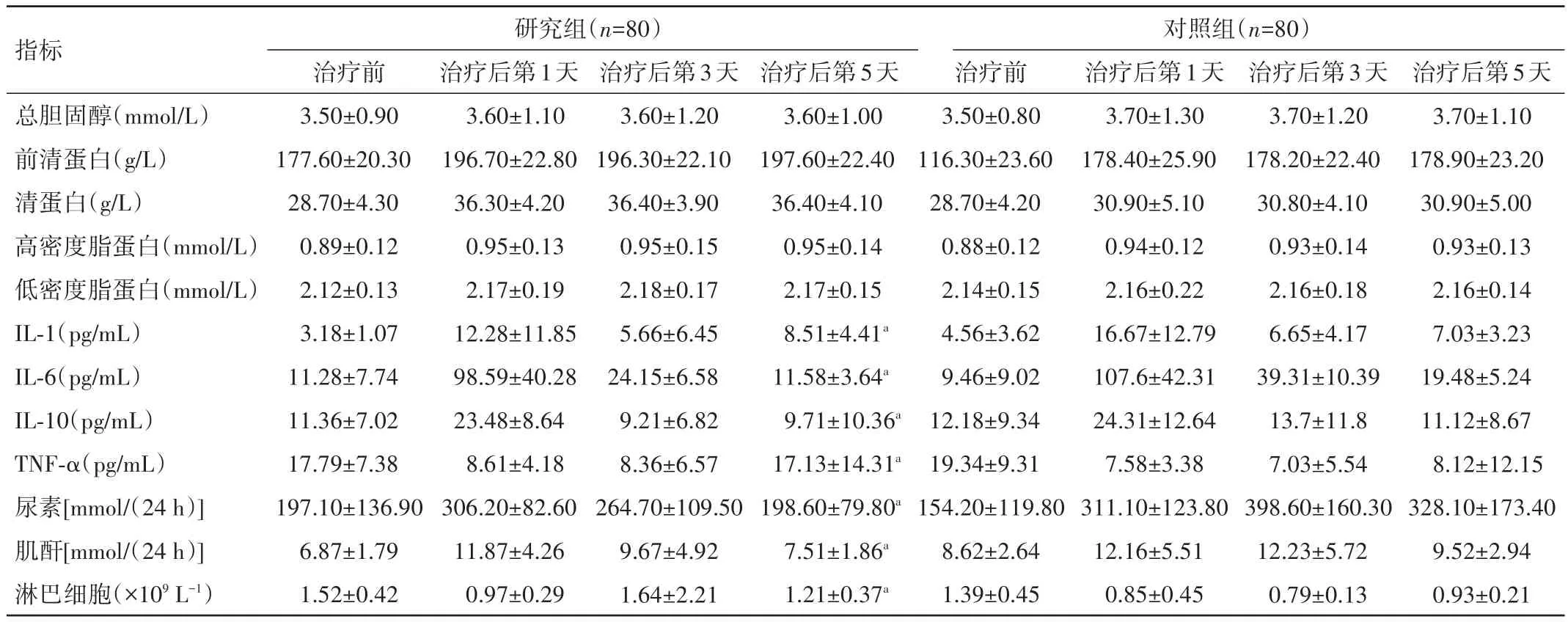
表1 2组患者治疗前、后临床指标比较(±s)
注:与对照组治疗后第5天比较,aP<0.05
指标总胆固醇(mmol/L)前清蛋白(g/L)清蛋白(g/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)IL-1(pg/mL)IL-6(pg/mL)IL-10(pg/mL)TNF-α(pg/mL)尿素[mmol/(24 h)]肌酐[mmol/(24 h)]淋巴细胞(×109L−1)研究组(n=80)治疗前3.50±0.90 177.60±20.30 28.70±4.30 0.89±0.12 2.12±0.13 3.18±1.07 11.28±7.74 11.36±7.02 17.79±7.38 197.10±136.90 6.87±1.79 1.52±0.42治疗后第1天3.60±1.10 196.70±22.80 36.30±4.20 0.95±0.13 2.17±0.19 12.28±11.85 98.59±40.28 23.48±8.64 8.61±4.18 306.20±82.60 11.87±4.26 0.97±0.29治疗后第3天3.60±1.20 196.30±22.10 36.40±3.90 0.95±0.15 2.18±0.17 5.66±6.45 24.15±6.58 9.21±6.82 8.36±6.57 264.70±109.50 9.67±4.92 1.64±2.21治疗后第5天3.60±1.00 197.60±22.40 36.40±4.10 0.95±0.14 2.17±0.15 8.51±4.41a 11.58±3.64a 9.71±10.36a 17.13±14.31a 198.60±79.80a 7.51±1.86a 1.21±0.37a对照组(n=80)治疗前3.50±0.80 116.30±23.60 28.70±4.20 0.88±0.12 2.14±0.15 4.56±3.62 9.46±9.02 12.18±9.34 19.34±9.31 154.20±119.80 8.62±2.64 1.39±0.45治疗后第1天3.70±1.30 178.40±25.90 30.90±5.10 0.94±0.12 2.16±0.22 16.67±12.79 107.6±42.31 24.31±12.64 7.58±3.38 311.10±123.80 12.16±5.51 0.85±0.45治疗后第3天3.70±1.20 178.20±22.40 30.80±4.10 0.93±0.14 2.16±0.18 6.65±4.17 39.31±10.39 13.7±11.8 7.03±5.54 398.60±160.30 12.23±5.72 0.79±0.13治疗后第5天3.70±1.10 178.90±23.20 30.90±5.00 0.93±0.13 2.16±0.14 7.03±3.23 19.48±5.24 11.12±8.67 8.12±12.15 328.10±173.40 9.52±2.94 0.93±0.21
表2 2组患者胃肠功能恢复时间及术后住院时间比较(±s)

表2 2组患者胃肠功能恢复时间及术后住院时间比较(±s)
组别研究组对照组n 80 80胃肠功能恢复时间(h)72.90±20.70 86.40±28.30术后住院时间(d)11.87±5.74 18.58±6.09退热时间(d)4.26±1.96 7.19±3.64通气时间(d)2.56±0.44 3.62±0.79
1.3 统计学处理 采用SPSS19.0统计学软件进行数据分析。计量资料以表示,组间比较采用t检验。计数资料以例数或率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者治疗前、后临床指标比较 研究组患者治疗后前清蛋白、清蛋白水平均明显高于对照组,差异有统计学意义(P<0.05)。2组患者总胆固醇、高密度脂蛋白、低密度脂蛋白水平比较,差异均无统计学意义(P>0.05)。治疗前 2 组患者 TNF-α、IL-10、IL-6、IL-1β等指标比较,差异均无统计学意义(P>0.05),治疗后观察组改善显著,差异有统计学意义(P<0.05)。见表1。
2.2 2组患者胃肠功能恢复时间及术后住院时间比较 研究组患者胃肠功能恢复时间及术后住院时间均明显短于对照组,差异均有统计学意义(P<0.05)。见表2。
2.3 2组感染发生率比较 研究组40例患者中共计出现4例感染患者,其感染比例为10.0%;对照组中共计出现14例感染患者,其感染比例为35.0%,2组感染发生率比较,差异有统计学意义(P<0.05)。
3 讨 论
随着人们生活节奏的不断加快,胃肠道疾病患者越来越多,手术治疗被广泛应用在临床治疗中[7]。营养支持对胃肠道手术患者具有重要作用,可促使患者病情康复,这引起了医学界的高度关注[8]。
作者在研究过程中,针对胃肠道手术后营养支持的常见方法进行分析发现,肠内营养支持、肠外营养支持是2种最常用的营养支持方法,临床上对胃肠道手术患者多采取肠外营养支持,虽然疗效确切,但是容易导致胃黏膜萎缩,肠道细菌移位,进而引发多种并发症,影响治疗效果[9]。肠内营养支持可弥补上述不足之处,是一种理想的胃肠道手术患者的营养支持方法[10-11]。
本研究结果显示,研究组患者治疗后前清蛋白、清蛋白水平均明显高于对照组,胃肠功能恢复时间及术后住院时间均明显低于对照组,差异均有统计学意义(P<0.05)。由此说明,胃肠道手术后肠内营养支持疗效可提升患者机体的前清蛋白及清蛋白水平,促使患者机体营养状况改善,加快患者的胃肠功能恢复,减少术后住院时间。胃肠道手术的实施,虽然能够帮助患者治疗原发疾病,但是容易使患者胃肠道受到不同程度的刺激,胃肠道出现损伤后会相对加剧其自身的应激反应水平,导致患者的身体处于营养不良状态[12]。肠外营养支持的方法实施相对简单,能够满足大部分患者对于营养的需求,但是该方法容易导致患者出现多种并发症,最终对患者的及时恢复产生明显影响,致使患者身体内各项指标无法快速恢复[13]。肠内营养支持是利用鼻十二指肠管、胃空肠造瘘管等方式将营养物质传输到患者体内,虽然会对患者产生一定创伤,但在微创医学的发展和进步下,该方法已经能够将创伤控制在极小范围内,不会对患者产生严重影响[14]。胃肠道结构功能不仅仅起消化和吸收作用,同时对人体的免疫机制具有重要作用。因此,肠内营养支持可以直接将营养物质传输到患者的肠道内,经过肠胃的快速吸收被利用,较好地符合了人体生理特征,帮助患者修复胃黏膜屏障功能,保证胃黏膜结构完整。这不仅利于患者吸收营养物质,同时对其身体免疫功能的改善具有重要意义[15]。而清蛋白、前清蛋白等物质均是反映人体营养状况的重要指标,其改善情况说明患者机体营养不良情况得到了恢复。此外,IL-10、IL-6等指标作为反映人体免疫功能的重要标志,其水平的提高说明患者的情况正不断好转。
综上所述,胃肠道手术后应用肠内营养支持,可有效改善患者机体营养状况,促使患者早日康复,具有临床推广价值。
