AMY、CRP和PCT在急性胰腺炎早期诊断中的价值研究
2018-09-14翁慧斌万秀萍林海王莉娟刘媛边君
翁慧斌,万秀萍,林海,王莉娟,刘媛,边君
急性胰腺炎(AP)是临床较为常见的急性腹症,是梗阻、酒精、外伤及感染等因素导致的自身胰酶激活而发生胰腺组织自身消化、水肿、出血甚至坏死的炎症反应[1]。主要特点为胰腺以及周围组织发生的炎症反应综合征,部分患者伴有其他脏器功能受损,临床症状包括急性腹胀、腹痛,伴有恶心、呕吐,血清淀粉酶(AMY)水平增高,是常见的消化系统急症[1]。临床主要分为轻型(MAP)与重型急性胰腺炎(SAP),大多数为MAP,表现为自限性且预后良好,病死率较低。SAP占AP患者的20%~30%,但病情进展更快,多数患者伴有其他器官受损,易出现一系列并发症,总体病死率为5%~10%[2]。关于AP临床诊断主要通过临床表现、生化检查及影像学检查完成。近年来对于AP患者可能出现的全身炎症反应以及感染的研究逐渐深入,也为相关炎性指标在AP的早期诊断提供依据。降钙素原(PCT)是临床上检测重症感染的重要指标,C反应蛋白(CRP)已被证实是机体炎症反应最敏感的指标之一。浙江省衢州市人民医院近年收治的AP患者逐渐增多,为寻找AP早期诊断的有效血清学指标,笔者通过对照研究来探讨AMY、CRP和PCT在AP早期诊断中研究价值,现将结果报道如下。
1 资料与方法
1.1 一般资料 选择2015年12月至2017年12月本院收治的80例 AP患者,根据病情严重程度分为MAP组(60例)和SAP组(20例);选择本院体检中心40例体检健康人群设为对照组。MAP组中男38例,女22例;年龄20~78岁,平均(45.48±4.89)岁。SAP组中男13例,女7例;年龄26~74岁,平均(46.34±5.33)岁。对照组中男24例,女16例;年龄23~73岁,平均(45.66±4.93)岁。3组年龄、性别差异均无统计学意义(均P>0.05)。
纳入标准:AP患者均符合文献[2]诊断标准,AP分类参照文献[3];年龄≥18岁,<80岁;发病至入院治疗≤24 h;未合并恶性肿瘤或其他严重内科疾病。对照组为年龄、性别配对的体检健康人群;排除标准:入院48 h死亡者;1个月内有免疫抑制剂或激素治疗史。
1.2 方法 所有患者入院后均进行胃肠减压、禁食、胰液分泌抑制、积极补液以及抗感染等综合治疗。PCT检测:采用双抗夹心免疫测定法结合酶联荧光法,入院时、48 h后抽取静脉血2 ml,3 000 r/min离心15 min分离血清,-20℃恒温环境保存。检测前样品于室温解冻,加入标准品和待测血清于 PCT抗体包被的96孔微孔板试剂盒(美国,R&D),PCT结合连接于固相载体的抗体,洗板后滴加PCT抗体,洗净未结合的抗体并加亲和素(HRP标记),彻底清洗后滴加底物显色。450 nm波长下采用酶标仪测得吸光度,最后计算各样品PCT浓水平。CRP:采用免疫透射比浊法,血清样本采集同PCT检测,采用贝克曼库尔特IMMAGE 800特定蛋白分析仪以及配套试剂,严格按照试剂盒说明书进行操作,检测标准为检测值>120 mg/L,可测定透过溶液的光量检测抗原水平,采用吸光度表示,同PCT检测一致。血清AMY:血清样本采集同PCT检测,酶速率法[强生(上海)医疗器材有限公司,25片,产品标准:YZB/USA 6461-2012]37℃检测血清AMY水平。
1.3 统计方法 采用SPSS 22.00统计软件进行统计学分析,计量资料以均数±标准差表示,组内比较采用 检验,多组比较采用F检验;计数资料比较采用 2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组血清AMY水平比较 SAP组、MAP组入院时、48h后血清AMY水平均高于对照组,SAP组、MAP组入院48h后均高于入院时,且 SAP组各时间点AMY水平高于MAP组,差异均有统计学意义(均P<0.05),见表1。
2.2 3组血清PCT水平比较 SAP组、MAP组入院时、48 h后血清PCT水平均高于对照组,SAP组、MAP组入院48h后PCT水平均降低,且SAP组高于MAP组,差异均有统计学意义(均< 0.05),见表2。
2.3 3组血清CRP水平比较 SAP组、MAP组入院时、48 h后血清CRP水平均高于对照组,SAP组、MAP组入院48h后均高于入院时,且 SAP组各时间点AMY水平高于MAP组,差异均有统计学意义(均P<0.05),见表3。
3 讨论
目前关于AP的确切发病机制尚未明确,既往研究结果认为导致AP的发生与梗阻、酒精、外伤及感染等因素有关。以上因素导致的AP病理生理过程主要与炎症递质与细胞因子的过度释放有关,发生局部组织严重损伤以及全身性炎症反应,在AP尤其是SAP的发生发展过程中起到十分重要的作用[4]。而轻症患者中有 10%的患者会发展为重症,且大多出现在入院48 h内。因此对AP患者进行病情早期预测,及时诊断并发症以及继发感染有助于掌握最佳治疗时机,改善预后[5]。
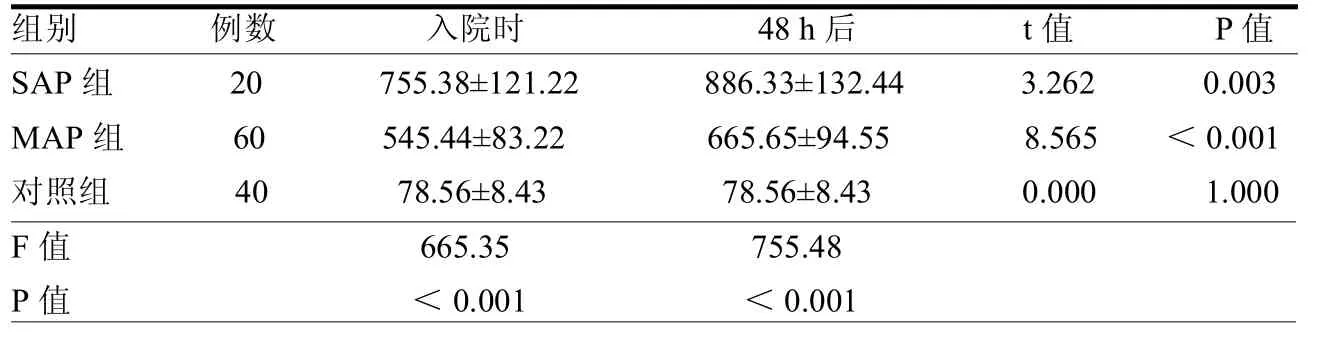
表1 3组血清AMY水平比较 U/L
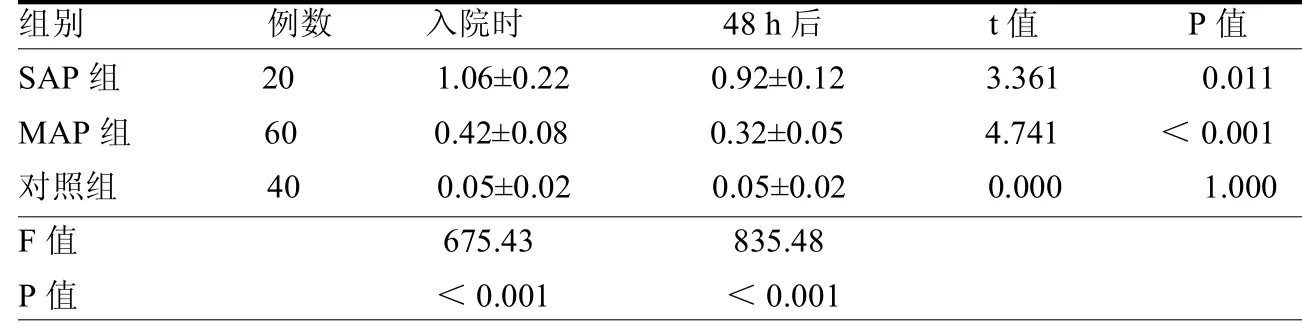
表2 3组血清PCT水平比较 g/ml
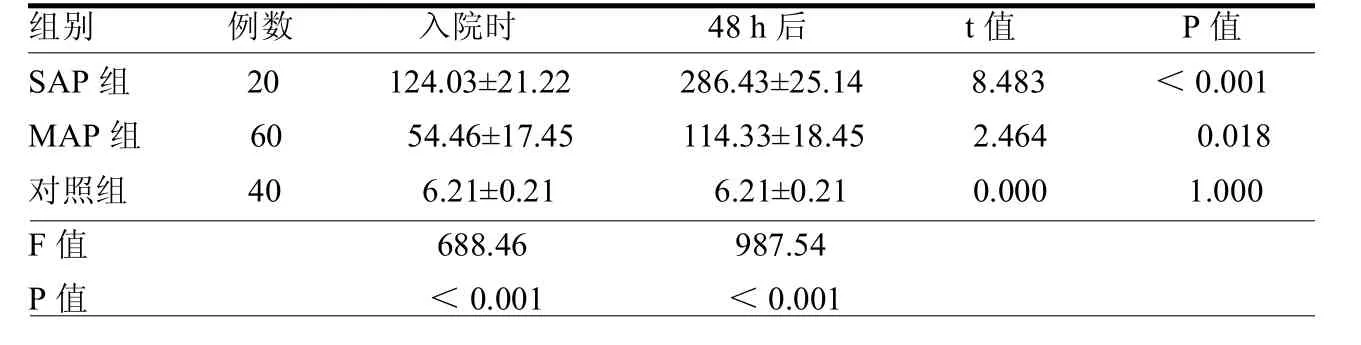
表3 3组血清CRP水平比较 mg/L
AMY主要由胰腺与唾液腺分泌,在多糖分解过程中起到催化作用,而在发生AP时AMY水平会急剧上升,作为临床上诊断AP的重要指标[6]。胰腺组织的炎症反应导致AMY释放进入血液循环,AP发病时便会升高。本研究两组AP患者血清AMY水平均显著高于对照组。有报道称AP发病后6~12h血清AMY水平达到高峰,即使积极治疗也会在3 d后才有所下降[7]。本研究两组患者入院后48 h血清AMY水平处于显著升高状态,与既往结果[7]一致,这也表明发病48 h检测血清AMY水平对AP诊断具有十分重要的意义。
PCT由甲状腺C细胞生成的CT前肽物质,无激素活性,健康人群血液水平率极低,大多处于0.5 g/ml以下。在机体发生脓毒症、细菌感染等异常情况下,PCT便会明显升高,而肿瘤、手术创伤以及病毒感染时则保持低水平[8]。人体发生AP时胰腺实质、胰周受到中性粒细胞以及巨噬细胞的侵袭,细胞活化后释放炎性因子导致局部胰腺组织受损。Plesko等[9]认为PCT水平与感染严重程度具有一致性。入院48h后一系列抗生素的应用以及感染灶的清除能够有效控制感染,血清PCT水平表现为下降。本研究结果表示,SAP组、MAP组入院48 h PCT水平均有所降低,与上述观点一致[10]。这表明PCT水平在炎症得到控制以及病情缓解后降低,因而可采用PCT用于AP病情诊断、预后以及疗效评价的有效指标。
MAP主要为局部胰腺病变,全身性病变较轻,相较于SAP患者出现胰腺囊肿、坏死等严重局部并发症,甚至发生炎症因子的次级瀑布效应,病情较为严重,产生的炎症因子明显高于MAP[11]。CRP已被证实是炎症性疾病最敏感的血清指标之一,在AP的严重程度诊断方面具有明显的优点。本研究结果显示,入院时SAP血清CRP水平显著高于MAP组,且均高出正常人群数十倍,与李超等[12]报道一致,这证实血清CRP水平在AP诊断以及病情判断的敏感性。有报道认为AP患者及时进行积极补液以及抗感染等综合治疗CRP水平会在发病后4 d左右达到峰值[13],后期逐渐降低;因此,在入院48 h后,SAP患者与MAP患者血清 CRP水平均处于上升状态,对于AP的早期诊断意义重大。
综上所述,AP患者血清AMY、CRP和PCT均明显升高,且随病情严重程度增加而增加,在AP的早期诊断具有十分重要的意义。
