南海石斑鱼苗种肠道微孢子虫病病原的鉴定
2018-09-13颜远义刘新华徐力文章晋勇
颜远义 刘新华 徐力文 章晋勇
(1. 广东省水生动物疫病预防控制中心, 广州, 511453; 2. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室,农业部淡水养殖病害防治重点实验室, 淮安研究中心, 武汉 430072; 3. 中国科学院大学, 北京 100049; 4. 中国水产科学研究院南海水产研究所, 广州 510300)
微孢子虫是一类泛在的、成孢子的、单细胞专性细胞内寄生虫, 宿主范围广泛, 可寄生于从原生动物到哺乳动物(包括人类)几乎所有动物类群[1]。至今, 已报道187属1500余种。鱼类是微孢子虫的主要宿主之一, 目前已报道21属160余种, 绝大部种类感染硬骨鱼类, 迄今仅报道一种可感染软骨鱼类[2]。石斑鱼(Epinephelusspp.)隶属鲈形目(Perciformes), 鮨科(Serranidae), 是一类重要的海水经济鱼类, 尤其是在东南亚地区, 因其肉质鲜美, 深受人们喜爱。随着苗种人工繁育的成功及配合饲料的使用, 已成为东南亚最重要的海水养殖品种之一,仅我国南海区域(主要包括福建、两广、海南等地)年产量就达8×107kg[3]。目前, 在我国养殖的石斑鱼种类有10属超过50种, 包括青石石斑鱼(E.awoara)、斜带石斑鱼(E. coioides)、赤点石斑鱼(E.akaara)、点带石斑鱼(E. malabaricus)、鞍带石斑鱼(E. lanceolatus)、褐点石斑鱼(E. fuscoguttatus)、杂交石斑鱼(珍珠龙胆,E. lanceolatus♂×E. fuscoguttatus♀)等。然而, 随着集约化养殖发展, 石斑鱼养殖病害频发, 给养殖生产造成了严重的经济损失。其中, 已报道3种石斑鱼微孢子虫病, 病原分别为寄生于清水石斑鱼(Epinephelus polyphekadion)肠壁的阿拉伯格留虫(Glugea arabica)、寄生于网纹石斑鱼(E. chlorostigma)腹腔的匹里虫待定种(Pleistophorasp.)、寄生于赤点石斑鱼(E. akaara)腹腔的石斑鱼格留虫(G. epinephelusis)[4—6]。
近年来, 一种引起石斑鱼苗种培育阶段的肠道微孢子虫病在海南广泛传播, 损失严重, 其主要症状为厌食、肠壁变薄、鱼体极度消瘦、排白便等症状, 造成苗种的大量死亡, 死亡率最高可达100%,危害仅次于石斑鱼神经坏死病毒病, 由于其最直观的临床症状为患病鱼极度消瘦, 故当地渔民也称其为“瘦身病”, 但由于引起石斑鱼瘦身的原因众多且由于这是石斑鱼肠道感染微孢子虫的首次发现, 故我们认为称其为石斑鱼肠道微孢子虫病更为合适。我们前期虽对该病例、流行病学及分子特征等进行了报道, 但并未对其病原鉴定至种[7]。本文详细报道了其引起的组织病理变化、超微结构以及分子特征等微孢子虫分类衍征, 确定了该病原为肠胞虫科, 肠孢虫属(Enterospora)一新种, 命名为石斑鱼肠孢虫(Enterospora epinephelisp. n.)。
1 材料与方法
1.1 样本采集及处理
于2017年5月在海南文昌冯家湾珍珠龙胆苗种培育场发现大量苗种出现患病症状, 主要表现为鱼苗停止摄食并伴有白便, 鱼体消瘦, 头骨和腹腔凹陷, 背脊肌肉消瘦, 严重的为刀刃状, 体重仅为正常鱼苗的20%—40%。采集患病症状的鱼苗50尾(体重11.3—20.9 g), 活体运回实验室解剖观察。
1.2 活体检查
将带回的石斑鱼进行解剖, 取少量肠道组织并刮取部分内容物进行涂片观察, 在1000×倍下对新鲜孢子进行观察、测量、拍照。
1.3 组织病理
剪取症状明显鱼体的部分肠道组织, 并刮取肠道内容物分别保存于10%中性福尔马林进行固定,样品固定48h后, 经乙醇和丙酮梯度脱水后移入到二甲苯透明, 浸蜡包埋后切片, 切片厚度4—6 µm,经苏木精–伊红染色(H&E染色)后用Olympus BX53拍照观察并保存。
1.4 超微结构观察
将感染的肠道及内容物保存到2.5%中性戊二醛中, 4℃固定24h, 磷酸缓冲液冲洗, 经1% 饿酸固定、磷酸缓冲液漂洗后, 再经系列丙酮脱水, 渗透、包埋、切片后经醋酸铀和柠檬酸铅双重染色,HITACHI H-7700透射电镜观察超微结构, 工作电压为80千伏。
1.5 DNA提取、18SrDNA序列的扩增和测定
取部分95%酒精保存的组织, 剪成碎片并用PBS离心洗涤2次以除去残余酒精。先用组织研磨仪(MP, FastPrep-24 5G)6.0速率振荡4次, 每次20s,然后用光学显微镜观察孢子是否完全破碎。破碎后利用细胞/组织基因组DNA提取试剂盒(Qiagen,德国)提取样品基因组DNA。18S rDNA序列片段扩增采用引物EnterF125 (5′-AACTAACCACGG TAACCTGTGGCTAA-3′)和EnterR1153 (5′-CAT TCACCATGCCTTGATGAGGCACCGTT-3′)[7]。PCR反应体系包括1 μL DNA, 12.5 μL 1× PCR mixture (康为, 北京), 正反引物各1 μL (10 μm), 加双蒸水至25 μL体系。反应程序为94℃预变性3min,35个循环: 94℃变性40s; 59℃退火30s; 72℃延伸90s; 72℃终延伸10min。PCR产物用1%琼脂糖凝胶电泳后, 用胶回收试剂盒(康为, 北京)纯化回收, 将目的片段连接到pMD18-T载体(TaKaRa, 日本), 再转化到感受态细胞DH5α中, 50 μL/mL氨苄青霉素的LB 固体培养基均匀涂布并培养过夜, 挑取阳性克隆, 用于测序。测序在自动测序仪ABI PRISM®3730 DNA Sequencer (Applied Biosystems USA)上完成。测序结果通过BioEdit[8]进行拼接, 并根据测序峰图人工校正(DNASTAR INC., Madisom, Wis),将拼接完毕的序列提交至GenBank。
1.6 系统发育关系及遗传距离分析
将所获得序列通过NCBI网站进行BLAST搜索, 并从GenBank上选取肠胞虫科以及其他序列相似性较高种类的18S rDNA序列数据进行系统发育树的构建。选取Glugea arabica(KT005391)和Glugea epinephelusis(AY090038)为外群。利用CLUSTAL 1.8[9]对选取的序列进行多重比对。分别利用最大似然法(Maximum Likehood, ML)和贝叶斯法(Bayesian Inferences, BI)进行系统发育关系分析。通过jModelTest[10]确定最佳核苷酸替代模型应用于ML和BI分析。ML分析利用PhyML 3.0[11]软件进行运算100代。BI分析利用Mr. Bayes[12]软件进行操作, 以随机树(Random)为起始树, 替换模型参数Nst为6, 马尔可夫链的蒙特卡洛方法(Markov chain Monte Carlo process)设置为4条链同时运行1000000代。获得的系统发育树用Treeview1.6[13]和Adobe Illustrator (Adobe Systems Inc.美国) 编辑、注释。
选取肠胞虫科所有种类进行遗传距离分析, 用MEGA (6.0) 软件选择Kimura 2-parameter 模型进行计算[14]。
2 结果
2.1 组织病理
在所检查的50尾鱼苗中, 均不同程度的感染了该微孢子虫。组织病理分析发现, 大量的孢子定殖在肠道上皮的杯状细胞核内, 造成细胞核肥大, 甚至胀破核膜流出到细胞质中(图1a)。同时, 由于感染细胞坏死、脱落, 肠腔中肠道内容物中孢子的丰度也非常大(图1b)。
2.2 石斑鱼肠孢虫超微结构特征和发育过程
图2—图4展示了该石斑鱼肠孢虫在细胞核内是如何发育为成熟孢子。早期单核裂殖体, 颜色较浅, 藕核, 通过一层薄膜与核质隔离, 无寄生泡或产孢囊结构, 细胞核周围围绕较多线粒体(图2a)。单核裂殖体继续发育形成多核裂殖原质团, 此时, 裂殖原质团颜色较深, 藕核明显, 且绝大部分聚集在细胞核周围, 原质团薄膜与细胞核膜基本重合。裂殖原质团发育导致细胞核出现明显肥大, 甚至直接将细胞核膜胀破(图2b—d)。裂殖原质团进一步发育形成多核产孢原质团, 并开始出现许多高电子密度的囊泡状结构(图3a—d)。囊泡状结构聚集在细胞核周围, 并组装形成微孢子虫挤出装置前体(图3c、 3d)。随后, 产孢体原生质团通过连续分裂形成一个个孢子母细胞, 孢子母细胞可见微孢子虫的典型特征, 如极丝、后泡及三层孢壁结构等(图3e)。值得注意的是, 整个孢子发育并不是同步完成(图3f)。孢子母细胞与细胞核直接接触, 并进一步发育形成成熟孢子(图4a—d)。成熟孢子为椭圆形, 孢子长(1.56±0.31) μm (1.07—1.96 μm), 宽(1.08±0.98) μm(0.93—1.28 μm), 具一个蘑菇状锚状盘(图4a)。极质体由两部分组成, 均呈薄膜状, 外层部分排列紧密, 内层较为稀疏(图4b—c)。同型极丝5—6圈, 分两列排列(图4d)。孢壁分为3层, 外壁电子密度高,厚(15.51±0.95) nm (9.87—26.18 nm), 内壁为电子透明层, 较外层更厚(81.13±2.71) nm (57.16—110.81 nm),最里面为孢质膜(图4c)。
分类学信息:
石斑鱼肠孢虫Enterospora epinephelisp. n.
宿主: 石斑鱼Epinephelusspp.
采样地点: 海南文昌冯家湾养殖区 (19°24′31″ N,110°42′29″ E)
寄生部位: 肠道上皮杯状细胞核内
宿主大小: 体重11.3—20.9 g
感染率: 100% (50/50)
样本保存: 10%福尔马林、2.5%戊二醛及95%酒精固定标本保存于中国科学院水生生物研究所鱼病研究室, 标本号: MTR201705181、MTR201705182、MTR201705183。
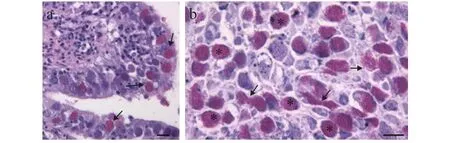
图1 石斑鱼肠孢虫感染肠道组织和肠道内容物病理切片Fig. 1 Photomicrographs of Enterospora epinepheli sp. n. from histological sections of intestine and intestinal contents of hybrid grouper, E. lanceolatus♂×E. fuscoguttatus♀

图2 石斑鱼肠孢虫裂体生殖时期超微结构Fig. 2 Ultrastructure of merogony in Enterospora epinepheli sp.n. in the intestines of E. lanceolatus♂×E. fuscoguttatus♀
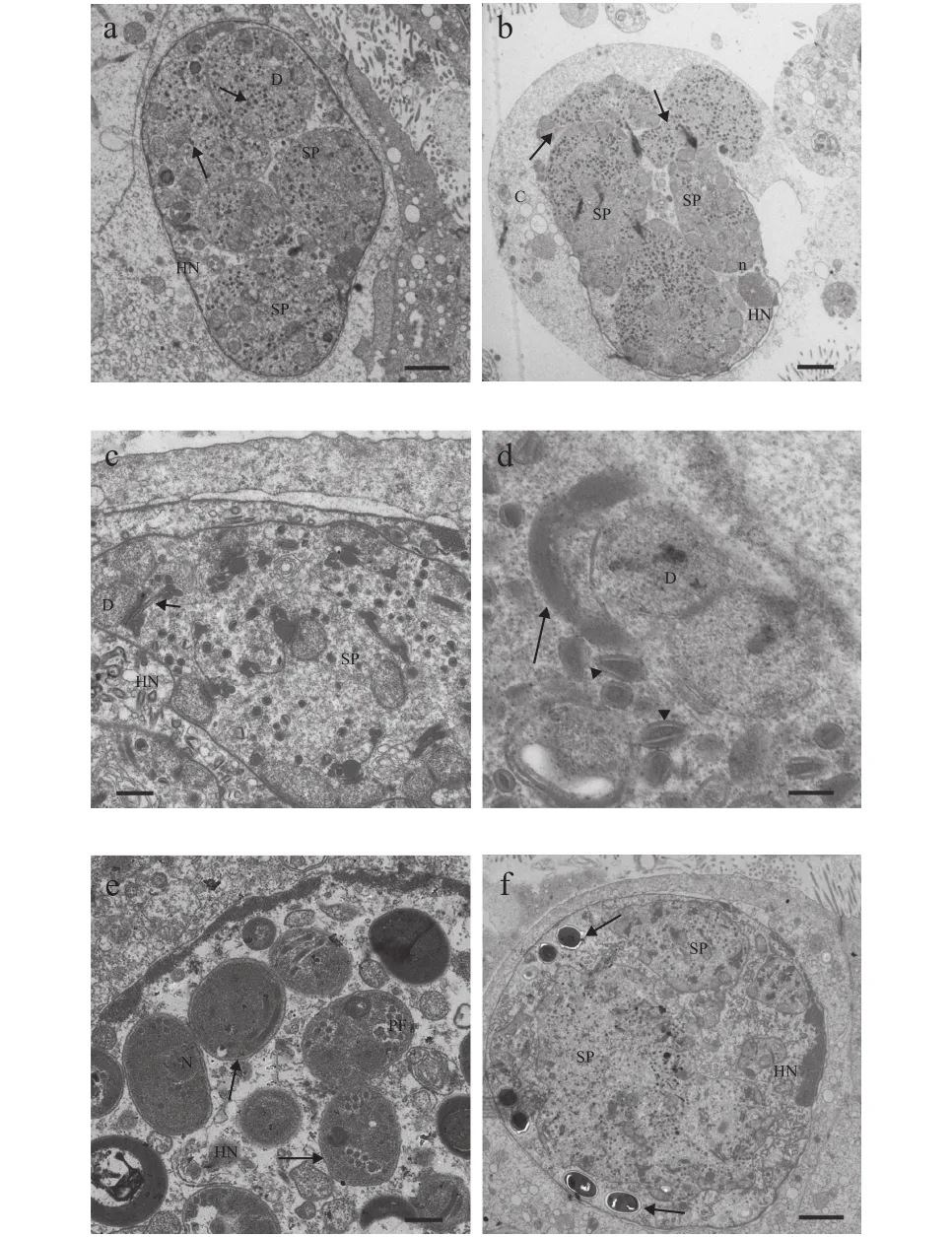
图3 石斑鱼肠孢虫孢子生殖时期超微结构Fig. 3 Ultrastructure of sporogony in Enterospora epinepheli sp.n. in the intestines of E. lanceolatus♂×E. fuscoguttatus♀
序列号: 模式标本18S rDNA序列在GenBank数据库中登录号为MH345732。
种名来源: 因其感染多种石斑鱼属石斑鱼而将其命名为石斑鱼肠孢虫。
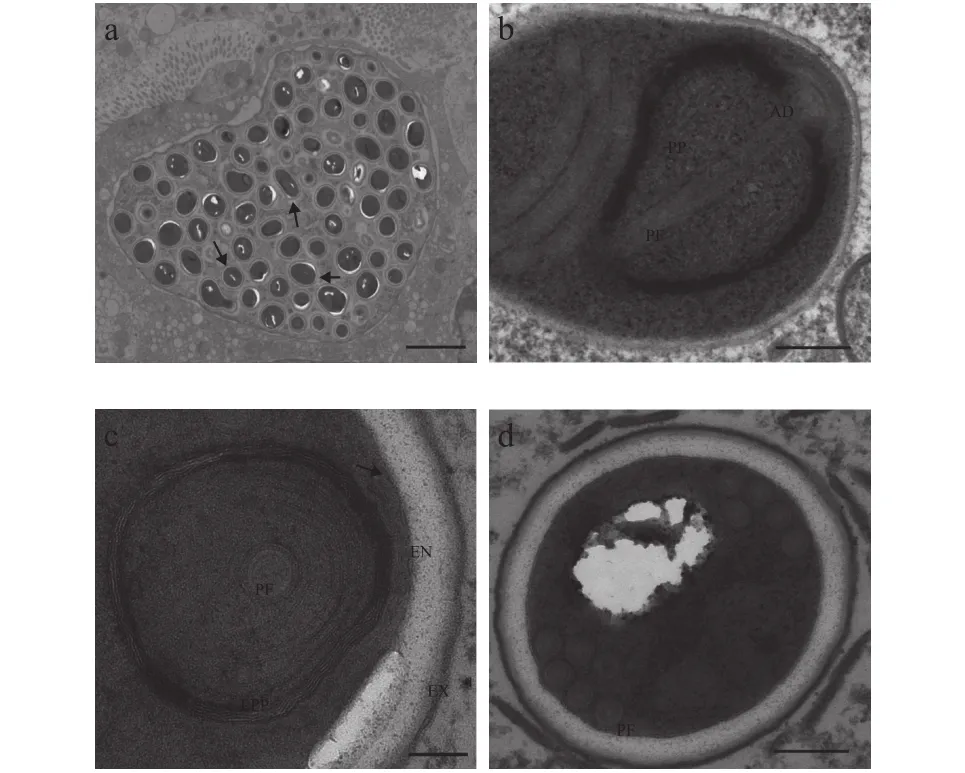
图4 石斑鱼肠孢虫成熟孢子超微结构Fig. 4 Ultrastructure of mature spores of Enterospora epinepheli sp. n. in the intestines of E. lanceolatus♂×E. fuscoguttatus♀
2.3 分子特征分析
通过分子克隆成功扩增出石斑鱼肠孢虫小核糖体RNA部分序列, 序列长1043 bp, GC含量为41.71%。将其在NCBI中进行BLAST发现, 与之前报道的石斑鱼肠孢虫待定种Microsporidiumsp.(100%, KR263870)序列一致, 其他较相似的种类还有: 虾肝肠胞虫Enterocytozoon hepatopenaei(85%,KX981865)、核肠孢虫Enterospora nucleophila(83%, KF135645)、黄道蟹肠孢虫Enterospora canceri(83%, HE584634)、三文鱼核孢虫Nucleospora salmonis(82%, AF185998)、毕氏肠胞虫Enterocytozoon bieneusi(81%, AF023245)等, 相似性最高的为85%, 低于种间的范围。与已报道的其他石斑鱼寄生的微孢子虫相似性都较低, 如Glugea epinephelusis(55%, AY090038),G. Arabica(56%, KT-000539),Pleistophorasp. (30%, JN205118), 显著低于种间范围。基于贝叶斯法以及最大似然法所构建出的系统发育关系树拓扑结构一致, 尽管各进化枝支持率有些许差异。因此, 本研究用贝叶斯树展示代表石斑鱼肠孢虫的系统发育关系。从系统发育关系树显示, 肠胞虫科的种类可分为2个枝系(Clade I 和Clade II), 石斑鱼肠孢虫与对虾肝胞虫、核肠孢虫、黄道蟹肠孢虫以及毕氏肠胞虫聚为一枝(Clade II), 且支持率较高, 但不与其中任何一种形成姊妹枝。中华绒螯蟹肝胰腺坏死相关的绒螯蟹肝孢虫(Hepatospora eirocheir)与肠胞虫科分枝聚为姊妹枝(图5)。
选取所有肠胞虫科的种类进行遗传距离分析发现, 遗传距离范围在0.000—0.225(表1), 最小的为石斑鱼微孢子虫待定种, 其他已经鉴定的种类遗传距离最近的为0.162, 超出种间范围。
3 讨论
肠胞虫科的典型特征为孢子在发育过程中, 孢子的挤出释放装置(包括锚状盘、极丝、后泡等)在产孢体分裂形成孢子母细胞前已经开始发育并形成, 而几乎所有的微孢子虫的挤出装置一般都是产孢体分裂形成孢子母细胞后才开始形成[15,16]。目前, 肠胞虫科主要包含5个属, 即Nucleospora、Paranucleospora、Obruspora、Enterocytozoon以及Enterospora[17], 其中毕氏肠胞虫(Enterocytozoon bieneusi)是重要的人源微孢子虫之一, 尤其对免疫缺陷病患者危害严重[15]。石斑鱼肠孢虫的许多特征与Enterospora属的模式种E. canceri极为相似, 主要包括: (1)均为细胞核内寄生; (2)裂殖体以及产孢体阶段均是通过薄膜与细胞核分离, 但成熟孢子却与细胞核直接接触; (3)均形成裂殖原质团和产孢原质团, 且单个核内可形成多个; (4)孢子大小、形状以及极丝圈数极为相似。与该属已报道的其他种类进一步形态特征比较分析发现, 石斑鱼肠孢虫具有显著的差异性特征(表2)。核肠孢虫(E. nucleophile)和黄道蟹肠孢虫(E. canceri)均是感染细胞核的种类, 前者是近几年在西班牙报道的金头鲷“白便瘦身病”病原, 也造成宿主厌食、消瘦、白便等临床症状, 但与石斑鱼肠孢虫不同的是, 其整个发育过程中都与宿主细胞核直接接触, 极丝排列只有一列, 一个核内的成熟孢子数只有不到13个[18]。此外, 核肠孢虫还能寄生于细胞质中, 而石斑鱼肠孢虫虽也在细胞质中有发现, 但超微结构显示其是由于孢原质发育引起细胞核肥大并胀破细胞核膜而弥散到细胞质中, 这也证实了石斑鱼肠孢虫为核内专性寄生。黄道蟹肠孢虫整个发育过程均为离核,寄生在肝胰脏上皮细胞核内, 单个核内孢子个数比石斑鱼肠孢虫要多(>100vs. >60)。此外, 黄道蟹肠孢虫的内层孢壁厚度显著低于石斑鱼肠孢虫[内层: (14.8±0.65) nmvs. (81.13±2.71) nm(57.16—110.81 nm)]。对虾肝肠胞虫寄生于南美白对虾和斑节对虾肝胰脏管状上皮细胞质内, 大量寄生时会导致对虾出现生长缓慢综合症[19], 其孢子大小(0.7 μm×1.1 μm) 和孢壁厚度(外壁: 2 nm; 内壁: 10 nm)都较石斑鱼肠孢虫小, 此外极质体类型也有显著的区别(表2)。
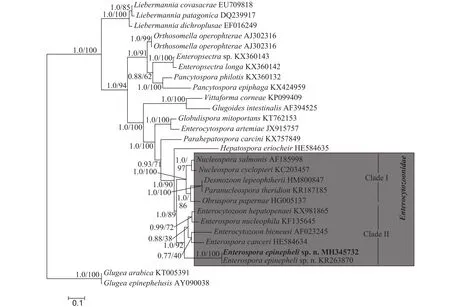
图5 基于18S rDNA基因序列构建的贝叶斯法(BI)系统发育树Fig. 5 Phylogenetic tree generated by Bayesian inferences (BI) based on the partial 18S rDNA sequences
随着分子生物学的发展, 分子标记对微孢子虫的鉴定及其系统发育生物学分析发挥了重要作用[17—21]。本研究中所扩增获得的石斑鱼肠孢虫18S rDNA部分序列经BLAST比较分析发现, 其与之前报道的石斑肠道微孢子虫待定种几乎100%相似, 只有2个碱基缺失的差异。而已报道感染石斑鱼的其他3种微孢子虫, 即G. epinephelusis、G. arabica及Pleistophorasp., 与石斑鱼肠孢虫的相似性均在60%以下, 表明这些种类与石斑鱼肠孢虫亲缘关系相差甚远。与其他相似性较高的种类进行遗传距离分析发现, 遗传距离在0.162—0.225, 其中与肠孢虫属其他种的遗传距离在0.162—0.182, 均远超出种内范围, 从而在分子水平上进一步证实了石斑鱼肠孢虫有别于已报道的肠孢虫属种类(表1)。
系统发育关系分析发现, 肠胞虫科整个类群的拓扑结构与之前报道的类似, 明显聚为两个分支(Clade Ⅰ和Clade Ⅱ)[17]。其中石斑鱼肠孢虫与肠孢虫属种(E. canceri,E. hepatopenaei,E. nucleiphila)及毕氏肠胞虫聚为一支(Clade Ⅱ)。而西班牙学者报道的金头鲷核肠孢虫与对虾肝胞虫形成姊妹枝。另外, 有学者报道对虾肝胞虫与肠孢虫属模型种黄道蟹肠孢虫相似性较高(94%), 认为应将虾肝肠胞虫划分到肠孢虫属中, 并提出肠孢虫属应为一个单系群[18,19]。然而, 在本研究中, 石斑鱼肠孢虫处于Clade Ⅱ的基部, 不与该属其他种类形成姐妹枝, 肠孢虫属枝系中还包含了毕氏肠胞虫, 表明肠孢虫属应为并系类群。此外, 寄生于细胞核内的微孢子虫都属于肠胞虫科, 但核内寄生的肠胞虫科种类并没有单独聚为一支, 而是与细胞质内寄生的种类(E. hepatopenaei、Obruspora papernae、E. bieneusi)分散在整个肠胞虫科的两个支系中, 表明细胞核和细胞质内寄生在肠胞虫科种类适应进化历程中出现多次, 并交替出现。有趣的是, 在其他微孢子虫科属中尚未发现细胞核内寄生种类。同时,细胞核内寄生对微孢子虫的生存、繁殖以及与宿主间互作关系等方面有怎样的影响, 目前仍不清楚。但有研究表明, 肠胞虫科的种类在基因组水平上丢失了糖酵解途径的大量基因, 通过 ATP转运体从宿主中转运能量和营养物质, 说明肠胞虫科种类对宿主具有高度的依赖性[22]。从而导致虫体与宿主竞争营养成分以及能量物质, 这可能是对虾肝肠胞虫、核肠孢虫以及石斑鱼肠孢虫寄生导致宿主出现生长速度慢、瘦身等症状的原因。
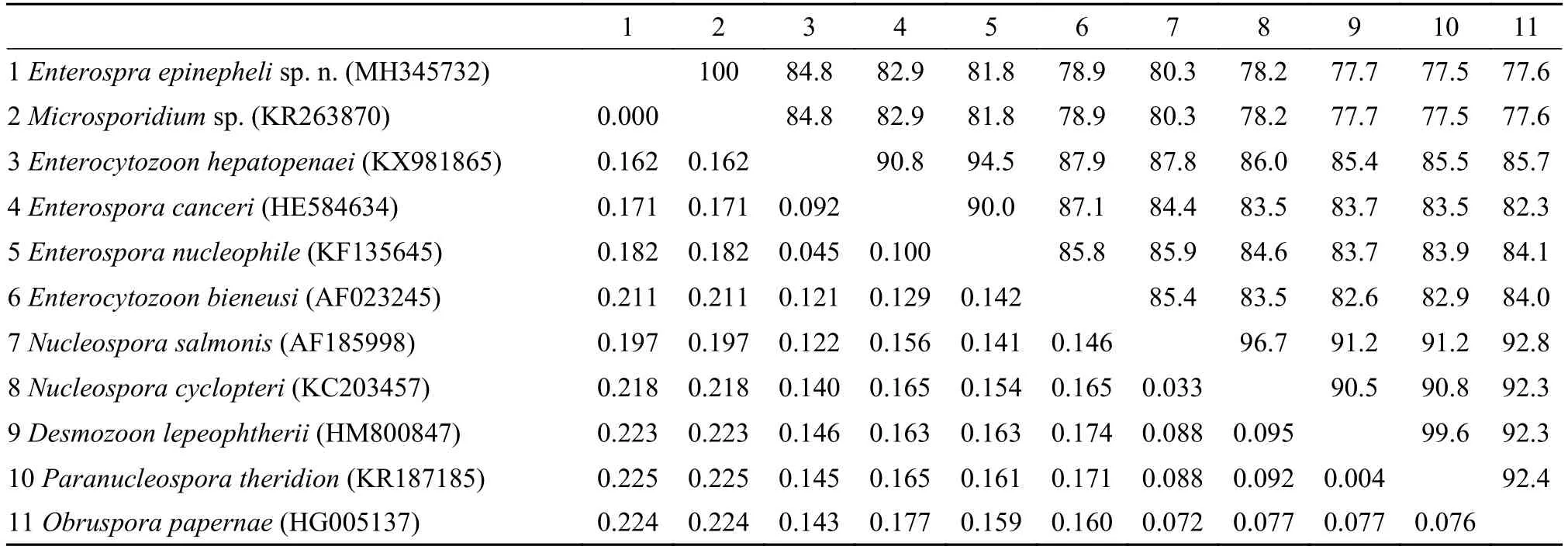
表1 石斑鱼肠孢虫与其他肠胞虫科种类基于18S rDNA的相似性(上面对角)和遗传距离(下面对角)Tab. 1 Comparison of similarities (above diagonal) and genetic distances (below diagonal) of Enterospora epinepheli sp. n. with other Enterocytozoonidae species based on the partial 18S rDNA

表2 已报道的肠孢虫属种类形态特征Tab. 2 Taxonomic characters of Enterospora spp. reported previously
综上所述, 本研究整合病理、各发育阶段超微结构及分子特征, 鉴定了近年来暴发于我国中南沿海石斑鱼苗种肠道微孢子虫病的病原为一肠孢虫新种, 命名为石斑鱼肠孢虫(Enterospora epinephelisp. n.)。
