一种发酵麸皮多糖的提取 及其对大鼠的抗氧化作用
2018-09-13安晓萍史俊祥段元霄张倩茹孟子琪齐景伟
安晓萍,王 园,史俊祥,段元霄,张倩茹,孟子琪,李 暄,齐景伟
(内蒙古农业大学动物科学学院,内蒙古呼和浩特 010018)
小麦麸皮作为小麦加工面粉的主要副产物,是一种重要的膳食纤维来源,对机体保持健康状态发挥着重要的作用。麸皮的利用常集中在饲料领域,其价值没有得到充分的发挥。麸皮中除含有一定数量的淀粉、蛋白质、脂肪外,还含有46%左右的非淀粉多糖(non-starch polysaccharides,NSP)[1],包括果胶多糖、纤维素多糖以及由阿拉伯木聚糖、混合链β-葡聚糖、葡甘露聚糖、半乳聚糖、木聚糖等组成的非纤维素多糖[2]。大量研究表明,麸皮多糖具有诸多可贵的生物活性,包括抗氧化[3]、免疫调节[4-5]和益生作用[6]等。因此,麦麸多糖已经在食品工业、发酵工业等领域崭露头角。
微生物发酵法是一种常用的食品、饲料加工技术。麸皮经过微生物处理后,其物理特性和营养价值均能够得到改善[7-8]。小麦麸皮经过酵母菌或乳酸菌为菌种的液态发酵后,可溶性阿拉伯木聚糖、酚酸含量、抗氧化活性均有提高[9-11]。崔晨晓等[12]以酵母菌为菌种进行小麦麸皮固态发酵,同样提高了可溶性阿拉伯木聚糖和总酚含量。与液态发酵法相比,固态发酵法具有成本低、条件温和、不受设备限制且多糖转化率较高的优点。
前期研究已利用枯草芽孢杆菌和酿酒酵母菌固态发酵了小麦麸皮,发现发酵麸皮多糖含量可达130.21 mg/g,且具有一定的抗炎活性[13-14],但发酵麸皮多糖的组成及其抗氧化活性仍有待于进一步研究。因此,本文通过对发酵麸皮粗多糖提取工艺进行优化,测定其单糖组成,并选用健康的雄性Wistar大鼠为研究对象,采用腹腔注射敌草快(Diquat)建立大鼠氧化应激模型,研究发酵麸皮多糖的抗氧化活性,以期为在生产中将发酵麸皮多糖应用于改善机体健康状况提供理论依据。
1 材料与方法
1.1 材料与仪器
Wistar大鼠 健康无菌级,雄性,断奶,36只,内蒙古医科大学试验动物中心(SCXK(蒙)2015-0001);酿酒酵母CGMCC 2.119、枯草芽孢杆菌CGMCC 1.0892 动物科学学院水产实验室保存;麸皮、豆粕粉、玉米粉 市购;甲醇、三氟乙酸、氯仿、1-苯基-3-甲基-5-吡唑啉酮(PMP) 色谱纯,天津市康科德科技有限公司;甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖 美国Sigma公司;营养肉汤培养基、麦芽汁液体培养基 广东环凯微生物科技有限公司;总蛋白定量、总抗氧化能力(Total antioxidant capacity,T-AOC)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione Peroxidasa,GSH-Px)、谷胱甘肽(Glutathione,GSH)、超氧化物歧化酶(Superoxide Dismutase,SOD)、丙二醛(Malondialdehyde,MDA)ELISA试剂盒 武汉基因美生物科技有限公司;其他试剂 均为国产分析纯。
YX-18LDJ型手提式压力蒸汽灭菌器 上海申安医疗器械厂;SW-CJ型超净工作台 上海新苗医疗器械;GX2型智力光照培养箱 宁波东南仪器有限公司;SH2-82型旋转气浴恒温振荡器 金坛市岸头中旺实验仪器厂;TG16-WS型台式高速离心机 湖南湘仪仪器开发有限公司;Epoch2型微孔板分光光度计 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 固态发酵小麦麸皮 将保藏的酿酒酵母和枯草芽孢杆菌分别接种于灭菌(121 ℃,0.1 MPa)的麦芽汁培养基和营养肉汤培养基中,培养24 h(37 ℃,120 r/min),使菌体浓度达到108cfu/mL,以6.73∶3.26的比例组成复合菌种液。发酵底物为麸皮80.46%、豆粕粉9.32%和玉米粉10.22%,总接种量10.4%,料水比为1∶1.16 (w/v,g/mL),置于35.4 ℃发酵52.7 h[13-14]。发酵结束后,于45 ℃烘箱中烘干(24 h)后粉碎过60目筛。
1.2.2 发酵麸皮多糖提取工艺研究 采用水提醇沉法,取干燥后发酵麸皮10 g,以一定料液比,一定温度,水浴浸提一定时间,离心(5000 r/min,15 min)取上清液,上清液加入4倍体积的95%乙醇,静置过夜,离心(5000 r/min,15 min)收集沉淀,沉淀冻干备用。利用单因素试验研究浸提温度、浸提时间和料水比对发酵麸皮多糖产量的影响。
浸提温度设定为50、60、70、80、90、100 ℃(固定料液比1∶20,浸提时间30 min);浸提时间设定为10、20、30、60、90、120 min(固定料液比1∶20,固定浸提温度80 ℃);浸提料水比(w/v,g/mL)设定为1∶10、1∶20、1∶30、1∶40(固定浸提温度80 ℃,浸提时间30 min)。
1.2.3 发酵麸皮多糖含量测定 采用葡萄糖苯酚-硫酸分光光度法测定发酵麸皮多糖含量。发酵麸皮多糖含量由下列公式计算得出:
发酵麸皮多糖含量(mg/g)=[发酵麸皮多糖液浓度(mg/mL)×发酵麸皮多糖液体积(mL)]/[固体浸提物的质量(g)]
1.2.4 发酵麸皮多糖单糖组成的测定
1.2.4.1 发酵麸皮多糖酸水解 称取冻干的发酵麸皮多糖样品2 mg,加入2 mol/L三氟乙酸(TFA)溶液0.5 mL,在120 ℃条件下水解2 h。氮吹仪吹干。
1.2.4.2 标准品溶液的制备 分别精确称取单糖标准品10 mg,溶解于1 mL水溶液中,配制成10 mg/mL的母液。各取5 μL单糖标准品母液加入至0.5 mL TFA溶液(2 mol/L)中,与样品同时在120 ℃条件下水解2 h。氮吹仪吹干。
1.2.4.3 PMP柱前衍生 向完全酸水解干燥后得到的样品中加入0.5 mL PMP甲醇溶液(0.5 mol/L)和0.5 mL NaOH溶液(0.3 mol/L),充分混匀后于70 ℃水浴反应30 min。冷却至室温,加入0.5 mL HCl溶液(0.3 mol/L)中和。加入0.5 mL氯仿反复萃取3次,离心(5000 r/min,5 min)取上清液,经0.22 μm微孔滤膜过滤后用于HPLC分析。
1.2.4.4 色谱条件 色谱柱为SHISEIDO C18柱(250 mm×4.6 mm,5 μm);流动相A为0.1 mol/L磷酸盐缓冲液(pH7.0);流动相B为乙腈水溶液(82∶18,v/v);流速1.0 mL/min;柱温25 ℃;进样量10 μL;采用VWD测器检测,检测波长为245 nm。
1.2.5 发酵麸皮多糖对大鼠抗氧化功能的影响
1.2.5.1 动物试验设计 本试验选用雄性Wistar大鼠36只,经过一周的适应期,随机分为6组。低剂量组(low-dose,CL)、中剂量组(middle-dose,CM)和高剂量组(high-dose,CH):每天分别灌服100、200和400 mg/kg发酵麸皮多糖粗制品;阳性对照组(positive control,PC):100 mg/kg维生素C;阴性对照组(negative control,NC):空白攻毒;正常对照组(control,CT):空白不攻毒。试验期14 d。试验结束当天,除CT组外,其它5组大鼠腹腔注射敌草快0.1 mmol/kg,CT组注射等量生理盐水,攻毒24 h后处死。
1.2.5.2 血浆和肝脏组织样品的制备 大鼠攻毒前禁食12 h,自由饮水,攻毒后24 h后乙醚致晕,心脏采血,并采集肝脏样本。血液样品采集后立即放置在冰盒中,离心(4 ℃,3000 r/min)10 min,血浆保存于-20 ℃,用于测定抗氧化功能相关指标。肝脏样本用生理盐水洗净后,装入无菌采样袋,浸入液氮,取出后-80 ℃冷冻保存。测定时,用含NaCl浓度为0.86%磷酸盐缓冲溶液(phosphate buffered solution,PBS)缓冲液(0.01 mol/L,pH7.4)匀浆,离心(4 ℃,3000 r/min)10 min,得到的上清液用于抗氧化功能相关指标测定。
1.2.5.3 血浆和肝脏组织中抗氧化指标的测定 总蛋白定量、T-AOC、CAT、GSH-Px、GSH、SOD及MDA定量测定根据ELISA试剂盒说明书进行。
1.3 数据处理
采用SAS 8.1统计软件GLM模型进行单因素方差分析,多重比较采用Duncan’s检验,p<0.05为差异显著。发酵麸皮多糖提取试验均重复6次,动物试验每组6个重复。
2 结果与分析
2.1 发酵麸皮多糖提取工艺优化
由图1A可知,当浸提温度在50~80 ℃范围内变化时,发酵麸皮多糖含量随浸提温度的升高逐渐增加(p<0.05),浸提温度在80 ℃时,提取效果最佳;在80~100 ℃范围内,发酵麸皮多糖含量小幅度上升后维持稳定(p>0.05)。考虑到升温过程能源浪费比较严重,增加提取成本,故将浸提温度定为80 ℃。
由图1B可知,当浸提时间在10~30 min范围内变化时,发酵麸皮多糖含量随浸提时间的延长逐渐增加(p<0.05),浸提温度达到30 min时,发酵麸皮多糖含量达到最大,延长浸提时间,发酵麸皮多糖含量没有显著变化(p>0.05)。考虑到缩短生产时间,降低提取成本,故将浸提时间确定为30 min。
由图1C可知,当浸提料水比在1∶10~1∶20 (w/v,g/mL)范围内变化时,发酵麸皮多糖含量随浸提料水比的增加而增加(p<0.05),当浸提料水比为1∶20 (w/v,g/mL)时,发酵麸皮多糖含量达到最大,浸提料水比在1∶20~1∶40 (w/v,g/mL)范围内变化时,发酵麸皮多糖含量不再继续增加(p>0.05)。提取液的增加有利于溶质的溶出,但过大的浸提料水比会增加溶剂的消耗,提高对提取设备的要求,会给后续浓缩干燥带来不便,因此,故将浸提料水比确定为1∶20。
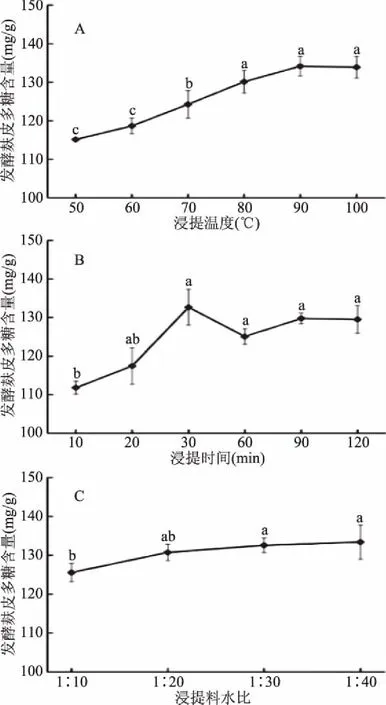
图1 浸提条件对发酵麸皮多糖含量的影响Fig.1 Effects of extraction conditions on fermented wheat branpolysaccharides production注:标示不同字母表示差异显著(p<0.05); 含有相同字母表示差异不显著(p>0.05)。
根据上述单因素试验结果,确定出的发酵麸皮多糖最佳提取条件为浸提温度80 ℃、浸提时间30 min和浸提料水比1∶20 (w/v,g/mL)。此条件下重复6次提取发酵麸皮多糖,得到发酵麸皮多糖含量为(151.57±3.25) mg/g,较提取工艺优化前发酵麸皮多糖含量(130.21±3.78) mg/g提高了21.36 mg/g。程彦伟等[15]研究确定的麸皮多糖最佳提取工艺为料水比1∶20 (w/v,g/mL)、提取温度100 ℃、提取时间2 h。康波等[16]利用单因素试验结合正交试验,确定出麦麸多糖的最佳条件为料液比1∶25 (w/v,g/mL)、提取时间4 h和提取温度100 ℃。本试验所得到的浸提温度相对较低,浸提时间较短,说明微生物发酵可能会破坏牢固的化合键,使麸皮多糖释放出来,因此,提取过程不需要过高的温度和过长的时间。
2.2 发酵麸皮多糖的单糖组成
混合标准单糖及发酵麸皮多糖酸水解衍生液的HPLC色谱图如图2所示。由图可见,发酵麸皮多糖的单糖组成包括甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖,其摩尔比分别为2.70∶0.62∶100.20∶4.34∶7.80∶12.23∶35.17,发酵麸皮多糖具有以葡萄糖为主的基本结构组成特征。王忠合等[17]利用超声波法提取麦麸多糖并用液相色谱法对其进行单糖组分测试,结果显示:单糖组成为葡萄糖、木糖、半乳糖、甘露糖,其比例为1.21∶0.57∶0.84∶1。Madhukumar等[18]用气相色谱法对水提醇沉制得的小麦麸皮水溶性多糖的化学组成成分进行了分析,结果表明,该小麦麸皮水溶性多糖是由鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖、葡萄糖按摩尔比1.3∶21.2∶38.5∶1.6∶26.4∶11.3组成。熊慧薇等[19]利用气相色谱法测定了麦麸膳食纤维中的单糖成分为鼠李糖、阿拉伯、木糖、甘露糖、葡萄糖和半乳糖,其比例为5.7∶103.9∶100.7∶7.3∶62.8∶9.8。本试验所测发酵麸皮多糖除了有甘露糖、鼠李糖、葡萄糖、半乳糖、木糖和阿拉伯糖,还含有岩藻糖,其中以葡萄糖含量最高,这可能是由于在微生物发酵过程中纤维素和半纤维素更多的被利用,促进发酵原料中植物多糖的溶出,且微生物自身也产生了胞外多糖。
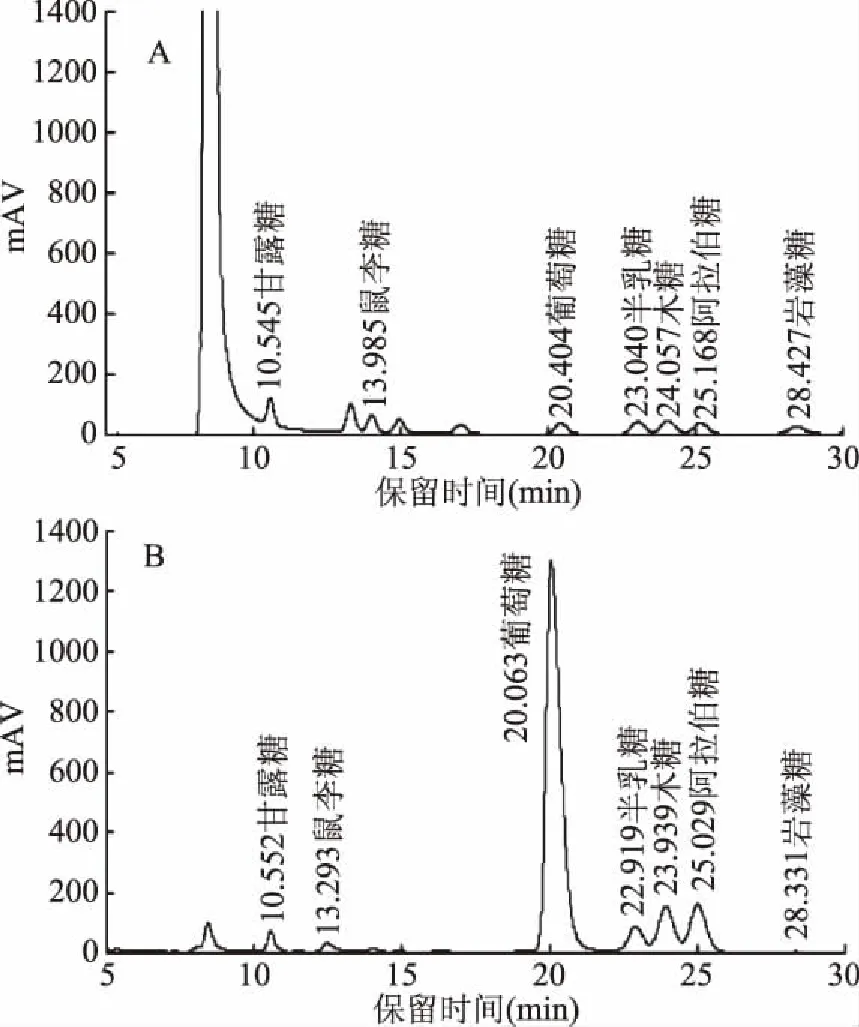
图2 混合标准单糖(A)及发酵麸皮 多糖酸水解衍生液(B)的HPLC色谱图Fig.2 HPLC chromatograms of standard monosaccharides(A) and derivatives of fermented wheat bran polysaccharides(B)
2.3 发酵麸皮多糖对大鼠血浆及肝脏组织中抗氧化相关指标的影响
2.3.1 大鼠血浆中抗氧化相关指标的变化 大鼠血浆中抗氧化相关指标如表1所示,与CT组相比,NC组中血浆CAT、GSH-Px和SOD活性、T-AOC以及GSH含量显著降低(p<0.05),而MDA含量显著升高(p<0.05)。CM组、CH组和PC组的GSH-Px活性显著高于NC组(p<0.05),其中CM组显著低于CT组(p<0.05),CH组、PC组与CT组差异不显著(p>0.05);CL组、CM组的MDA含量显著低于NC组,却显著高于CT组(p<0.05);PC组的GSH含量显著高于NC组,却显著低于CT组(p<0.05)。这表明灌胃发酵麸皮多糖可以缓解由敌草快引起的大鼠血浆中抗氧化相关酶和GSH含量的降低,抑制MDA水平的升高,并且具有剂量依赖效应。
2.3.2 大鼠肝脏组织中抗氧化指标的变化 大鼠肝脏组织中抗氧化相关指标如表2所示,与CT组相比,NC组肝脏组织中T-AOC和GSH-Px活性以及GSH含量显著降低,而MDA含量显著升高(p<0.05)。CH组肝脏组织中T-AOC、GSH-Px活性和GSH含量显著高于NC组(p<0.05),与CT组差异不显著(p>0.05);PC组肝脏组织中T-AOC和GSH-Px活性显著高于NC组(p<0.05),与CT组差异不显著(p>0.05),GSH含量显著低于CT组(p<0.05);CL组、CM组、CH组和PC组肝脏组织中MDA含量显著低于NC组(p<0.05),其中CL组、CH组和PC组与CT组差异不显著(p>0.05)。这表明灌胃发酵麸皮多糖可以缓解由敌草快引起的大鼠肝脏组织中抗氧化相关酶和GSH含量的降低,抑制MDA水平的升高,并且同样具有剂量依赖效应。
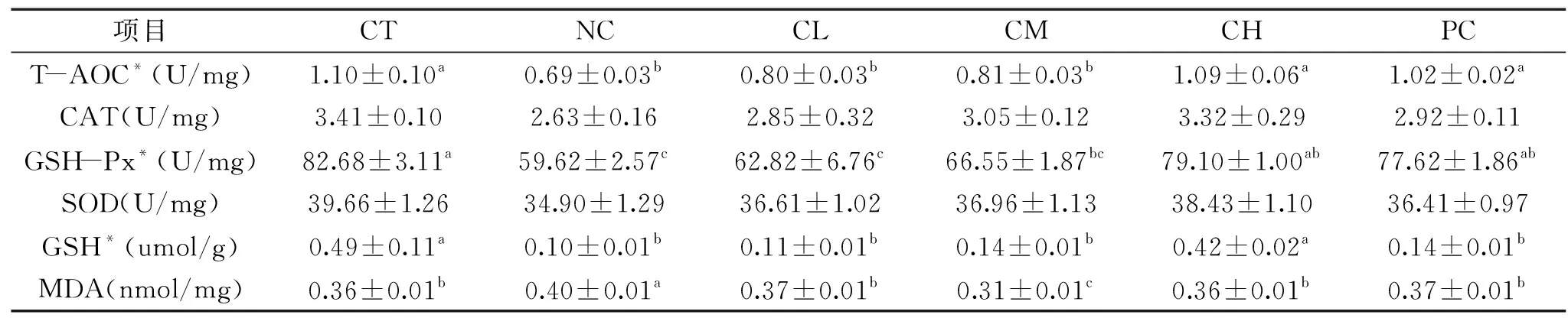
表2 发酵麸皮多糖对大鼠肝脏组织中抗氧化相关指标的影响Table 2 Effects of fermented wheat bran polysaccharides on theantioxidative status in the liver of rats
敌草快是二吡啶基除草剂,它能利用分子氧产生超氧阴离子和过氧化氢,继而产生其它自由基,诱导机体产生氧化应激[20]。本试验中,敌草快攻毒后的大鼠血浆和肝脏组织中T-AOC水平、CAT、SOD和GSH-Px活性以及GSH含量急剧下降(p<0.05),MDA含量显著上升(p<0.05),表明本试验氧化应激模型建立成功。灌服发酵麸皮多糖处理组大鼠血浆和肝脏组织中总抗氧化能力、抗氧化酶和GSH含量均高于敌草快攻毒组,MDA水平低于敌草快攻毒组,其中高剂量组大鼠的部分抗氧化指标恢复到正常组的水平,并且作用效果优于灌胃100 mg/kg维生素C。这一结果与Higuchi等[3]、Wang等[21]和王军等[22]对麸皮多糖抗氧化活性的研究结果一致。
3 结论
发酵麸皮多糖水提醇沉法试验结果表明,在料水比1∶20 (w/v,g/mL),温度80 ℃,提取30 min,发酵麸皮多糖含量较高,可达到151.57 mg/g。获得的发酵麸皮多糖的单糖组成比例为甘露糖∶鼠李糖∶葡萄糖∶半乳糖∶木糖∶阿拉伯糖∶岩藻糖2.70∶0.62∶100.20∶4.34∶7.80∶12.23∶35.17。灌胃发酵麸皮多糖对由敌草快诱导的大鼠氧化应激,有一定的缓解作用,可通过提高抗氧化酶和GSH含量,降低脂质过氧化的发生。
