响应面优化铜藻(Sargassum horneri)中 褐藻多酚的提取及其结构鉴定
2018-09-13王育信田晓清李骄洋屠璐丹谭淑云吴文惠
王育信,田晓清,李骄洋,屠璐丹,谭淑云,吴文惠,3,包 斌,3,*
(1.上海海洋大学食品学院,上海 201306; 2.中国水产科学研究院东海水产研究所,上海 200090; 3.上海海洋大学食品科学与工程国家级实验教学示范中心,上海 201306)
铜藻(Sargassumhorneri)俗称 “丁香屋”,属褐藻纲墨角藻目马尾藻科马尾藻属,是一种经济型大型褐藻[1]。铜藻主要分布于辽宁、浙江、福建和广东等沿海地区,在医药、食品、饲料中有较高的应用价值[2]。据《中华本草》和《广东中药志》记载,铜藻可用于治疗水肿、咳嗽、甲状腺肿大等疾病。除多糖、蛋白质、矿物质和脂类等营养成分外,铜藻中还含有萜类化合物、褐藻多酚等活性物质[3]。其中褐藻多酚(Phlorotannins)是一类间苯三酚(Phloroglucinol)的聚合物,主要存在于褐藻中,是细胞壁的结构成分。迄今为止已被鉴定的褐藻多酚有近百种。褐藻多酚具有多种活性,如抗氧化性、抗菌性、抗病毒性、抗炎症、抗肿瘤性、抗凝血性、抗糖尿病综合症和保护肝脏等活性[4-10]。因此从褐藻中提取得到褐藻多酚作为一种天然活性成分,具有成为新型药物和健康产品的巨大潜力[11]。有学者采用70%的乙醇溶液直接抽提后,分析铜藻多酚提取物中总酚含量[12];卢虹玉等[13]在室温条件下采用80%的甲醇溶液直接提取全缘马尾藻干粉,分别分析了水相萃取物和乙酸乙酯相萃取物中总酚含量;Sugiura等[9]在5 ℃下采用甲醇直接提取48 h,分别分析了昆布多酚粗提物和昆布乙酸乙酯萃取物中的总酚含量,而从铜藻中提取并分析褐藻多酚还未见报道。
本文采用超声辅助提取法,以褐藻多酚得率为指标,结合单因素实验分析法分析乙醇体积分数、液固比、超声提取时间三个因素,并通过响应面分析得出褐藻多酚最佳提取条件,并采取液相色谱仪联用四级杆串联飞行时间质谱仪(LC-TOF-MS)对分离萃取后的样品中褐藻多酚进行了初步分析鉴定。
1 材料与方法
1.1 材料与仪器
铜藻(Sargassumhorneri) 由上海海洋大学水产与生命学院提供;薄层层析硅胶 粒度200~300目,青岛海洋化工厂分厂;间苯三酚、2,4-二甲氧基苯甲醛 光谱纯,均购于国药集团化学试剂公司;无水碳酸钠、Folin-Ciocalteu试剂、无水乙醇、乙酸乙酯、冰醋酸、盐酸 分析纯,均购于国药集团化学试剂公司;水 蒸馏水。
SH-1000 Lab酶标仪 CORONA;ATX224型电子天平 日本岛津公司;1290LC-6224型LC-TOF-MS 安捷伦科技有限公司;CR-21G型冷冻高速离心机 株式会社日立制作所;DZF-6030型真空干燥箱 上海新苗医疗器械制造有限公司;DHG-9070A型鼓风干燥箱 上海一恒科学仪器有限公司;SB4200DT型超声清洗机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 样品前处理 将新鲜铜藻用清水洗涤,去除杂质沙泥,纱布滤干后55 ℃烘干,研磨过120目筛,细粉置阴凉干燥处备用。
1.2.2 单因素实验设计 对影响褐藻多酚超声提取的乙醇体积分数、液固比以及超声提取时间进行单因素试验,超声功率为400 W。精确称取铜藻干粉1 g,在液固比为30∶1 mL/g,超声提取时间75 min的条件下,探讨不同乙醇体积分数(0%、20%、40%、60%、80%、95%)对铜藻中褐藻多酚得率的影响;在乙醇体积分数为60%,超声提取时间75 min,探讨液固比(10∶1、20∶1、30∶1、40∶1、50∶1 mL/g)对铜藻褐藻多酚得率的影响;在乙醇体积分数为60%,液固比为40∶1 mL/g,探讨超声提取时间(15、30、45、60、75 min)对铜藻褐藻多酚得率的影响;收集残渣并反复提取3次,旋转蒸发后定容至50 mL。
1.2.3 褐藻多酚的响应面试验 根据单因素分析结果,响应面试验采用铜藻干粉1 g;选用乙醇体积分数、液固比以及超声提取时间作为试验因素,以褐藻多酚得率作为响应面值,设计三因素三水平17个试验点5个中心点的响应面优化试验,响应面因素间水平设计见表1。
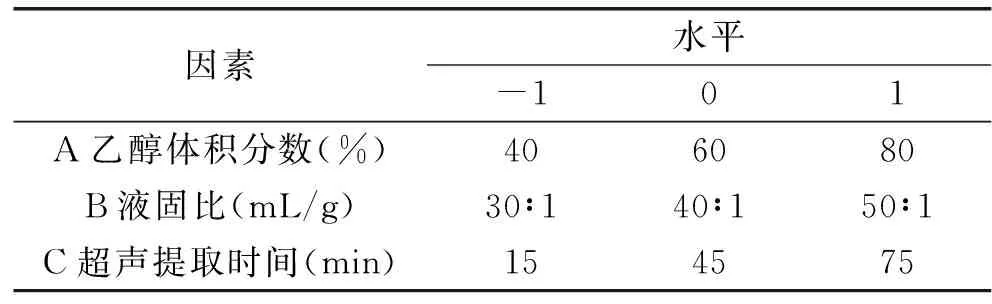
表1 响应面分析因素及水平Table 1 Analytical factors and levels for response surface methodology
1.2.4 褐藻多酚得率的测定(DMBA法) 参照文献[14-16]方法略有改动。配制浓度为0、0.005、0.01、0.05、0.1、0.15 mg/mL的间苯三酚标准溶液。吸取50 μL样品与标准溶液于96孔板中,加入125 μL的6%盐酸冰醋酸溶液,5 min后样品及标准曲线加入125 μL的2% 2,4-二甲氧基苯甲醛冰醋酸溶液,样品空白加入125 μL的冰醋酸。放置1 h,在520 nm处测吸光度。根据标准曲线(y=18.805x+0.0031,R2=0.9999)得到褐藻多酚得率(mg/mL)并计算得率。
褐藻多酚得率的计算公式如下:
式中:M1:褐藻多酚的含量(mg);m0:铜藻干粉的质量(g)。
1.2.5 总酚的测定 参照Folin-Ciocalteu法[17],配制为0、6.25、12.5、25、50、100 μg/mL 的间苯三酚标准溶液。吸取20 μL样品于标准溶液于96孔板中,样品及标准溶液加入100 μL的Folin-Ciocalteu试剂,混匀8 min后加入7.5%的碳酸钠溶液。样品空白加入180 μL的蒸馏水。蒸馏水200 μL为校准。避光放置2 h后,在730 nm 处测吸光度。根据标准曲线(y=0.0059x+0.0057,R2=0.9995)得到总酚得率(g/mL)并计算得率。
总酚得率的计算公式如下:
式中:M2:总酚的含量(g);m1:铜藻干粉的质量(g)。
1.2.6 褐藻多酚与总酚的相关性分析 运用SPSS软件以褐藻多酚得率为横坐标,总酚得率为纵坐标,分析褐藻多酚得率与总酚得率的关系。
1.2.7 铜藻多酚提取物的分离纯化 参考Sugiura等[9]的方法略有改动。在最优提取条件下,用乙醇溶液提取铜藻干粉,经旋转蒸发得到铜藻乙醇提取液,用乙酸乙酯以体积比1∶1的比例萃取铜藻乙醇提取液七次,得到铜藻乙酸乙酯萃取液,旋转蒸发至干物,得到乙酸乙酯馏分,过硅胶柱(3.0 cm×250 cm)分离。流动相:二氯甲烷∶甲醇200∶1~6∶4,得到25个馏分,用DMBA法测定褐藻多酚得率,合并含有褐藻多酚的馏分。真空干燥后溶于甲醇,配制4 mg/mL的溶液,过C18预处理柱,待LC-TOF-MS鉴定。
1.2.8 LC-TOF-MS条件
1.2.8.1 色谱条件 参照Ferreres等[18]方法略有改动。色谱柱:YMC-Pack ODS-AQ C18(75×4.6 mm,3 μm);柱温20 ℃。流动相:以0.1%甲酸甲醇为A相,0. 1%甲酸乙腈为B相;程序洗脱:0 min,0% B;5 min,0% B;15 min,30% B;17.5 min,80% B;20 min,80% B;22.5 min,0% B;保持3.5 min;26 min。流速:0.3 mL/min,进样量5 μL,进样温度4 ℃;DAD波长扫描范围200~400 nm;紫外检测波长280 nm。
1.2.8.2 质谱条件 干燥气氮气流速8.0 L/min;干燥气温度350 ℃;雾化气压力40 psig;裂解电压175 V;毛细管电压4000 V;质谱扫描范围:m/z 100~1800。
质量校正:参比溶液通过参比Nebulizer与样本同时导入离子源进行实时参比,正离子模式下选择离子322.048132、622.028960和922.009798。
1.3 数据统计分析
本实验所有样品均为三次平行。本文作图采用OriginPro 8.0软件,响应面分析采用Design-Expert 8.0.6 Trail软件;利用SPSS statistic 19进行显著性分析以及相关性分析,利用Qualitative Analysis B.04.00对LC-TOF-MS 的结果进行分析。
2 结果与讨论
2.1 褐藻多酚得率的单因素试验
2.1.1 乙醇体积分数对褐藻多酚得率的影响 由图1可知,铜藻中褐藻多酚得率随乙醇体积分数增大呈先升高而后降低的趋势。在0%~60%之间,褐藻多酚提取得率随乙醇体积分数增大而增大,而乙醇体积分数大于60%时,褐藻多酚得率随乙醇体积分数变大而降低。即在提取试剂乙醇的体积分数在60%能达到峰值。这是由于乙醇中的水能够促进铜藻中的许多黏性物质和外来水分互溶形成胶团从而影响褐藻多酚得率,而体积分数过大的乙醇挥发性较大,使提取液极性降低也会影响褐藻多酚得率[19]。因此,乙醇体积分数选择60%较为适宜。
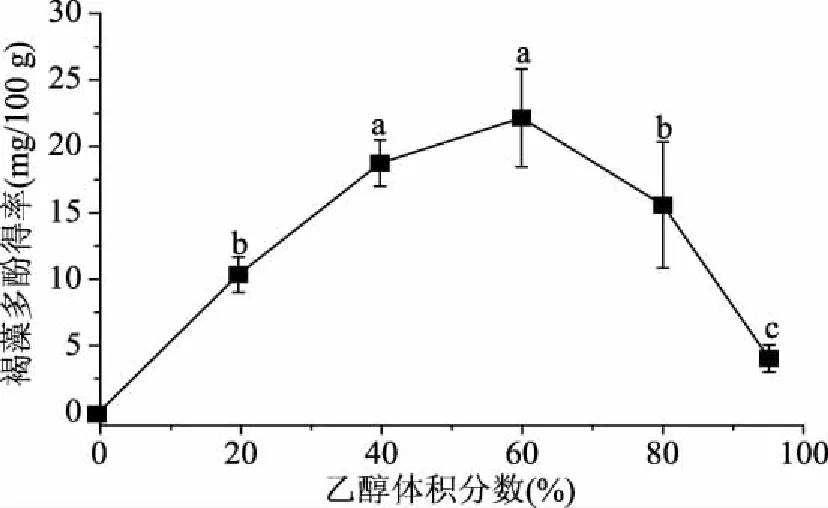
图1 乙醇体积分数对褐藻多酚得率的影响Fig.1 Effect of ethanol concentration on extraction yield of phlorotannins注:图中不同小写字母表示显著性差异(p<0.05),图2~4同。
2.1.2 液固比对提取褐藻多酚的影响 从图2可知,随着液固比的增加,褐藻多酚得率显著提高,达到40∶1 mL/g后,逐渐趋于平稳。再增加液固比,提取率未增加,而且由于乙醇用量增加,成本增加,且不利回收。因此选择液固比为40∶1 mL/g。
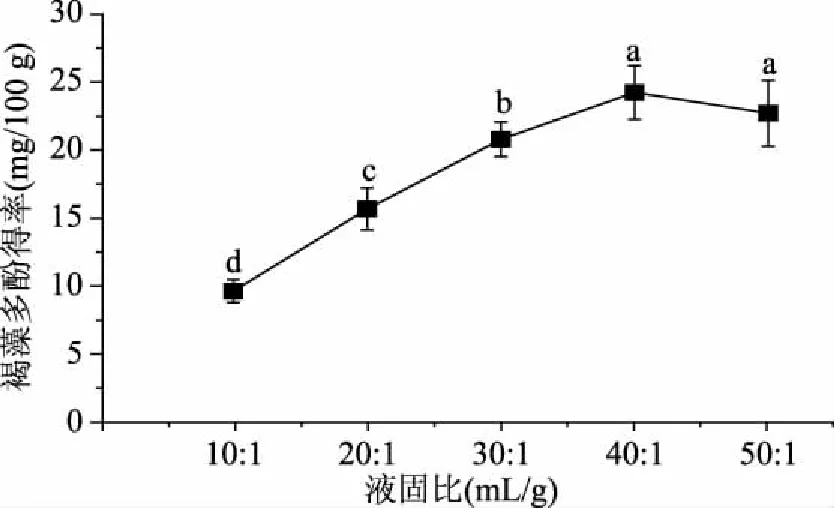
图2 液固比对褐藻多酚得率的影响Fig.2 Effect of liquid-solid ratio on extraction yield of phlorotannins
2.1.3 超声提取时间对提取褐藻多酚的影响 由图3可见,当乙醇体积分数和液固比一定时,超声提取时间在45 min时褐藻多酚得率最高,而后缓慢下降。这可能是因为提取时间过长,褐藻多酚会被氧化或降解[19]。所以超声时间过长不利于褐藻多酚的提取,45 min较为适宜。
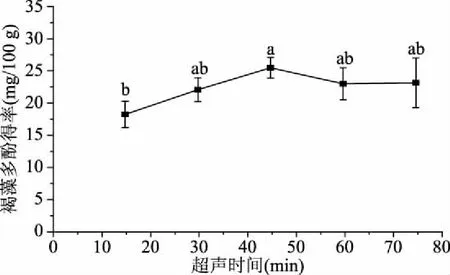
图3 超声时间对褐藻多酚得率的影响Fig.3 Effect of extraction time on extraction yield of phlorotannins
2.2 褐藻多酚得率的响应面分析
2.2.1 响应面分析 根据单因素褐藻多酚得率的结果,以提高褐藻多酚得率为目的,考察乙醇体积分数、液固比和超声提取时间对铜藻中褐藻多酚得率的影响,分析结果见表2。
2.2.2 回归模型的建立与方差分析 利用Design-Expert软件对表2数据进行二次回归拟合,得到褐藻多酚得率对乙醇体积分数、液料比和超声提取时间的回归模型:
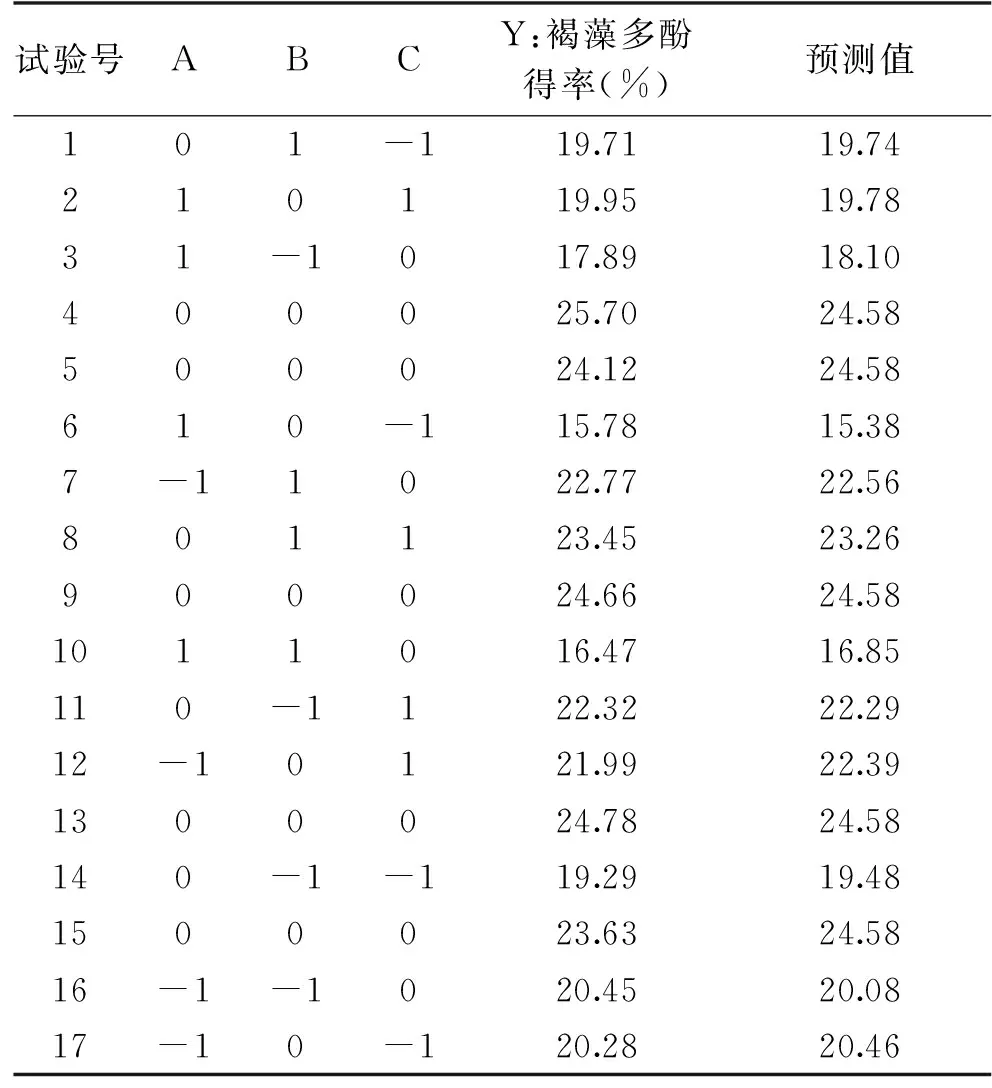
表2 Box-behnken超声波辅助提取褐藻多酚试验Table 2 Box-behnken design, ultrasonic-assisted extraction of phlorotannins experiment
Y=-43.17629+1.07518×A+1.68151×B+0.13134×C-4.66425×10-3×A×B+1.02663×10-3×A×C+5.93667×10-4×B×C-8.59142×10-3×A2-0.017472×B2-1.82157×10-3×C2
如表3方差分析所示,超声波辅助提取褐藻多酚得率试验模型非常显著(p<0.0001),表示回归模型指标高度显著;R2=0.9768,失拟误差不显著(p>0.05),说明该模型拟合程度良好。信噪比为17.628,远远大于临界值4,说明该模型与实际值拟合度良好。
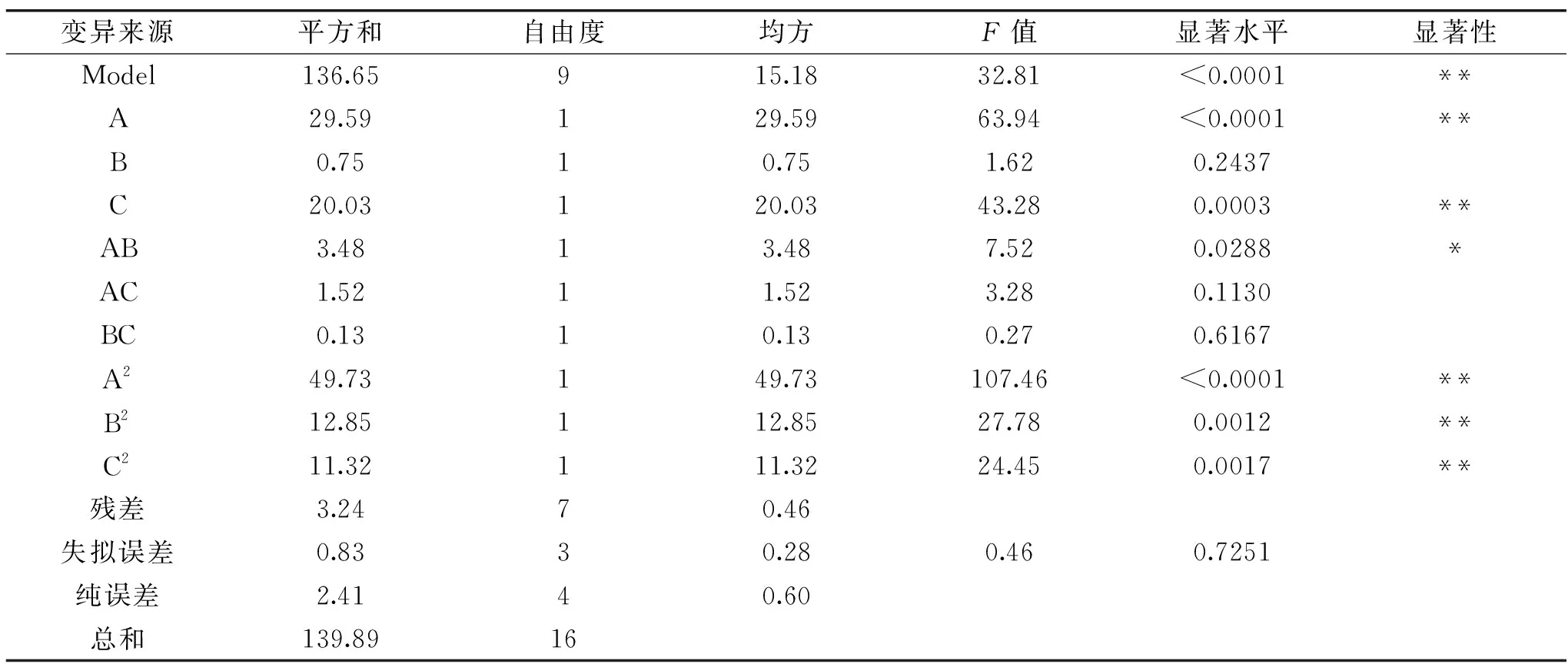
表3 超声波辅助提取的方差分析Table 3 Analysis of variance for regression model regarding ultrasound-assisted extraction
回归方程的各项显著性表明:一次项A(p<0.0001)、C(p<0.01),交互项AB(p<0.05)对铜藻褐藻多酚得率影响显著;二次项A2(p<0.0001)、B2(p<0.01)、C2(p<0.01)对铜藻中褐藻多酚得率影响极显著。方差分析表中的F值及p值可知,影响褐藻多酚得率的主次顺序依次为乙醇体积分数、超声提取时间、液固比,乙醇体积分数和超声提取时间对响应值影响比较大。
2.2.3 超声辅助提取响应面的分析及优化 图4~6反映了所考察的三个因素(乙醇体积分数、液固比和超声提取时间)任意因素取零水平时,其他两因素交互作用对褐藻多酚得率的影响程度。图4曲面陡峭,说明乙醇体积分数和液固比交互作用显著,乙醇体积分数对得率的影响较大,最初随液固比的增加,褐藻多酚得率迅速增大,之后随液固比的增加反而有开始下降;图5可知,乙醇体积分数和超声提取时间交互作用不显著,褐藻多酚得率随着乙醇体积分数的增大和超声提取时间的延长均出现先增大后减小的趋势;图6可知,液固比和超声提取时间交互作用不显著,褐藻多酚得率随着液固比的增大和超声提取时间的延长均出现先增大后减小的趋势。
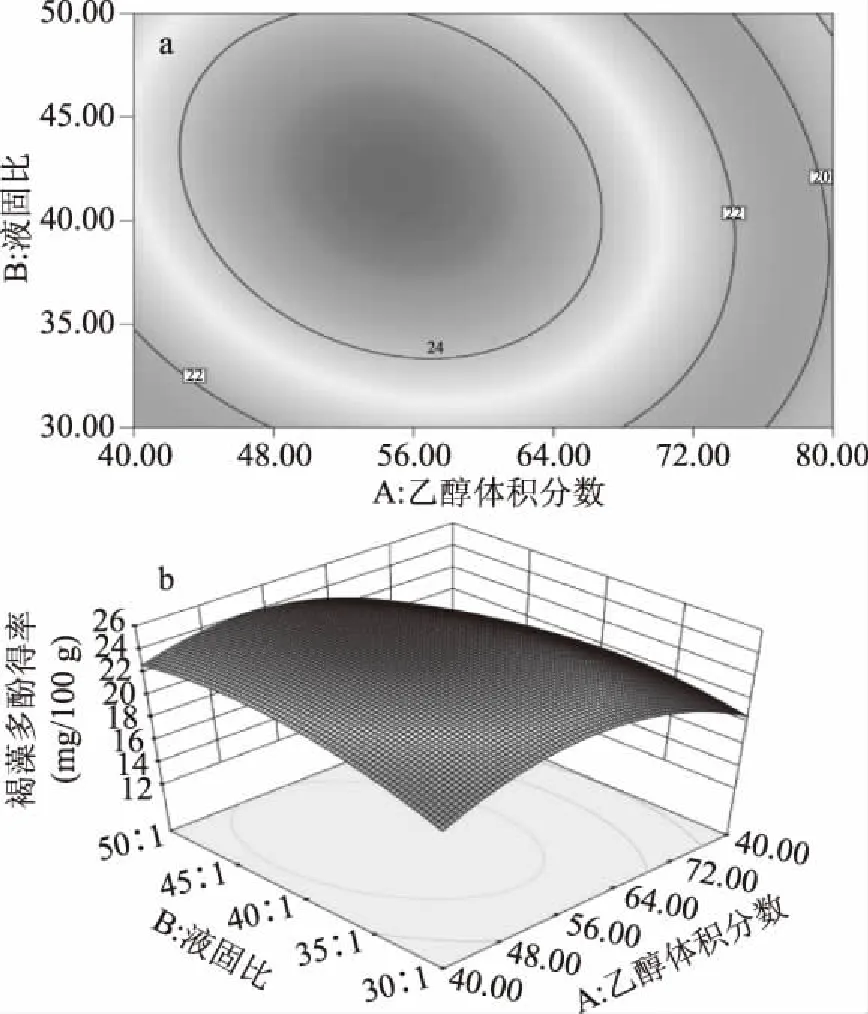
图4 乙醇体积分数与液固比对褐藻多酚 得率影响的等高线图(a)和响应面图(b)Fig.4 Response contour plots(a)and the surface diagram(b)of ethanol concentration and liquid-solid ratio impacting on extraction yield of phlorotannins
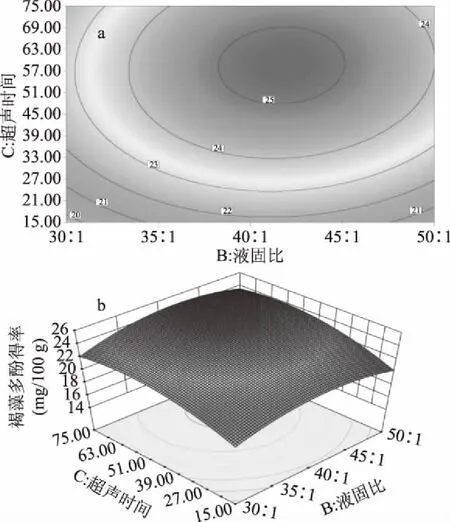
图6 液固比与提取时间对褐藻多酚得率影响的 响应面图(a)和等高线图(b)Fig.6 Response contour plots(a)and the surface diagram(b)of solid-liquid ratio and extraction time impacting on extraction yield of phlorotannins
通过响应面分析,得到超声波辅助提取铜藻中的褐藻多酚的最佳工艺条件是:乙醇体积分数为 54.72%,液固比为41.80∶1 mL/g,提取时间为58.3 min。在此工艺条件下,褐藻多酚得率的理论预测值为25.21 mg/100 g。为了便于试验操作,最优条件简化为:乙醇体积分数55%、液固比42∶1 mL/g、提取时间58 min。在最优条件下,通过实验进行验证,得到褐藻多酚的得率为(25.16±0.34) mg/100 g。与预测值相比,比较误差在0.20%。表明实验所得回归方程的最大预测值与验证值非常接近,说明回归方程能较真实地反映各筛选因素的影响,建立的模型与实际情况比较吻合。
2.3 褐藻多酚得率与总酚得率的相关性分析
采用SPSS 19.0对单因素中45个样品所得总酚得率和褐藻多酚得率进行双变量相关性分析(如图7),其相关系数为0.803,p<0.0001,非常显著。即在铜藻多酚提取物中,随着总酚的增加,褐藻多酚也相应增加,可以确定DMBA法测得的褐藻多酚与Folin-Ciocalteu法测得的总酚之间呈正相关。Folin-Ciocalteu法的原理为酚类物质在碱性条件下与磷钼酸盐发生氧化还原反应生成蓝色混合物,样品中所有羟基苯基团均发生此反应,不具有特异性,因此该方法用于总酚的测定。DMBA法的原理是酚类物质与醛发生显色反应,是1,3-羟基苯基团和1,3,5-羟基苯基团发生的特异性反应,因此可用于褐藻多酚的测定。由于褐藻多酚是总酚的一部分,因此两者呈正相关关系,在绝大多数情况下总酚得率可以反映褐藻多酚的得率。但是对于以邻位羟基酚为主的样品,若采用Folin-Ciocalteu法所得结果代表样品中的褐藻多酚得率,会导致结果偏高,而采用DMBA法才能更准确分析样品中褐藻多酚的得率。
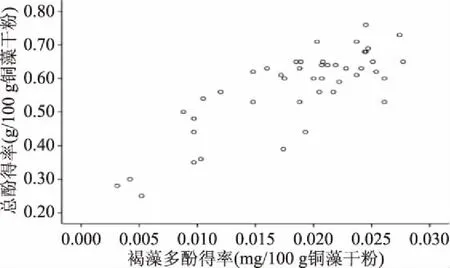
图7 褐藻多酚得率与总酚得率的相关性分析结果Fig.7 Correlation analysis results between phlorotannins and total phenol
2.4 LC-TOF-MS鉴定提取物中褐藻多酚的结构
利用LC-TOF-MS,在合并的馏分中鉴定出1个化合物(如图8),该化合物在保留时间为14.8 min正离子模式下分子离子峰为m/z 375[M+H]+,其平均分子量为374.3036,理论值为374.2984,分子式为C18H14O9。分子离子经电喷雾离子化裂解为 m/z为357和232的碎片峰,其中脱去水后形成特征碎片m/z 357[M+H—H2O]+,脱去间苯三酚及羟基氧形成离子碎片m/z 232[M+H—O-C6H6O3]+。由此结果可知此化合物为C-O-C氧化酚连接起来的间苯三酚三聚体[20]。酚类物质在波长在280 nm下具有紫外吸收[21],该馏分在280 nm下的紫外吸收色谱图中保留时间为14.8 min处有可见吸收,进一步佐证了该化合物的结构。
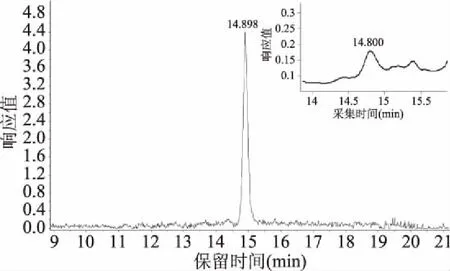
图8 m/z为375的离子流色谱图和波长为 280 nm下的紫外吸收色谱图Fig.8 EICFigure of m/z=375 and UV absorption spectra at wavelength 280 nm
迄今发现分子量为374.3036的褐藻多酚有6个,分别是:Fucophlorethol-A、Fucophlorethol-B、Fucophlorethol-C、Triphlorethol A、Triphlorethol C、Trifucol。其中前五种褐藻多酚的结构中有C-O-C氧化酚连接。Fucophlorethol-A、Fucophlorethol-B、Fucophlorethol-C、Triphlorethol C分别从墨角藻(Fucusvesiculosus)[22]、褐藻(Laminaraiaochroleuca)[23]和Eiseniabicyclis[24]、Colpomeniabullosa[25]、Laminariaochroleuca[23]中被发现。Triphlorethol A是一种常见的三聚体,广泛地存在于Cystophoraretroflexa[26]、昆布Eckloniastolonifera[27]、马尾藻(Sargassumspinuligerum)[28]和昆布Eckloniacava[29]。铜藻是马尾藻属,初步推测该化合物是Triphlorethol A(如图9)。
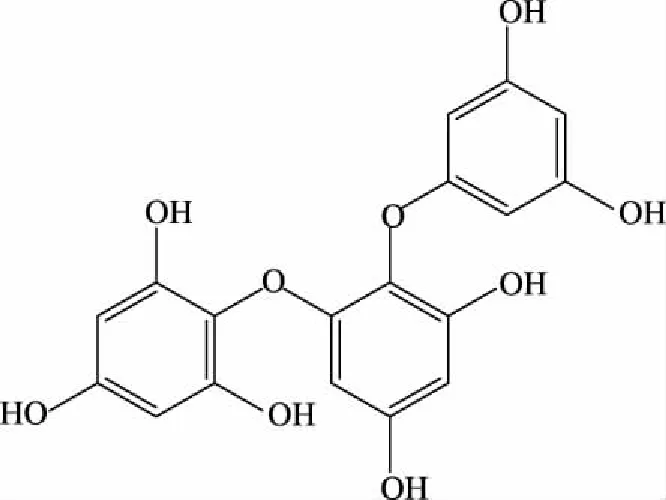
图9 Triphloretol A的结构式Fig.9 The structural formula of Triphloretol A
3 结论
用超声波辅助法提取铜藻中的褐藻多酚得率的最佳工艺条件为:乙醇体积分数为55%,液固比为42∶1 mL/g,提取超声时间为58 min。在此条件下,褐藻多酚得率实际值为(25.16±0.34) mg/100 g。对于所得到的铜藻多酚提取物,Folin-Ciocalteu法测得的总酚得率与DMBA法测得的褐藻多酚得率呈正相关性。通过LC-TOF-MS鉴定出一种间苯三酚三聚体,推测该化合物为Triphlorethol A。
