野生猕猴桃酿酒酵母的 筛选及其发酵特性
2018-09-13王荣荣刘坤峰王梦楠
王荣荣,刘坤峰,朱 静,*,王梦楠
(1.信阳农林学院食品学院,河南信阳 464000; 2.南昌大学食品学院,江西南昌 330031)
野生猕猴桃营养丰富,富含糖、蛋白质、氨基酸等多种有机物和人体必需的矿物质,尤其VC含量高达100~420 mg/100 g,被称为“VC之王”。野生猕猴桃主要分布在大别山山脉、陕西秦岭山域以及湖南西部等地区。野生猕猴桃的营养、药用、保健价值及食用方法备受消费者关注[1]。由于野生猕猴桃的贮藏期短,目前仍以鲜销为主,野生猕猴桃深加工利用率明显不足。
为改善猕猴桃不耐贮藏,尤其是野生猕猴桃资源的浪费现象,开发野生猕猴桃附加产品对其综合利用具有重要的意义和开发前景[2]。近年来,对于野生猕猴桃酒的研究工作主要集中在国内,罗安伟等[3]和周一琴等[4]从不同品种猕猴桃果实上筛选出3株起酵速度较快的酵母菌株,但利用这些酵母菌株发酵的野生猕猴桃酒,其不足在于香气不突出,典型性不强,品质不佳,缺乏与其相匹配的先进生产工艺[6]。徐清萍等[5]在野生猕猴桃果实上筛选出发酵能力强、产香较好及耐受性较强的酵母菌株,但不同地域的野生猕猴桃由于营养成分的差异,筛选出的猕猴桃果酒酵母并不能适应整个国内野生猕猴桃酒的生产,不同地区的野生猕猴桃专用酵母的研究还不完善。因此,本研究针对猕猴桃酒生产中缺乏专门的、优良的酿酒酵母问题[7],筛选出适合大别山区猕猴桃酒的酿酒酵母,对提高猕猴桃酒的发酵速率以及改善猕猴桃酒的品质有非常重要的意义。
本试验拟从大别山区商城县采摘的成熟野生猕猴桃果皮中分离筛选出酵母菌种,并进行猕猴桃汁发酵酿酒和耐受性研究,筛选出产酸、产酒能力、口感均较佳的猕猴桃酒酵母菌种。
1 材料与方法
1.1 材料与仪器
野生猕猴桃 信阳商城大别山山脉;普通猕猴桃 当地超市;氢氧化钠、偏重亚硫酸钾 天津市巴斯夫化工有限公司;乙醇 开封市方晶化学试剂有限公司;YEPD培养基、蛋白胨、琼脂、酵母膏 北京奥博星生物技术有限公司;葡萄糖 天津市大茂化学试剂厂。
SW-CJ-1C型双人双面净化工作台 苏州净化设备有限公司;SHP-Ⅲ型生化培养箱 上海山连试验设备有限责任公司;LDZX-50FA型立式压力蒸汽灭菌器 上海申安医疗器械厂;JC303型电热恒温培养箱 上海成顺仪表有限公司和南通嘉程仪器有限公司合作出品;美澳纯酿酒机 MA-A1-159型中山市小榄镇美澳塑胶制品厂;手持糖度仪 上海众林机电有限公司。
1.2 实验方法
1.2.1 猕猴桃汁制备 将新鲜的猕猴桃去皮,称取500 g,切碎打浆,加糖调节糖度到21%。将偏重亚硫酸钾(60 mg/L)(SO2)溶于经灭菌过的含有10 mL水的广口瓶中,加入打浆好的猕猴桃汁液、果胶酶(100 mg/L),封口。在45 ℃电热恒温培养箱中静置酶解8 h,4 ℃冷藏备用。
1.2.2 酵母的分离 将1.2.1中的猕猴桃汁分装100 mL于已灭菌的250 mL三角瓶中,每个三角瓶加3 g野生猕猴桃果皮(选取不同部位)于28 ℃培养4~5 d。
选取感官判断带有明显酒味且无异味的两瓶发酵液[7,14],取1 mL进行10倍系列的稀释(10-1、10-2、10-3、10-4、10-5),将稀释液分别取100 μL涂布于YEPD培养基上,每个浓度涂布5个平板,编号,28 ℃培养3 d。挑选形态不同长势较好的菌落采用平板划线法四次纯化,获得单菌落,对其编号后接入YEPD斜面培养基,4 ℃保存备用[4-5]。
对分离获得的5株典型酵母(M1~M5),采用WL培养基进行形态观察[6],杜氏管进行产气测定[5]和1.2.1中的猕猴桃汁进行发酵过程中降糖能力测定(可溶性固形物)。
1.2.3 酵母的酿酒特性
1.2.3.1 酵母耐受性 采用YEPD培养基,调整SO2、酒精和糖的浓度,按5%(0.65×106cfu/mL)接种M1~M5酵母菌株,于25 ℃发酵48 h,采用血球计数板测定发酵液中的菌体细胞数,不接种酵母的猕猴桃原汁的菌体细胞数做空白对照,每组3个平行。其中耐SO2的测定:取经偏重亚硫酸钾调整的SO2浓度为200~350 mg/L的猕猴桃汁;耐酒精能力的测定:取经无水乙醇调整乙醇含量为10%vol~16%vol;耐糖能力的测定:取经葡萄糖调整葡萄糖浓度为200~350 g/L。
1.2.3.2 酵母的发酵特性 采用1.2.1的方法制备猕猴桃汁,酵母菌(M1~M5)接种量为5%(0.65×106cfu/mL),避光,25 ℃条件下进行初发酵,每天观测起泡状态、出液情况、猕猴桃果渣的状态,测其降糖,监控发酵过程。8 d后基本无气泡产生,果渣下沉,可溶性固形物保持在4 Brix[7],发酵基本停止,进行酒精度、总酸理化指标的测定,并进行感官评定。
1.2.4 理化指标测定 糖度:手持糖度仪法;酒精度、总酸参照GB/T 15038-2006测定;VC含量的测定:2,6-二氯酚靛酚法[8]。
1.2.5 酵母菌产气测定 分离得到的酵母菌株接入杜氏小管中,28 ℃培养,在不同时间段测定其产气情况[9]。
1.2.6 感官评定 由10位经验丰富,具有专业知识的人员组成感官评定小组对产品进行感官评定。猕猴桃酒的感官评定标准如表1所示,参照孙洪浩[10]的方法,略微修改。

表1 猕猴桃酒发酵液的感官评价标准Table 1 Kiwi wine fermented liquid of sensory evaluation standard
1.3 数据处理
数据采用Origin 8.0软件进行图形绘制。
2 结果与分析
2.1 酵母菌的分离
2.1.1 酵母形态观察 通过显微镜观察和WL的初步筛选,得到多端出芽、菌落颜色为奶油色(浅黄色)至绿色,表面为球形突起光滑,不透明,奶油状的菌株有5株,分别编号为M1~M5。菌落形态如表2和图1所示,M1~M5菌株都是奶白色或浅绿色或深绿色,圆形或椭圆形。

表2 酵母菌落形态Table 2 The colonial morphology of yeast

图1 酵母菌落形态Fig.1 The colonial morphology of yeast
2.1.2 酵母的发酵力 酵母菌在不同时间段产气情况结果如表3所示。有3株酵母菌产气较明显,分别是M2、M4和M5,其中M2、M4和M5所产气体充满整个杜氏管,这些产气能力强的酵母极可能主发酵力强,但后续还需根据其他实验结果确定最适酵母菌株。
表3 杜氏小管发酵情况Table 3 The fermentation of duchenne tubules
发酵是在无氧条件下,酵母菌分解可溶性固形物等有机物,产生酒精和CO2的过程。而降糖速度,即可溶性固形物分解速度反映了目标菌株的发酵能力[7,11]。M1~M5号菌株发酵果酒过程中,可溶性固形物的变化曲线如图2所示。其中M2的降糖能力最强,M5次之,M3在前3 d降糖高于M4和M1外,但后期其降糖能力较这两株菌有所降低。
图2 可溶性固形物含量变化Fig.2 The content changes of soluble solid
2.2 酵母的酿酒特性
2.2.1 酵母耐受性
2.2.1.1 酒精耐受性测定 耐酒精能力强的酵母可使发酵更彻底,显著提高果酒的酒精度。酒精达到一定浓度会抑制酵母菌的生长,过高浓度的酒精使酵母菌中毒致死[12]。
不同酵母对不同酒精度的耐受性(10%vol~16%vol)如图3所示。酒精度在10%vol~12%vol范围内,这5株酵母生长状况良好,其中M2和M5耐受性更强。酒精浓度14%vol~16%vol范围内,酒精度对5株酵母的生长均有很大程度的抑制,随着酒精度的增加,抑制作用更强。在10%vol~12%vol时,耐受性依次为M5>M2>M4>M3>M1,M5总体酒精耐受性较好,M1和M3较差。
图3 酵母在不同酒精浓度时YEPD培养基中的生长情况Fig.3 Growth of yeast in YEPD medium under different alcohol concentrations
2.2.1.2 糖耐受性测定 糖是酵母发酵的底物,是转化为酒精的主要来源,也为酵母提供能源物质。适宜的糖浓度可使酵母的代谢更旺盛,但高浓度糖对酵母有抑制作用。因而,优良的酵母应对高糖浓度产生的渗透压具有较好的耐受性[13]。
不同酵母对不同糖浓度的耐受性如图4所示。糖浓度200~300 g/L时,5株酵母的生长状况良好,但当浓度升高至350 g/L时,酵母的生长均受到不同程度的抑制。M1、M2和M5在300 g/L的糖浓度时生长情况良好,有较好的耐受性。
图4 酵母在不同糖浓度时YEPD培养基中的生长情况Fig.4 Growth of yeast in YEPD medium under different glucose concentrations
2.2.1.3 SO2耐受性测定 SO2的添加既能抑制有害微生物,又能防止果汁被氧化,但其对酵母会产生胁迫作用,从而影响发酵程度[14]。
酵母在不同浓度(200~350 mg/L)的生长情况见图5。SO2浓度在200~250 mg/L时,5株酵母的生长基本不受抑制;300~350 mg/L时,对5株酵母的生长均有明显的抑制作用。其中M2和M5能耐受300 mg/L的SO2。
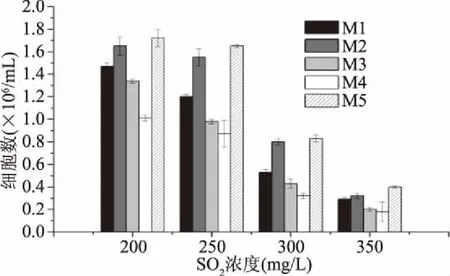
图5 酵母在不同SO2浓度时YEPD培养基中的生长情况Fig.5 Growth of yeast in YEPD medium under different SO2 concentrations
2.2.2 酵母的发酵特性
2.2.2.1 果酒发酵状态观察 猕猴桃酒发酵过程中发酵状态如果肉的状态、发酵液澄清度、起泡产量等可反应酵母菌的发酵速度,即发酵力。发酵过程观察5 d(发酵旺盛期)和8 d(发酵基本终止)的果酒发酵状态如图6和表4所示。M2和M5果肉上浮较快,发酵液澄清度较高,分层明显,因此发酵速度较快。
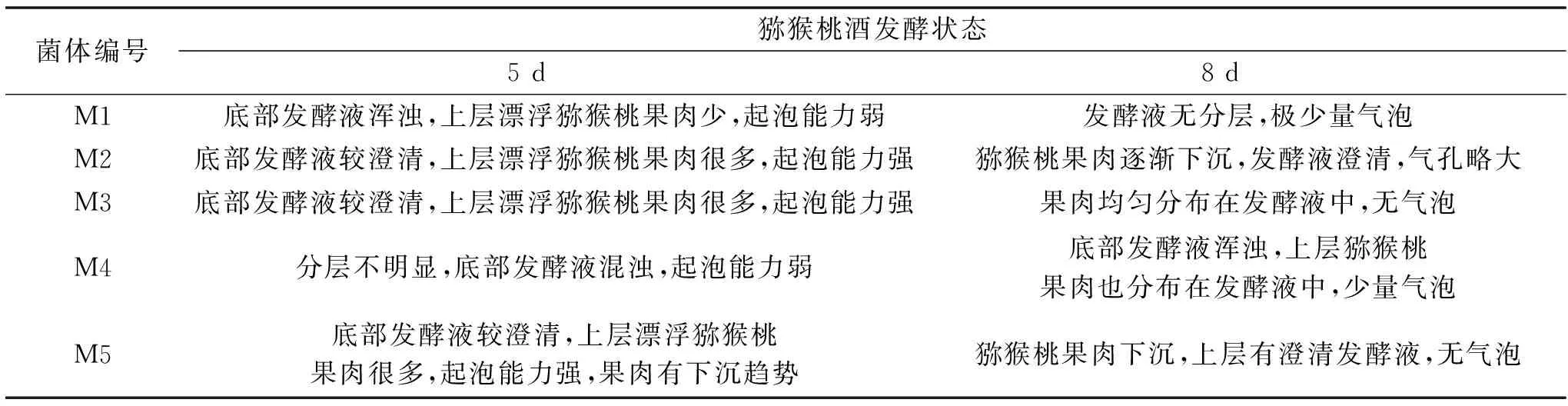
表4 发酵第5、8 d发酵情况记录结果Table 4 States of fermentation of kiwi wine(fermented after 5,8 days)

图6 第5 d(a)和8 d(b)猕猴桃酒的发酵状态Fig.6 States of fermentation of kiwi wine at 5 days(a)and 9 days(b)
2.2.2.2 猕猴桃酒特性 酒精度、酸度是评判猕猴桃酒酵母菌株发酵效果的重要指标,酵母菌株需在较短时间达到一定的产酒量(猕猴桃酒的最佳酒精度在8%vol~13%vol),而酸度过高会使猕猴桃酒口感不愉悦,酸度过低则使口感趋于平淡[15-16],猕猴桃干酒成品的酸度通常为0.4~0.8 mg/100 mL(以柠檬酸计)[17]。
测定不同菌株发酵8 d后的酒精度、总酸和VC含量如表5所示。其中M2的酒精度最高为10.9%vol,M3的酒精度最小为8.3%vol,酒精度转化未见较大差距。M2总酸最高为0.9 g/100 mL,M1、M3和M4总酸较低为0.6 g/100 mL。VC含量差异不大,其中M5酿造的果酒VC含量最高。
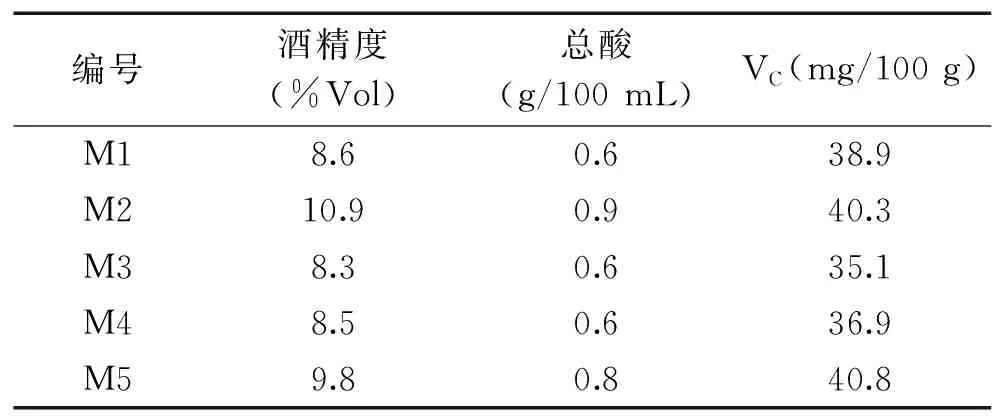
表5 不同菌株发酵的猕猴桃酒指标Table 5 Indicators of kiwi wine fermented by different strains
2.2.2.3 猕猴桃酒的感官评价 果酒作为饮品,外观和口感对于产品非常重要,发酵过程中的泡沫多少对于工业生产亦有较大影响,大量泡沫对工业生产很不利[16]。因此野生猕猴桃专用酵母应该使发酵液具有澄清透明、光泽好等特点,且口感良好。本试验对猕猴桃酒的澄清度、光泽、香味、色泽和口感五个方面作出评分,评分结果如表6所示。
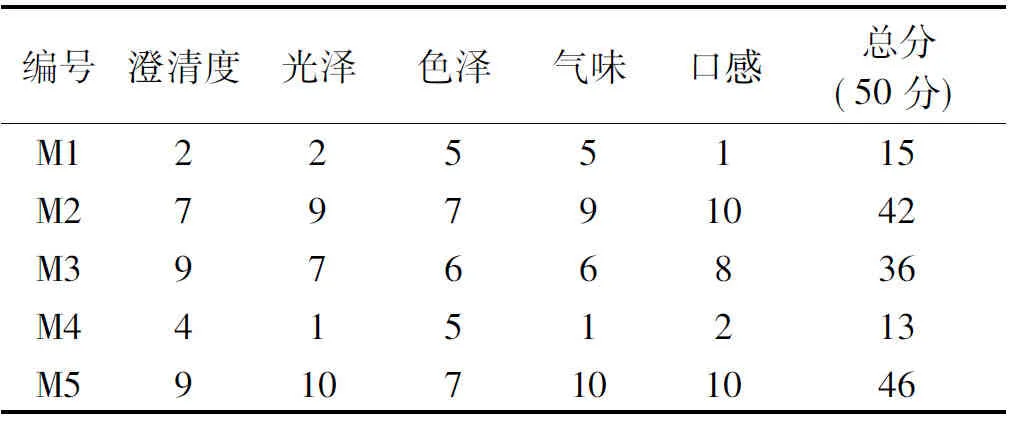
表6 猕猴桃酒的感官评鉴Table 6 Sensory evaluation of Kiwi wine
由表6可看出,M1发酵液不澄清,光泽度差,香味一般,且口感平淡;M4有异杂味;M3发酵液澄清,但不具有猕猴桃典型风味;而M2和M5发酵液口感适中,具有猕猴桃典型风味,但M2澄清度和光泽方面略逊于M5。
综合上述结果,M5产气能力良好,其降糖能力仅次于M2,能够耐受14%vol的酒精度,而M2耐受酒精的能力较差,M5可耐受300 g/L的糖和300 mg/L SO2,其酿造的猕猴桃酒8 d时,酒精度仅次于M2,综合发酵状态和感官评鉴结果,M5最适合发酵猕猴桃酒。周一琴等[4]从猕猴桃表面筛选出一株能够耐受SO2浓度27.5 mg/L、酒精度可达9.8%vol产香能力好的菌株X7-1。本文M5菌株在SO2耐受性方面较X7-1好。蒋成等[18]筛选的菌株L36,能够耐受酒精体积分数14%,SO2质量浓度250 mg/kg,发酵15 d酒精度可达10.56%。M5在发酵产酒精的时间方面优于L36,M5作为酿酒菌种,能在短时间内达到一定产酒量,其产酒力较好,能够达到一般果酒酒精度(9%vol~12%vol)的要求,所以M5符合工业化生产菌株的要求。
3 结论
通过发酵过程观察、感官评价及理化指标测定结果分析,确定M5菌株为最佳猕猴桃酿酒酵母。M5菌株用于发酵猕猴桃酒,发酵速度快、酒液澄清、降糖能力较强,所得猕猴桃酒酒液清澈,口感酸甜适中,具有猕猴桃典型的清雅、和谐的果香及酒香,有纯净柔和、酸甜适中、果香味浓的特点,无异杂味。
试验所筛选出的M5菌株发酵所得的果酒酸度为0.8 g/100 mL,酒精度9.8%Vol;并且感官品质极佳。而徐清萍等[5]筛选出的YM-7菌株发酵果酒的酒精度为10.7%Vol,酸度2.33 g/100 mL,酒液呈浅黄色,果香酒香浓郁,但果酒酸度高,口感酸涩。相比较而言,M5菌株酸度适中,但产酒精量略低于YM-7菌株。此外,M5菌株的发酵耐受性较好。后续要增强M5菌体发酵猕猴桃酒香气方面的研究。综上,M5菌株经过后期驯化有望发展为优良猕猴桃酿酒酵母。
