青海牧区产凝乳酶细菌多样性分析
2018-09-13罗俏俏文鹏程张忠明朱建宁贺晓玲张卫兵
朱 艳,罗俏俏,马 江,杨 敏,文鹏程,张忠明,朱建宁,贺晓玲,张卫兵,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070; 2.甘肃农业大学理学院,甘肃兰州 730070; 3.甘肃省食品药品监督管理局,甘肃兰州 730000)
凝乳酶是奶酪生产中的关键酶,奶酪加工工程中凝乳酶具有切断κ-酪蛋白特定肽键的功能,能使牛乳中的酪蛋白凝结[1];奶酪成熟过程中,凝乳酶可将酪蛋白分解为大分子多肽,并进一步降解成氨基酸、胺、含硫化合物等风味物质[2]。根据来源不同,凝乳酶可分为动物凝乳酶、植物凝乳酶和微生物凝乳酶。不同来源的凝乳酶性质不同,动物凝乳酶在干酪生产中应用最早,但由于原料缺乏,导致其价格昂贵[3]。植物凝乳酶由于蛋白水解力强,制成的干酪有一定苦味,限制了其应用[2]。微生物凝乳酶主要来源于细菌、真菌和少数放线菌,由于微生物资源丰富、种类多,因而可以用其生产出多种性能不同的凝乳酶。目前缺乏微生物凝乳酶的生产技术和菌种,因此产凝乳酶微生物的研究成为凝乳酶研究的热点[3-5]。
细菌是产凝乳酶微生物的重要种类,目前国内外已发现了多种产凝乳酶的细菌,但大多酶活不高[6-8]。青藏高原地区海拔高、空气稀薄、昼夜温差大、辐射强度大,特殊的地理、气候条件造就了丰富、独特的微生物种质资源[9]。近年来人们对于该地区微生物资源进行了大量研究,获得了产纤维素酶、木聚糖和纤溶酶的微生物[10-13],但关于该地区产凝乳酶微生物的系统性报道较少。
本研究拟从青海牧区广泛采集样品,研究产凝乳酶细菌资源和细菌凝乳酶的多样性,以揭示该地区产凝乳酶细菌的特异性,为青藏高原地区微生物多样性及种质资源的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
土壤样品 36个,于2016年7月至9月,从青海海南、海西、海北等地牧区牧场、牦牛饮水区和挤奶区在离地面5~10 cm左右采集土样,放入灭菌的纸袋中于4 ℃保存备用;牛肉膏、蛋白胨、酵母膏、葡萄糖、氯化钠、氯化钙、琼脂粉、福林 兰州嘉特星化学试剂公司;麸皮 兰州市安宁区桃海市场;脱脂奶粉 黑龙江完达山乳业股份公司;细菌总基因组DNA提取试剂盒 美国Omega公司;DL2000 DNA Marker 大连Takara公司;试验所用引物 上海派森诺生物科技股份有限公司;酪蛋白固体培养基:蛋白胨2.5 g/L,葡萄糖10 g/L,酵母膏1 g/L,干酪素10 g/L,脱脂牛乳50 g/L,琼脂20 g/L,pH7.0;酪蛋白液体培养基不加琼脂;斜面培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂20 g/L,pH7.0;麸皮汁培养基:将10 g麸皮加入100 mL自来水,煮沸10 min,四层纱布过滤后用补足100 mL,pH自然;脱脂乳培养基∶脱脂乳与水以1∶8的比例配制,115 ℃灭菌10~15 min。
SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;YX-280A型手提式不锈钢压力蒸汽灭菌锅 上海三申医疗器械有限公司;DHG-9033BS-Ⅲ型电热恒温培养箱 上海一恒科学仪器有限公司;H1650R型冷冻高速离心机 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 菌种初筛 称取1 g的土壤样品于99 mL无菌生理盐水,分别稀释成10-3、10-4、10-5、10-6、10-7五个稀释度,取1 mL涂布于酪蛋白固体培养基上,37 ℃培养48 h,选择沉淀圈与菌落直径比值大的菌落进一步划线分离,分离纯化后接入新鲜斜面培养基保藏,以备菌种复筛。
1.2.2 菌种复筛 将菌种分别接种于麸皮汁培养基、牛肉膏蛋白胨培养基和酪蛋白培养基,37 ℃、160 r/min转速摇床培养48 h,取培养液于4000 r/min,4 ℃下离心10 min,取上清液测凝乳酶活力和蛋白水解活力。
1.2.3 酶活测定 凝乳酶活力的测定采用Arima法[14];蛋白酶活力测定方法采用福林法[15]。
1.2.4 基因组DNA提取 将复筛后分离菌株分别接种于LB培养基培养,用细菌基因组DNA提取试剂盒提取细菌基因组总DNA,具体操作流程按操作说明进行。
1.2.5 16S rDNA 扩增 采用细菌通用引物27f:AGAGTTTGATCCTGGCTCAG和1492r:TACGGC TACCTTGTTACGACTT,使用16S rDNA Bacterial Identification PCR仪,进行PCR扩增目的片段。反应体系共50 μL,94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,30个循环,72 ℃保温5 min。取反应产物5 μL上样,1%琼脂糖凝胶电泳,于凝胶成像系统下观察并拍照。
1.2.6 16S rDNA序列系统发育分析 切胶回收目的片断由上海派森诺生物科技股份有限公司完成DNA测序,将测定的16S rDNA序列在NCBI使用Blast与GenBank中核酸序列数据库进行比对,选择与其相似度高的菌株的序列,使用ClustalX 1.8对齐后利用软件MEGA4.0构建系统发育树。
1.2.7 产凝乳酶细菌的种群多样性分析 参考兰晓君等[16]的方法。定义16S rRNA基因序列同源性大于97% 作为同一分类单元,分别计算Shannon指数(D)、Simpson指数(H)、Shannon-Wiener均匀度指数(E)和Margalef丰富度指数(Ma)。
式(1)
Simpson指数=1-∑Pi2
式(2)
Shannon-Wiener均匀度指数=H/log2S
式(3)
Margalef丰富度指数Ma=(S-1)/lnN
式(4)
式中,ni表示第i种的菌株数;N表示所有菌株数;S为菌种数;Pi=ni/N,表示第i种的相对多度。
1.3 数据处理
试验中各组数据均为3次实验的平均值,以平均值±标准差表示;数据采用SPSS 18.0进行统计分析。
2 结果与分析
2.1 菌种初筛
36个样品中共分离得到21株有明显沉淀圈的细菌菌株,划线分离纯化后编号分别为HN1、HN2、HN3、HN4、GL1、GL2、GL3、GL4、HB1、HB2、HB3、HB4、HX1、HX2、HX3、HX4、HM1、HM2、HM3、HM4、HM5。21个菌株菌落直径、水解圈直径及沉淀圈直径结果如表1所示。
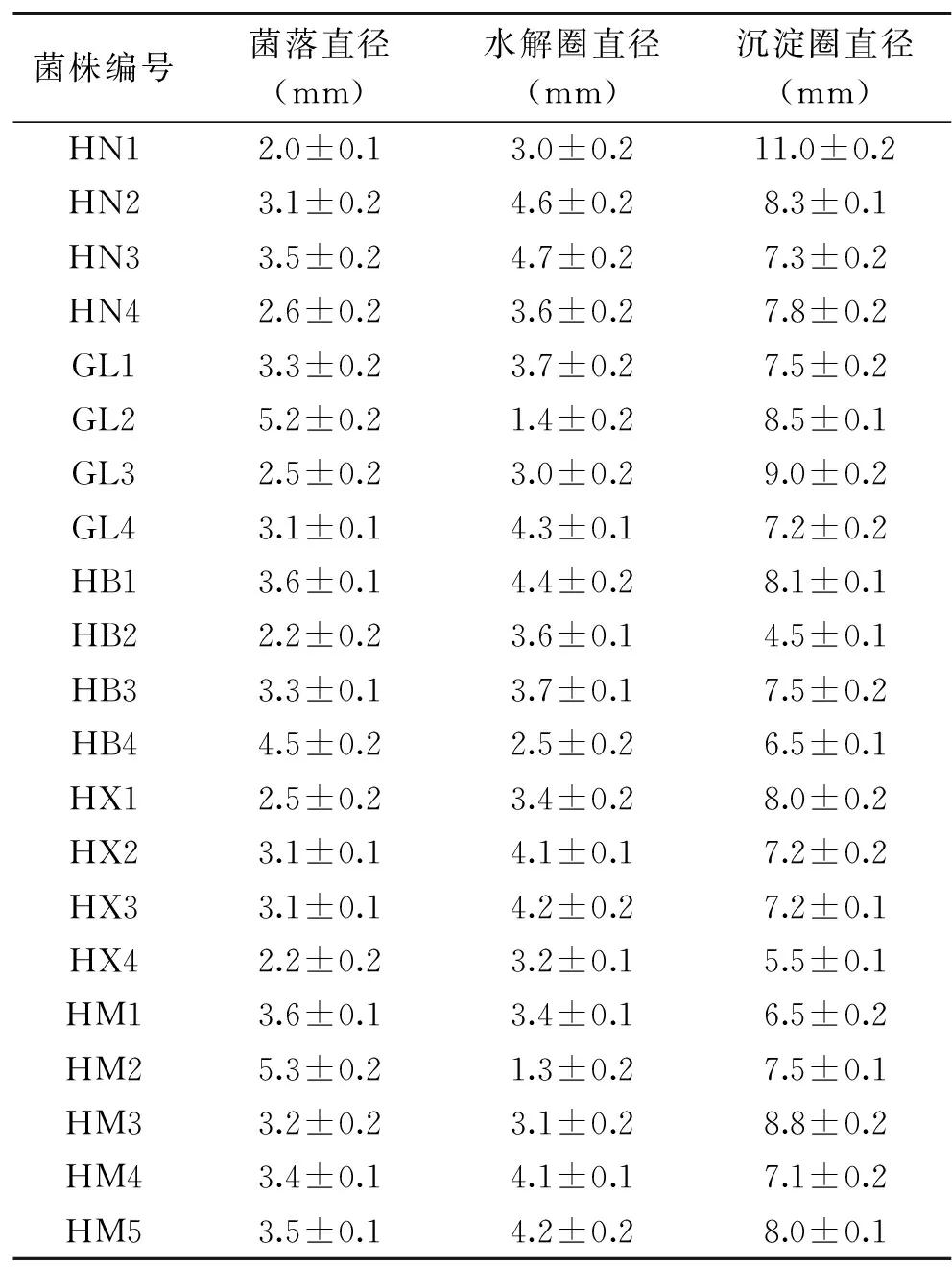
表1 不同菌株在酪蛋白平板上水解圈和沉淀圈直径(mm)Table 1 Diameter of hydrolyze and deposition circles on the solid casein medium of different strains
沉淀圈和水解圈直径是产凝乳酶细菌初筛时常用的检测指标,水解圈直径的大小与菌株蛋白水解活力有一定的关系,水解圈直径越大,蛋白水解活力越大;沉淀圈直径的大小与菌株凝乳酶活力有一定的关系,沉淀圈直径越大,凝乳酶活力越大;但由于固体平板和液体培养的条件不同,菌株在液体发酵的产酶情况不一致[15]。由表1可以看出,不同菌株的菌落直径、水解圈直径及沉淀圈直径有一定差异,说明这些菌株的凝乳酶活和蛋白水解力有一定的差异;菌株HN1菌落直径最小,为2.0 mm,而沉淀圈直径达到11.0 mm,沉淀圈与菌落直径比值达到5.5,说明其凝乳酶活力可能较高;该菌株的水解圈直径为3.0 mm,沉淀圈与水解圈直径比值达到3.6,说明其凝乳酶活力与蛋白水解力的比值可能较高。菌株HM2菌落直径最大,达到5.3 mm,而沉淀圈直径为7.5 mm,沉淀圈与菌落直径比值仅为1.41,说明其凝乳酶活力可能较低;该菌株的水解圈直径为1.3 mm,沉淀圈与水解圈直径比值达到5.7,说明其凝乳酶活力与蛋白水解力的比值可能较高。其余菌株的菌落都介于这两株菌之间,其沉淀圈与菌落直径比值也介于1.41~5.5之间。
2.2 菌种复筛
21株菌株在不同培养基中的两种酶活性见表2。
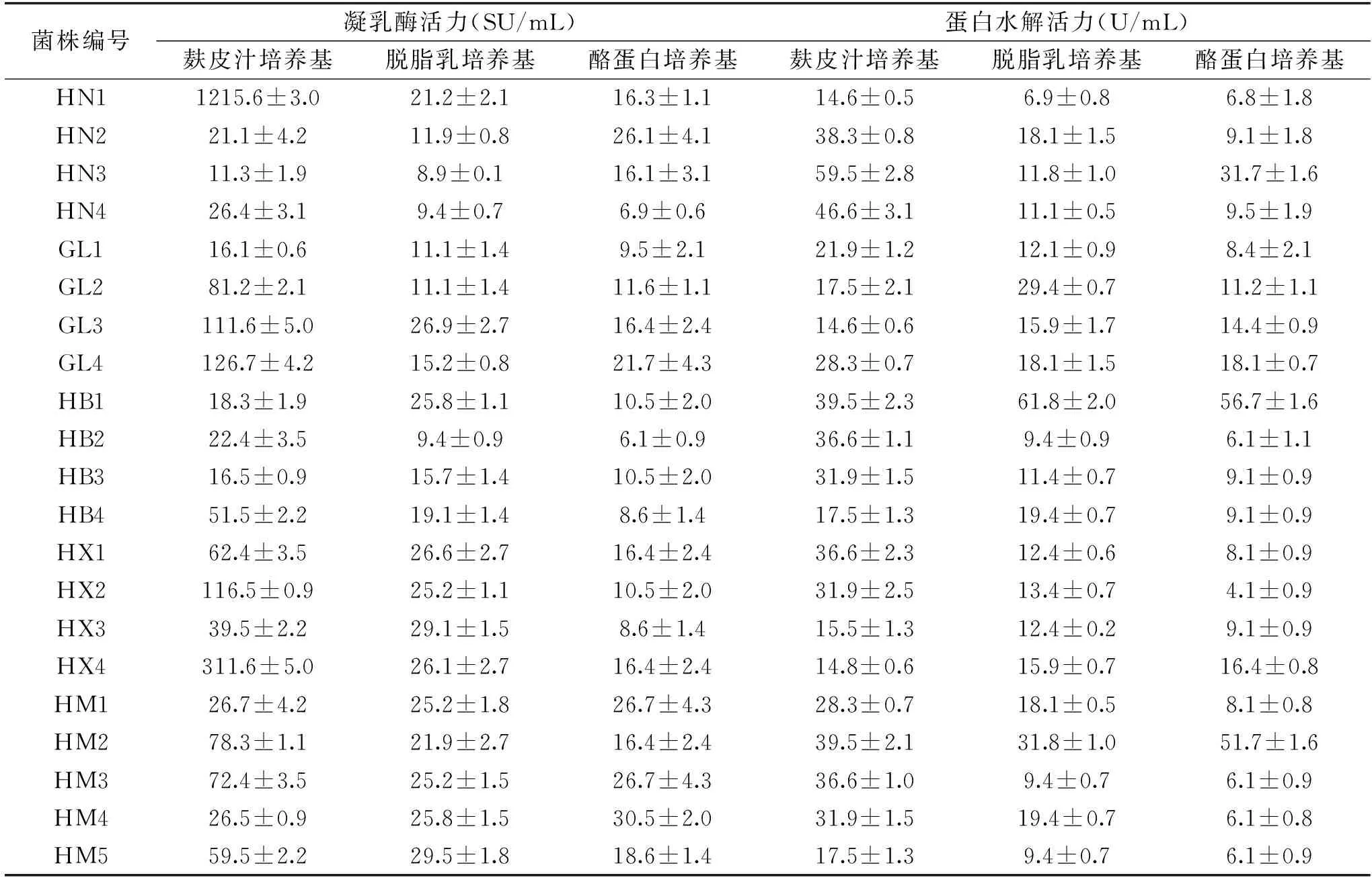
表2 不同菌株在不同培养基中的产酶活力Table 2 Enzyme activities of different strains in different fermentation medium
表2可以看出不同菌株在不同培养基中凝乳酶活力和蛋白水解力极大差异,显示营养成分对产酶特性有一定影响。在21株菌在脱脂乳培养基中的凝乳酶活力介于8.9~29.5 SU/mL,蛋白水解力介于6.9~61.8 U/mL之间;在酪蛋白培养基中的凝乳酶活力在6.1~30.5 SU/mL之间,蛋白水解力在4.1~56.7 U/mL之间;在麸皮汁培养基中的凝乳酶活力在11.3~1215.6 SU/mL之间,蛋白水解力介于14.6~59.5 U/mL之间;菌株HN 1在麸皮汁培养基中发酵时,凝乳活力最高,可以达到1215.6 SU/mL,对应的蛋白水解活力为14.6U/mL,凝乳活力与蛋白水解力比值达到83.26,说明其发酵液中凝乳酶活力高,有利于干酪的制作[15]。
2.3 16S rDNA 序列相似性分析
不同菌株PCR扩增产物电泳图见图1。
图1 不同菌株的16S rDNA序列的琼脂糖电泳图Fig.1 Agarose gel electrophoresis pattern of RCR amplification product of 16s rDNA of different stains注:1~21:菌株编号,依次与表2中的菌株对应。
图1为不同菌株16S rRNA PCR扩增产物电泳图,结果与表3吻合。由表3可以看出,14株杆菌中,菌株HN3与BacilluscereusLAM 30的16S rDNA序列相似性在98%以上,其余菌株与其最相近的典型菌株的相似性均在99%以上,根据分子生物学鉴定的依据,这14株杆菌都属于芽孢杆菌属。其中菌株HN2鉴定为蜡样芽孢杆菌(Bacilluscereus),菌株HX1和GL1鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),菌株HN4鉴定为苏云金芽孢杆菌(Bacillusthuringiensis),菌株GL3和GL4鉴定为坚强芽孢杆菌(Bacillusfirmus),菌株HB1和HB2鉴定为巨大芽孢杆菌(Bacillusmegaterium);菌株HN1和HB3鉴定为地衣芽孢杆菌(Bacilluslicheniformis),菌株HM2鉴定为韦氏芽孢杆菌(Bacillusweihenstephanensis),菌株HM1鉴定为蕈状芽胞杆菌(Bacillusmycoides),菌株HX4鉴定为简单芽胞杆菌(Bacillussimplex);7株球菌中菌株HM3、HX3和HX2鉴定为粪肠球菌(Enterococcusfaecalis),菌株HB4和GL2鉴定为黄色黏球菌(Myxococcusxanthus),菌株HM4鉴定为乳酸乳球菌(Lactococcuslactis),菌株HM5鉴定为藤黄微球菌(Micrococcusluteusstrain)。
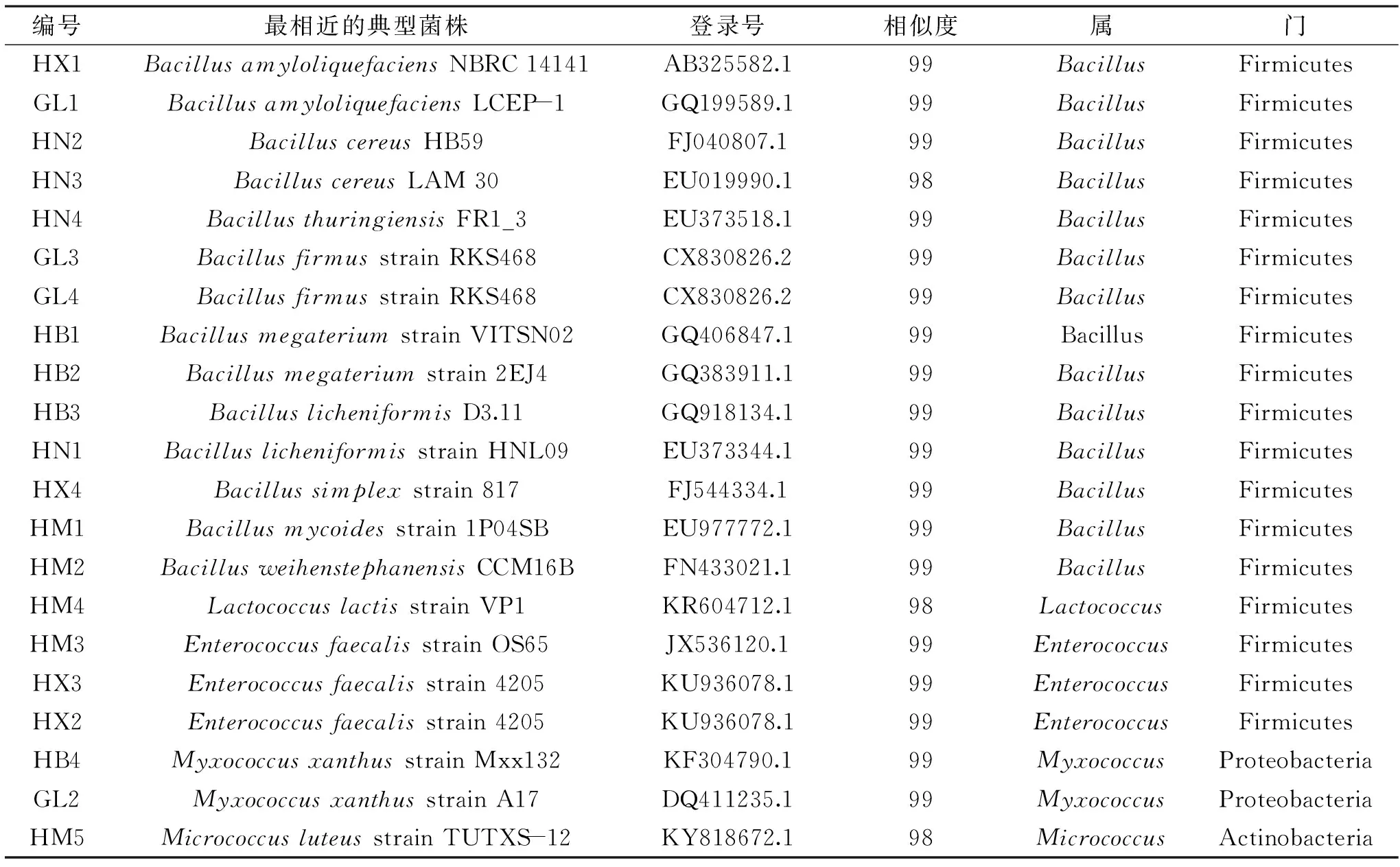
表3 不同菌株的16S rDNA序列相似性分析Table 3 Similarity analysis of partial 16S rDNA sequences of different strains
同时,由表3还可以看出,21株菌分别属于3个门,其中厚壁菌门(Firmicutes)有18株,占到85.7%,变形菌门(Proteobacteria)有2株,占到9.5%,放线菌门(Actinobacteria)1株,占到4.7%。从属水平上看,21株菌中有14株菌属于芽孢杆菌属(Bacillus),占到总菌株的66.67%,说明芽孢杆菌是产凝乳酶细菌中的优势属;肠球菌属(Enterococcus)有3株菌,占到14.2%,为第二优势属;黏球菌属(Myxococcus)有2株菌,占到9.5%;乳球菌属(Lactococcus)和微球菌属(Micrococcus)均只有1株菌,仅占4.5%。
由图2可以看出,相同属的菌株聚集在一个分支上,不同属的菌株遗传距离较远;14株杆菌的亲缘关系较近,7株球菌的亲缘关系较近,球菌和杆菌的亲缘关系较远,与表3的分析结果一致。
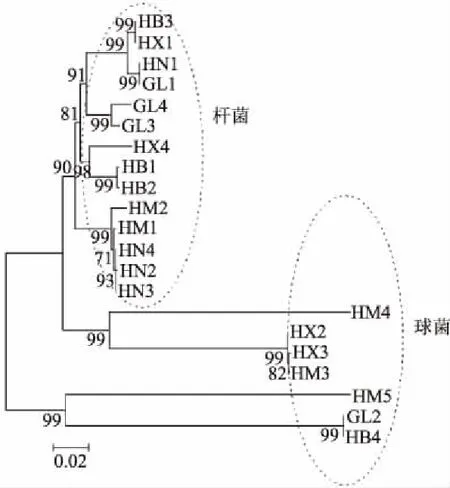
图2 产凝乳酶细菌菌株的系统发育树Fig.2 Phylogenetic tree based on 16S rDNA sequence of homology
2.4 产凝乳酶细菌的多样性分析
辛普森多样性指数(D)、Shannon-Wiener指数(H)、Shannon-Wiener均匀度指数(E)和Margalef丰富度指数(Ma)用于表示群落中物种的多样性和丰富度。本试验中产凝乳酶细菌的多样性和丰富度指数的结果见表4,4个指数分别为0.916、3.053、0.802、4.269,辛普森多样性指数(D)、Shannon-Wiener指数(H)和Shannon-Wiener均匀度指数(E)均大于兰晓君等对金川镍矿可培养细菌的多样性的对应指数[16],说明该地区的产凝乳酶细菌种类的多样性和丰富度较高。与文献中报道的土壤细菌多样性相比[17],本试验中的多样性较低,这是因为产凝乳酶的细菌只是样品中所有细菌的一部分。

表4 产凝乳酶细菌多样性指数Table 4 Diversity of bacteria producing milk-clotting enzymes
3 结论与讨论
国外细菌凝乳酶研究19世纪初就开始,最早报道的产凝乳酶细菌为多粘芽孢杆菌[3]。此后先后报道地衣芽孢杆菌[4]、枯草芽孢杆菌[5-7]、球形芽孢杆菌[8,18]、纳豆芽孢杆菌[19]、黄色粘球菌[20]、粪肠球菌[21]等产凝乳酶。国内凝乳酶研究起步较晚,从20世纪80年代末才开始凝乳酶的研究工作,郭光远[22]等首先从160株细菌中筛选到14个产凝乳酶菌株;此后,周俊清等研究者分别报道了产凝乳酶的蜡状芽孢杆菌[23]、枯草芽孢杆菌[24-25]和地衣芽孢杆菌[15]。本试验从青海牧区采集的土壤样品中分离筛选到21株产凝乳酶细菌,其中有14株菌属于芽孢杆菌属(Bacillus),说明芽孢杆菌是产凝乳酶细菌中的优势属,这一结果与国内外已有的报道基本一致。
从已有的文献来看,由于筛选时采用选择性培养基和产酶培养基不同,因而筛选得到菌株种类和性能有所差异;来自乳制品及其加工环境中的样品中分离到的菌株较多,不同来源的样品中可能会有不同种类的菌株[4-8]。青藏高原地区放牧历史悠久,当地牧民长期利用牦牛奶、马奶和羊奶加工酸奶、曲拉、酥油等乳制品,因而该地区富集了大量的乳品微生物资源。本试验的结果证明了该地区的乳品加工环境中存在丰富的产凝乳酶微生物。另外,本试验中发现的产凝乳酶的Bacillusthuringiensis、Bacillusfirmus、Bacillusweihenstephanensis、Bacillusmycoides、Lactococcuslactis、Micrococcusluteus等以前均未报道,说明了青海牧区土壤中的产凝乳酶细菌有一定的特异性。在后续试验中,如果加大样品的采集量,可能会分离筛选出更多种类,并且性能优良的产凝乳酶细菌。
本文得到的21株菌在脱脂乳培养基中的凝乳酶活力介于8.9~29.5 SU/mL,在酪蛋白培养基中的凝乳酶活力介于6.1~30.5 SU/mL,在麸皮汁培养基中的凝乳酶活力介于11.3~1215.6 SU/mL,说明菌种的种类和营养成分对其产酶特性都有一定的影响,这与本试验室以前的结果一致[15,27-28]。这一结果也表明菌株筛选时尽可能选用多种培养基,以免漏掉一些产酶能力较高的菌株。本试验中得到的菌株HN1在麸皮汁培养基中发酵时,凝乳活力最高,可以达到1215.6 SU/mL,比以往报道的细菌菌株的凝乳酶活力都高,说该菌株有应用于工业化生产的潜力。
