周氏啮小蜂(海南种群)对椰子织蛾的寄生功能反应
2018-09-12吕宝乾彭正强金启安温海波刘衍超
吕宝乾,苏 璐,彭正强*,金启安,温海波,何 杏,刘衍超
1农业部热带作物有害生物综合治理重点实验室/中国热带农业科学院环境与植物保护研究所,海南 海口 571101;2海南大学,海南 海口 570228
椰子织蛾OpisinaarenosellaWalker,又称椰子木蛾,是棕榈植物上的重要害虫(李后魂等,2014; 吕宝乾等,2013)。椰子织蛾2013年入侵海南,被列为高风险性有害生物(阎伟等,2013)。本地天敌筛选利用是控制外来入侵害虫的重要措施(Huffaker,2012)。周氏啮小蜂(海南种群)ChouioiacuneaYang是海南本地收集到的控制椰子织蛾的蛹寄生蜂(李紫成等,2017; 吕宝乾等,2018)。周氏啮小蜂从美国白蛾HyphantriacuneaDrury蛹上采集,在美国白蛾上寄生率高,在我国北方已广泛应用(杨忠岐,1989)。海南发现的椰子织蛾周氏啮小蜂形态上不同于报道的周氏啮小蜂,生物学上也存在差异,总体上海南种群周氏啮小蜂较北京种群周氏啮小蜂个体小,出蜂量多,成蜂寿命短(李紫成等,2017; 吕宝乾等,2018)。功能反应是衡量天敌对害虫捕食或寄生能力的重要指标之一(丁岩钦,1994)。为了评价周氏啮小蜂(海南种群)对椰子织蛾的控害潜能,本文研究了周氏啮小蜂(海南种群)对椰子织蛾的寄生功能反应,通过开展周氏啮小蜂(海南种群)对椰子织蛾功能反应的研究,获得周氏啮小蜂(海南种群)的寄生潜能,为评价周氏啮小蜂(海南种群)对椰子织蛾的控制作用提供重要依据。
1 材料与方法
1.1 供试虫源
椰子织蛾采自中国热带农业科学院儋州院区(北纬N 19° 30′ 29″,东经E 109° 29′ 21″)。实验条件为温度(23±2) ℃、相对湿度RH=75%±10%。椰子织蛾幼虫饲养于20 cm×30 cm×8 cm的养虫盒中,饲养方法见吕宝乾等(2015)。实验所用寄生蜂来自中国热带农业科学院环境与植物保护研究所同批次培养的周氏啮小蜂(海南种群)。
1.2 实验方法
1.2.1 寄生行为观察 在装有椰子织蛾初期蛹的玻璃指形管(50 mL)内引入一对刚羽化的周氏啮小蜂(海南种群),在体视显微镜下观察并描述周氏啮小蜂(海南种群)的寄生产卵过程。另设1头蜂对多头寄主情形观察寄生蜂产卵行为。
1.2.2 功能反应 根据前期研究,椰子织蛾蛹在此条件下蛹的发育历期为10 d(Luetal.,2016)。实验一在不补充营养条件下进行。分别取椰子织蛾初期蛹(2 d)、中期蛹(5 d)、晚期蛹(8 d),每个蛹期分别设置1、2、3、4、5头寄主密度梯度,分别置于50 mL指形管中,每个指形管再引入1对新羽化的周氏啮小蜂(海南种群),24 h后移去寄生蜂。解剖观察寄生情况并记录每个密度条件下实际被寄生的椰子织蛾蛹数量。实验重复5次。实验二在补充营养的条件下进行,指形管中加入蘸有10%蜂蜜水的棉棒,其他过程同实验一。
1.3 数据处理

2 结果与分析
2.1 周氏啮小蜂(海南种群)寄生椰子织蛾行为
周氏啮小蜂(海南种群)羽化后即可寄生。在指形管中,绝大多数周氏啮小蜂(海南种群)雌蜂在(10.2±3.4) min (n=30)内便可找到寄主。产卵时,雌蜂会用触角触碰检查寄主状况,然后将产卵器插入寄主蛹体内,寄主受到刺激身体会扭动翻转,少部分(10.5%)寄生蜂会脱落,需再次进行产卵行为。产卵部位不固定,整个产卵过程持续(1.3±0.8) min (n=30,图1)。寄生蜂休息(20.6±15.8) min (n=30)后可再次产卵。

图1 周氏啮小蜂(海南种群)寄生椰子织蛾蛹Fig.1 O.arenosella pupae being parasitized by C.cunea
2.2 周氏啮小蜂(海南种群)对椰子织蛾的寄生功能反应(无营养补充)


图2 周氏啮小蜂(海南种群)寄生不同蛹期椰子织蛾的Holling Ⅱ模型(无营养补充)Fig.2 Holling Ⅱ model for different stages of O.arenosella parasitized by C.cunea (no nutrition)
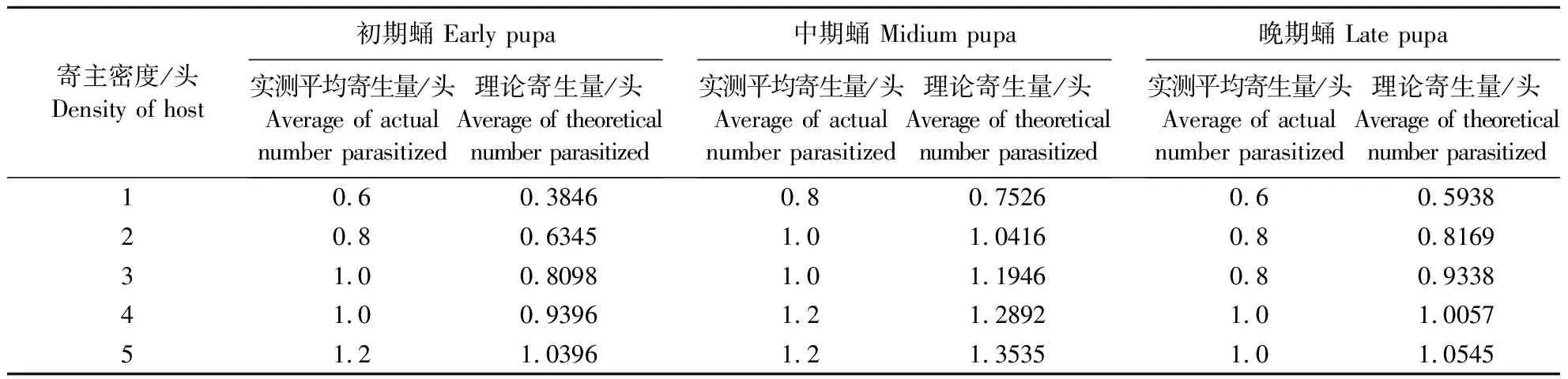
表1 周氏啮小蜂(海南种群)对不同密度椰子织蛾蛹的寄生情况(无营养补充)Table 1 C.cunea response to parasites of different densities of O.arenosella (no nutrition)
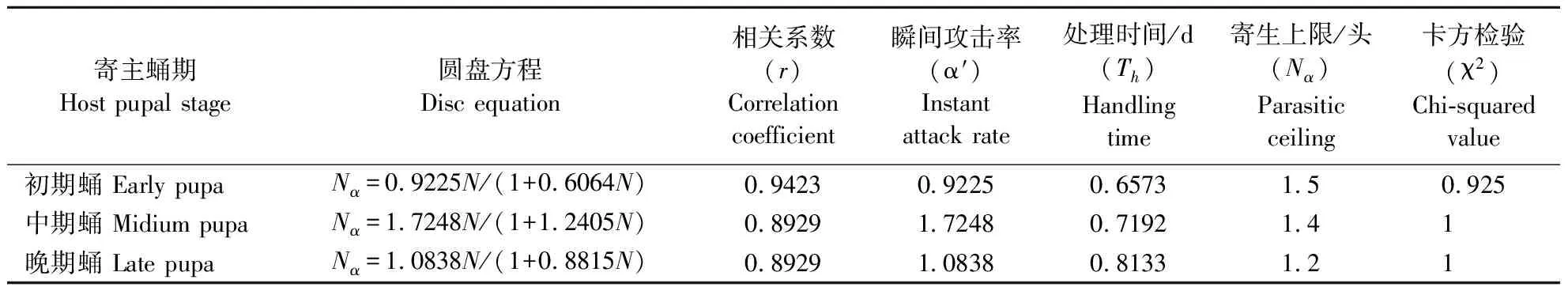
表2 周氏啮小蜂(海南种群)对椰子织蛾的功能反应(无营养补充)Table 2 Parasitism functional response of C.cunea on O.arenosella (no nutrition)
2.3 周氏啮小蜂(海南种群)对椰子织蛾的寄生功能反应(补充营养)

3 讨论
周氏啮小蜂(海南种群)每头寄主可出蜂80多头,且偏雌性,雌蜂比率约90%,是海南本地优势寄生蜂(吕宝乾等,2018)。研究表明,周氏啮小蜂(海南种群)对椰子织蛾蛹的功能反应类型与大多数寄生蜂的功能反应类型相同,为Holling Ⅱ(李倩等,2017; 吕宝乾等,2006;尚禹,2014),即寄生量随寄主密度的增大而增大,之后寄生量维持在某一阈值范围。本研究中周氏啮小蜂(海南种群)对椰子织蛾晚期蛹的寄生量与初期蛹、中期蛹有差异,表明寄主快羽化的晚期蛹不利于寄生蜂寄生发育,这在螟蛉埃姬蜂Itoplectisnaranyae(Ashmead)上有相似表现(Ueno,1997),所以,椰子织蛾初蛹期和中蛹期可作为繁蜂的首选阶段。
研究表明,天敌昆虫取食蜜粉源植物的花粉或花蜜等补充营养后,寿命和寄主搜寻能力多会显著延长(Arajetal.,2011; Balzan & Wäckers,2013;Wong & Frank,2013)。在野外,寄生蜂通常会取食蜜粉源植物补充营养,可不同程度地促进天敌昆虫性成熟、延长寿命、提高生殖力或寄生率以及搜寻寄主效率和子代雌性比率,从而显著提高天敌昆虫在生物防治中的控害能力和效果(王伟等,2012; 魏可等,2016;Thompson,1999)。

图3 周氏啮小蜂(海南种群)寄生不同蛹期椰子织蛾的Holling Ⅱ模型(营养补充)Fig.3 Holling Ⅱ model for different stages of O.arenosella parasitized by C.cunea (10% honey nutrition)

表3 周氏啮小蜂(海南种群)对不同密度椰子织蛾蛹的寄生情况(营养补充)Table 3 C.cunea response to parasites of different densities of O.arenosella (10% honey nutrition)

表4 周氏啮小蜂(海南种群)对椰子织蛾的功能反应(营养补充)Table 4 Parasitism functional response of C.cunea on O.arenosella (10% honey nutrition)
在利用周氏啮小蜂(海南种群)防治椰子织蛾时,保护目标害虫植物周围的蜜源植物不受化学农药污染或人为破坏有重要意义。本研究是在室内进行的,结果存在一定的局限性,不能准确地反映周氏啮小蜂(海南种群)对椰子织蛾的实际控制能力,需进一步研究其在自然条件下的控害能力。
