自凝刀联合抗HPV生物蛋白辅料治疗LEEP术后HPV持续阳性的疗效分析
2018-09-12侯学涛
侯学涛
(莱芜市妇幼保健院妇科,山东 莱芜 271100)
目前多项研究已经证明,高危型HPV持续感染是宫颈上皮内瘤变(CIN)和宫颈癌发病的必要条件。虽大多数宫颈癌前病变经LEEP治疗后病情进展得到很好的遏制,但由于LEEP的局限性,使少部分患者不能清除HPV 病毒而成为持续感染者,致使 CIN 不能控制反而进展成为宫颈癌,造成患者极大的恐惧和焦虑。本研究旨在探讨自凝刀联合抗HPV生物蛋白辅料治疗LEEP术后HPV持续阳性的临床疗效,现将结果总结如下。
1 资料与方法
1.1 一般资料:回顾性分析2015年9月至2016年3月于我院因宫颈病变行LEEP术后4~6个月随访,HPV持续阳性者188例,年龄28~55岁。根据病情和个人治疗意愿分为4组:暂不治疗,密切观察者35例(A组),年龄30~55岁;自凝刀治疗者50例(B组),年龄30~45岁;抗HPV生物蛋白辅料治疗者43例(C组),年龄32~47岁;自凝刀联合抗HPV生物蛋白辅料治疗者60例(D组),年龄28~53岁。四组在年龄,临床症状等方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2 病例选择标准
1.2.1 纳入标准:①年龄≥18岁;②经宫颈液基细胞学(TCT)检查确诊宫颈柱状上皮异位;③高危型HPV DNA(尤其16型和18型)检测阳性;④行LEEP治疗病理结果提示切缘阴性。⑤经LEEP术后4~6个月随访,复查HPV为同一亚型高危型HPV持续感染。
1.2.2 排除标准:①孕妇及哺乳期妇女;②宫颈早期浸润癌患者;③近期服用激素类药物者;④伴有严重肝肾功能不全者;⑤精神疾病及其他传染病患者。
1.3 方法:A组暂不治疗,密切随访。B组行自凝刀射频消融治疗。C组行抗HPV生物蛋白敷料(太原锦波生物医药科技有限公司,3克/支))治疗,1支/次,隔日1次,10次/疗程,月经期停用,共用3个疗程。D组行自凝刀射频消融治疗后7 d,进行抗HPV生物蛋白辅料治疗,1支/次,隔日1次,10次/疗程,月经期停用,共用3个疗程。
1.4 监测指标。① 宫颈液基细胞学(TCT):记录LEEP治疗前和治疗后4~6个月的TCT指标,采用国际癌症协会推荐的TBS分类标准,包括正常范围(WNL)、不典型鳞状细胞性质未定(ASCUS)或未明确意义的非典型柱状细胞(AGCUS)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)。② 人乳头瘤病毒(HPV)DNA:检测13种致癌型HPV-DNA(16、18、31、33、35、39、45、51、52、56、58、59和68),阳性标准为HPV-DNA>1.0 ng/L。记录治疗后4~6个月的转阴(治愈)情况,即阳性HPV亚型全部转为阴性(载量<1 pg/mL)。
1.5 评价指标:对四组患者的治疗效果,由专业医护人员进行记录和统计,治疗效果包括治愈、有效和无效。若原高危型HPV亚型全部转为阴性(载量<1 pg/mL)为治愈;原高危型HPV感染型别消失,转为其他型别;或者原多种高危型HPV感染有一种或一种型别以上HPV消除为有效;原感染高危型HPV型别无变化或者在原型别基础上又感染其他型别为无效。总有效率为治愈率与有效率之和。
1.6 统计学处理:本研究采用SPSS 22.0统计软件进行统计分析,计量资料以均数±标准差(±s)表示,采用t检验;计数资料采用χ2检验。P<0.05为差异有显著性,有统计学意义。
2 结 果
2.1 四组患者HPV清除率比较:治疗3个月后,随访 A组35例,B组50例,C组43例,D组60例,四个组别的HPV清除率有不同程度的差异(χ2=23.187,P<0.05),D组的HPV清除率明显高于A组(χ2=22.7,P<0.001)、B组(χ2=11.551,P<0.05)和C组(χ2=8.021,P<0.05),差异有统计学意义,见表1。
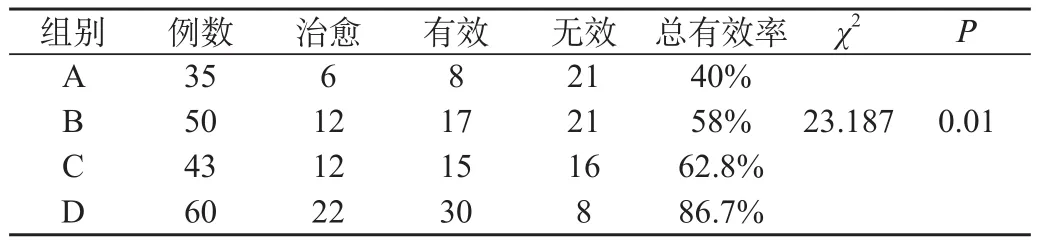
表1 四组患者HPV清除率比较
2.2 四组患者宫颈脱落细胞学转阴率比较:在A、B、C、D四组中,HPV感染合并宫颈细胞ASCUS/LSIL者分别25例、30例、29例和41例。治疗3个月后复查,四个组别的宫颈液基细胞学指标有不同程度的转阴率(χ2=22.237,P<0.001)。D组转阴率明显高于A组(χ2=22.086,P<0.001)、B组(χ2=8.785,P<0.05)和C组(χ2=6.361,P<0.05),见表2。
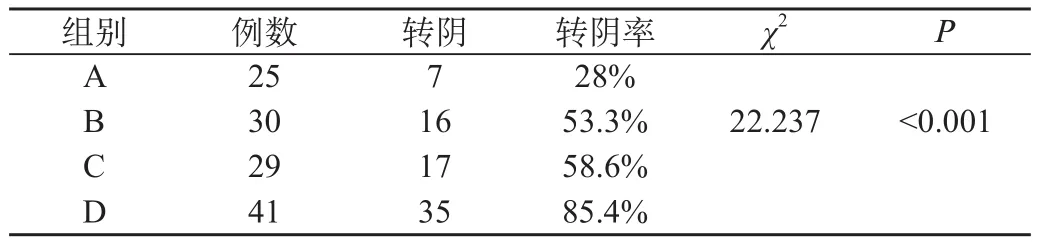
表2 四组患者宫颈脱落细胞学转阴率比较
2.3 不良反应:两组治疗期间均未发现皮疹、皮损,无发热等不适,无明显不良反应,安全性好。
3 讨 论
宫颈癌中HPV 检出率可达99.7%,根据HPV致癌相关性,HPV可分为高危型HPV(HR-HPV)和低危型(LR-HPV),在宫颈上皮内瘤样病变和宫颈浸润癌中能检测到高危HPV[1]。世界卫生组织(WHO)已确认HR-HPV感染是宫颈癌的首要病因及发生的必要条件[2-3]。女性感染了高危型HPV病毒后,70%~80%可自我清除,称“一过性感染”,但其中20%~30%感染者,不能自我清除,成为“持续感染”,可引发宫颈癌。在临床上,若感染了高危型HPV病毒的女性在0.5~1年内,连续两次检测均为阳性,即认定为“持续性感染”。高危型HPV 持续性感染时,正常上皮或者低级别宫颈上皮内瘤变可在较短时间内发展为高级别宫颈上皮内瘤变[4-5],因此,积极预防和治疗HPV 感染,特别是高危型HPV感染,对预防和降低宫颈癌的发生具有重要的临床价值[6]。
LEEP是美国阴道镜和宫颈病理学会(ASCCP)推荐的用于治疗CIN的术式,可利用系列不同型号的高频电波刀治疗不同类型的宫颈病变,疗效得到国内外专家的认可。Fan等[7]对135例CIN患者经LEEP治疗的疗效进行统计分析,治愈率93.3%,复发率2.2%,残留率4.4%。但仍有部分患者治疗后持续HR-HPV阳性,导致CIN复发,其原因可能在于:癌前病变的不恰当治疗,HR-HPV的持续感染,新的HR-HPV再感染,或与原发病不相关的其他类型HPV感染。
自凝刀的作用原理为通过射频电流,促进病变部位温度升高,加速细胞内外水分的蒸发,促进细胞的干燥和固缩脱落,从而达到有效消除病变组织的目的。抗HPV生物蛋白辅料的主要成分是JB蛋白和卡波姆,JB蛋白的作用机制是利用正负电荷非特异性相互作用的原理,直接杀灭HPV病毒,打破HPV的持续性感染,从而阻断HPV感染,预防宫颈癌[8]。卡波姆用于修复局部微损伤,促进创面愈合,同时有极强的黏膜黏附性,缓释JB蛋白,长时间保持灭活HPV的效果,并把破坏的 HPV 碎片包裹排除,因此,抗 HPV 生物蛋白敷料不仅清除 HPV病毒,同时修复损伤,从而全面、快速清除 HPV 感染,预防宫颈癌的发生[9-10]。
本研究通过对LEEP术后HPV持续阳性者分别进行随访观察、自凝刀治疗、抗HPV生物蛋白辅料治疗及自凝刀联合抗HPV生物蛋白辅料治疗,研究结果表明自凝刀联合抗HPV生物蛋白辅料治疗后,患者的宫颈脱落细胞学转阴率和HPV转阴率明显高于单独应用自凝刀或抗HPV生物蛋白辅料治疗组及随访观察组,差异有统计学意义。因此,对LEEP术后高危型HPV持续感的患者,给予自凝刀联合抗HPV生物蛋白辅料治疗可以很好的降低HPV持续性感染状态,从而预防宫颈癌的发生。在临床工作中,对行LEEP术后的患者,应积极随访,定期复查HPV和TCT,尽可能早发现、早诊断,并根据患者自身情况采取合理有效的治疗方案,以提高HPV感染转阴率,降低CIN复发率,继而降低宫颈癌的发生率。
