钠与氯气燃烧的改进实验探究
2018-09-12苟兴龙文丰玉
刘 枫 苟兴龙 文丰玉
西华师范大学化学教育研究所(637000)
教材中钠与氯气燃烧的实验存在氯气不方便携带和尾气未处理等方面的不足。在教学实践中,不少教师也对该实验进行了改进,大多采用氯气的制备与钠反应的一体化设计,为了实验简便一般将直接制取的氯气与钠反应,并没有对氯气进行处理,从而对实验结果产生影响。对此,问题笔者设计了以下实验进行探究。
1 实验原理

2 实验现象预测
通过对实验的原理分析,可知高锰酸钾制备氯气会产生水,浓盐酸具有挥发性。为了验证水和氯化氢对改进实验的影响,做了以下实验设计。
3 实验过程
3.1 实验装置及步骤
实验装置如图1所示,实验步骤如下。
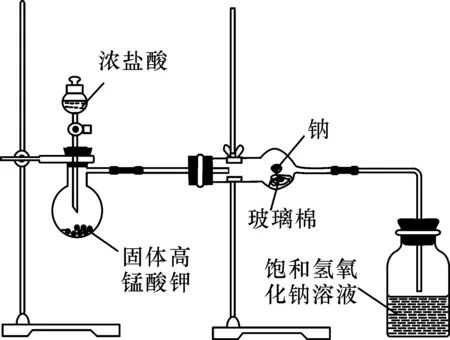
图1 实验装置
(1)按照图1所示组装图连接实验装置,并检查装置气密性。
(2)在蒸馏烧瓶中加入1 g高锰酸钾固体,并在分液漏斗中装入约1 mL浓盐酸。
(3)取一块黄豆大小的钠,用滤纸吸去表面的煤油,并用小刀刮去表面的氧化层,迅速放入干燥管中的玻璃棉上,并立刻旋紧球形干燥管口的橡胶塞。
(4)用分液漏斗缓慢滴加浓盐酸,让浓盐酸与高锰酸钾充分反应,此时蒸馏烧瓶中产生绿色气体,排除球形干燥管中的空气,待有气泡产生时,点燃酒精灯,将球形干燥管预热,后局部加热。
(5)当钠加热燃烧时,迅速撤除酒精灯。此时观察到钠剧烈燃烧,火焰成黄色,并产生大量白烟,反应结束后,球形干燥管壁上有白色固体产生。
(6)实验结束后,在分液漏斗中加入少量氢氧化钠溶液进行尾气处理。
3.2 实验中出现的问题
通过多次反复实验发现以下问题。
(1)钠易发生自燃,在酒精灯还未加热时就与氯气发生了反应。
(2)将白色晶体溶解后进行pH检验,pH值大于7,呈碱性。
(3)产生的氯化钠不一定全是钠与氯气反应产生的。
(4)钠没有发生反应。
3.3 原因分析
(1)钠自燃是由于浓盐酸与高锰酸钾反应生成水,水与钠反应后再与氯气反应。

(2)从钠与水反应中可以猜测白色晶体不仅有NaCl,还可能产生NaOH,所以pH大于7,呈碱性。
(3)浓盐酸具有挥发性,易进入玻璃管与Na反应,产生氯化钠。

(4)浓盐酸、水和钠反应都会产生氢气,氢气与氯气会在一定条件下发生爆炸,存在安全隐患。

(5)氯气与氢氧化钠反应也会产生氯化钠。

(6)钠发生氧化,在表面形成了氧化膜。
通过以上实验可以发现以下问题:①产物无法确定,有杂质;②Na易自燃且易氧化;③产生的氢气,会对实验产生安全隐患。对此,可采用控制变量法分别检验水和氯化氢对实验的影响。
4 实验检验
实验检验过程见表1。

表1 实验检
5 实验结论
通过以上实验探究,得出水对钠与氯气的燃烧实验具有一定的影响。首先,水与钠反应会产生自燃,导致产生杂质氢气和氢氧化钠。氢气与氯气反应产生安全隐患,氢氧化钠则会影响产物的纯度,无法确定产物是氢氧化钠还是氯化氢。其次,氯气还会与氢氧化钠反应产生氯化钠,影响产物。至于氯化氢气体,只要在反应过程中缓慢滴加氯化氢溶液,并使其与高锰酸钾充分反应,则氯化氢气体对燃烧反应的影响很小。
除去水和氯化氢后,干燥纯净的氯气与钠燃烧反应很迅速,降低了钠加热后不燃烧的概率。所以,在做钠与氯气反应的一体化设计时,最重要的是要对水进行处理。通过对钠与氯气的燃烧实验探究改进,有利于提高学生在控制单一变量的实验探究中养成求实的科学态度和严谨的科学思维。
