联苯-联苯醚混合萃取剂分散液液微萃取测定饮用水中挥发性卤代烃
2018-09-11杜小弟蔡宏伟郭丽萍雷家珩
杜小弟 蔡宏伟 郭丽萍 雷家珩
(武汉理工大学化学化工与生命科学学院化学系,武汉 430070)
1 引 言
挥发性卤代烃是重要的环境污染物。特别是采用氯气消毒工艺的饮用水中,三卤甲烷等众多挥发性卤代烃作为消毒副产物而广泛存在[1,2]。国内外对饮用水中多种卤代烃都有严格的限量[3,4],我国生活饮用水卫生标准规定的三氯甲烷和四氯化碳含量限值分别为60和2 μg/L,比世界卫生组织(WHO)的推荐值更加严格。大部分卤代烃都具有较强的电负性,因此主要采用气相色谱-电子捕获检测器(GC-ECD)进行测定[5],常用的方法包括直接进样法[6]、顶空法[7]、液液萃取法[8]、吹扫捕集法[9,10]、顶空微萃取法[11]等。直接进样法最为简便,但由于未富集,灵敏度不高,而且存在基体干扰问题。顶空法能够有效消除基体干扰,但是样品测定前需要恒温30~60 min以达到气液平衡,耗时较长, 而且沸点较高的卤代烃用顶空法测定的灵敏度不理想。液液萃取法虽然需要较为繁琐的萃取操作,但是能够克服直接进样法和顶空法的缺点,在富集效果和消除基体干扰方面都有优势,因此仍然被广泛应用[12,13]。吹扫捕集法和顶空微萃取法较为先进,但所需设备较为复杂,目前使用较少。
作为对传统的液液萃取法的改进,近年来提出的分散液液微萃取法(DLLME)[14]分离富集水中的有机物污染物具有简便、快速、高效的优点,获得了广泛研究和应用[15~17]。DLLME法为了便于离心收集微量的萃取剂,要求萃取剂的密度大于水,符合要求的萃取剂以卤代烃为主[17],这限制了该方法在卤代烃检测方面的应用。Kozani等[18]尝试了以二硫化碳为萃剂剂的DLLME-GC-ECD法测定饮用水中的三卤甲烷,虽然获得了显著的富集效果,但是二硫化碳在ECD检测器中有强烈的响应,不仅容易污染ECD,还产生明显的溶剂峰拖尾,干扰三氯甲烷峰,而且二硫化碳对三氯甲烷的萃取率也不高。Ma等[19]提出了改进的DLLME方法并尝试用二氯甲烷萃取水中的卤代消毒副产物,但该萃取剂也不适合使用ECD检测器,因此采用气相色谱-质谱联用法(GC-MS)进行检测,其灵敏度低于ECD检测器。悬浮固化(Solidification of floating organic-droplets, SFO)技术拓展了DLLME萃取剂的种类[20]。基于SFO-DLLME方法,已经有通过高级脂肪醇萃取水中卤代烃,并通过GC-ECD法检测的报道[21,22],该方法使用了无卤素萃取剂,但萃取剂的密度比水低,不能离心收集,不如使用高密度萃取剂简便。
本研究以联苯-联苯醚混合物作为无卤素萃取剂,通过DLLME法成功分离富集饮用水中的7种卤代烃。此萃取剂不含卤素和电负性基团,适用于ECD检测器,同时其密度大于水,保持了DLLME方法中萃取剂分离简便的优点。萃取相通过GC-ECD法进行测定,灵敏度和准确度都令人满意。
2 实验部分
2.1 仪器与试剂
GC2010气相色谱仪(日本岛津公司), 配不分流直接进样口(WBI-2010)和电子捕获检测器(ECD-2010); DB-624弹性石英毛细管色谱柱(30 m×0.53 mm×3.0 μm,美国安捷伦公司); 微量注射器(美国SGE公司)。萃取容器为10 mL尖底玻璃离心管(带磨口塞)。
标样:7种卤代烃标准物质分别为三氯甲烷(Chloroform, TCM)、四氯化碳(Perchlormethane, PCM)、三氯乙烯(Trichloroethylene, TCE)、一溴二氯甲烷(Bromodichloromethan, BDCM)、四氯乙烯(Perchloroethylene, PCE)、二溴一氯甲烷(Dibromochloromethane, DBCM)和三溴甲烷(Bromoform, TBM),其纯度均不低于99%,购于美国Sigma-Aldrich公司。
萃取剂:联苯、联苯醚均为分析纯(99.5%,美国Sigma-Aldrich公司),二者按质量比26.5∶73.5混合,在减压(5 kPa)条件下加热回流2 h, 除去挥发性杂质,在有活性炭的干燥器内保存,备用。
甲醇、乙腈、乙醇均为色谱纯(美国Fisher公司)。实验用纯水为亚沸蒸馏水,使用前通高纯氮(99.999%)加热回流1 h,在有活性炭的干燥器内冷却, 备用。
待测试样为武汉市内居民区采集的自来水,以及市售的瓶装纯净水和瓶装矿泉水。
2.2 实验方法
2.2.1标准溶液配制与定量分析方法标样分别用甲醇配制成1.00g/L的单标储备液,然后用甲醇稀释成混合工作标液。工作标液的浓度为:三氯甲烷10.0 mg/L,三氯乙烯、三溴甲烷均为2.00 mg/L,其余组分均为1.00 mg/L。将工作标液用纯水稀释成不同浓度的标准系列,采用与待测试样相同的方法进行处理和测定,采用外标法进行定量分析。
2.2.2水样的处理水样经0.45 μm针头滤膜(尼龙膜,天津津腾公司)过滤,移取5.00 mL于尖底玻璃离心管中,用微量注射器将200μL萃取剂与300 μL分散剂(甲醇)的混合液迅速注入到水样中,轻摇约30 s后得到乳浊液。以6000 r/min离心2 min,分层,弃去上层水相,用微量注射器吸取沉积相,供气相色谱测定。
2.2.3色谱条件使用DB-624色谱柱,高纯氢气(99.999%)为载气,恒线速度控制(40 cm/s)。程序升温:初始40℃保持2 min,以5℃/min升温至120℃,以30℃/min升温至240℃并保持10 min,排出高沸点的溶剂和其它杂质。ECD检测器温度280℃,基流0.5 nA,尾吹气为高纯氮气(99.999%),流速40 mL/min。 WBI不分流直接进样口,温度250℃,进样1.00 μL。
2.2.4萃取率和富集倍率计算将已知浓度的工作标液作为模拟样,采用与待测试样相同方法进行处理和测定,萃取率(Extraction recovery, ER)和富集倍率(Enrichment factor, EF)按下列公式计算:

(1)

(2)
其中,Caq为水相中目标物的原始浓度,模拟样中Caq已知;Csed为沉积相中目标物的浓度,通过外标法测定;Vaq为水样体积;Vsed为沉积相体积,由于本方法所用萃取剂在水中几乎不溶(溶解度<0.1 g/L),因此认为沉积相体积与加入的萃取剂体积近似相等。
2.3 分析方法的质量控制
以纯水代替待测样进行空白实验,所测得空白值小于方法检出限,因此测定过程中未进行空白扣除。将工作标样添加到待测水样中进行加标回收实验,测定方法的加标回收率。以现行国标方法[7]作为对照方法,采用顶空气相色谱法(HS-GC-ECD)对相同的水样进行了对照实验。
3 结果与讨论
3.1 色谱条件优化
挥发性卤代烃的分离通常采用中等极性或者弱极性色谱柱。实验结果表明,6%氰丙基苯基-94%甲基聚硅氧烷固定相(DB-624)对7种目标物分离效果最好,按2.2节所述色谱条件测定标样,色谱图见图1。使用极性较弱的固定相(如DB-1、DB-5等)时,三氯乙烯与一溴二氯甲烷分离度低;使用极性较强的固定相(如DB-1701等)时,三氯甲烷与四氯化碳分离度低。在此条件下,萃取剂在程序升温至约240℃时流出,且响应很低,对目标物无干扰,不会影响下一次进样。
由于目标物的沸点低、挥发性强,因此采用较低的初始柱温和厚液膜的色谱柱,以实现目标物的聚焦,从而获得尖锐的色谱峰。由于萃取剂的沸点较高,在进样口温度较低时难以瞬间气化,造成色谱峰的拖尾。实验表明,当进样口温度在240~260℃范围时可以实现瞬间气化,不存在拖尾现象。考虑到溴代烃类稳定性不好,高温下可能分解,因此进样口温度不宜太高,最终选定为250℃。
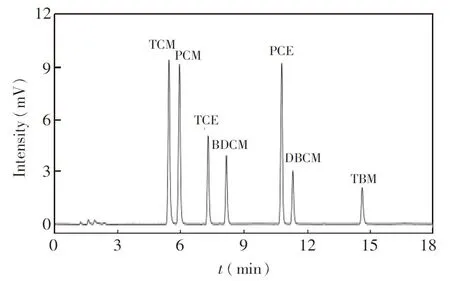
图1 DB-624大口径毛细管色谱柱分离7种卤代烃的色谱图Fig.1 Chromatograms of 7 kinds of halogenated hydrocarbons using capillary columns with DB-624 stationary phaseChromatographic conditions are as described in Section 2.2.
3.2 萃取方法的建立以及条件优化
3.2.1萃取剂的选择DLLME法常用的萃取剂主要是含氯溶剂,均不适用于GC-ECD法测定挥发性卤代烃。用于挥发性卤代烃测定的无卤素萃取剂主要有二硫化碳和高级脂肪醇,其物理性质见表1。DLLME法的萃取剂,除了要有较好的萃取效果外,密度还需比水高, 这样才能简便快速地通过离心收集微量的萃取相。二硫化碳符合上述要求,但是其ECD响应很强,形成的溶剂峰对低沸点的三氯甲烷干扰较为明显。高级脂肪醇的ECD响应很弱,在目标物之后出峰,不会产生干扰,但是其密度低于水,难以用离心的方法快速收集萃取相,只能使用SFO方法,通过冷冻使悬浮的萃取相凝固,然后取出。这种方法不及使用高密度萃取剂简便,耗时较长。本研究采用的联苯-联苯醚混合物是一种新型高密度无卤素萃取剂,不存在溶剂峰干扰问题,又能简便快速地通过离心收集微量的萃取相。此混合物俗称导生油(或道生油),在工业上广泛用作导热介质,性质稳定,毒性很低,比传统的含卤素萃取剂以及二硫化碳更加绿色环保。从表2可见,联苯和联苯醚单独使用时均不适合作为萃取剂,二者按质量比26.5∶73.5混合后, 达到低共熔点,常温下的密度大于水,而且在水中溶解度很低,适合用作DLLME法的萃取剂。
表1 不同萃取剂的物理性质对比
Table 1 Comparison of physical properties of different extractants

3.2.2萃取剂的用量考察了萃取剂用量分别为50、100、150、200和250 μL时的萃取效果,结果分别见图2和图3。图2的结果表明,减小萃取剂体积对提高富集倍率有利,在萃取剂体积较小时,各目标物均有较高的富集倍率。但是从图3可以看出,萃取剂用量太低时无法完全萃取目标物。使用50 μL萃取剂时,除四氯化碳和四氯乙烯外,其余目标物的萃取率均不到90%,其中三氯甲烷的萃取率仅为58%。随着萃取剂体积增加,各目标物的萃取率逐渐提高,当萃取剂体积达到200 μL时,7种目标物的萃取率均可达到90%以上。进一步增加萃取剂用量,萃取率提高不明显,但富集倍率继续降低。兼顾富集倍率和萃取率两个因素,选择萃取剂的最佳用量为200 μL。

图2 萃取剂体积对7种卤代烃富集倍率的影响Fig.2 Effect of extraction solvent volume on enrichment factor of seven halogenated hydrocarbonsThe extraction conditions are as described in Section 2.2

图3 萃取剂体积对7种卤代烃萃取率的影响Fig.3 Effect of extraction solvent volume on extraction recovery of seven halogenated hydrocarbonsThe extraction conditions are as described in Section 2.2.
3.2.3分散剂的种类和用量DLLME方法中需要使用能够与水和萃取剂都能完全混溶的分散剂,甲醇、乙腈、乙醇等较为常用[17]。这3种分散剂在本研究的体系中使用的效果对比见图4。使用甲醇作为分散剂时,7种目标物均有最高的萃取率。使用乙腈和乙醇作为分散剂时,各目标物的萃取率都显著降低。这可能是因为卤代烃在水中都有一定的溶解性,而乙腈和乙醇的极性比甲醇更弱,使卤代烃在水中的溶解度增加较为明显,从而降低了萃取率。因此,选择甲醇作为分散剂。
进一步考察了分散剂的用量对萃取效果的影响。分别以0.30、0.50和1.00 mL甲醇作为分散剂的萃取率见图5。实验结果表明,随着分散剂用量增加,各目标物的萃取率降低,其中三氯甲烷的萃取率降低最为显著。这主要是因为卤代烃在甲醇中易溶,水相中甲醇含量太高会使目标物溶解度显著增加。但分散剂用量小于0.30 mL时分散效果不佳,不能形成稳定的乳状分散液。因此最终选择分散剂用量为0.30 mL甲醇。
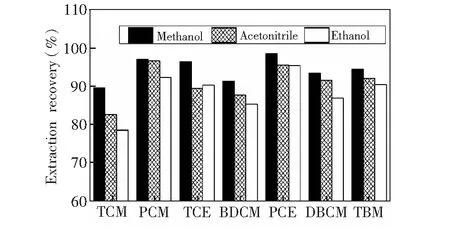
图4 不同分散剂对7种卤代烃萃取率的影响Fig.4 Effect of type of disperser solvent on extraction recovery of seven halogenated hydrocarbonsThe extraction conditions are as described in Section 2.2.

图5 分散剂体积对7种卤代烃萃取率的影响Fig.5 Effect of disperser solvent volume on extraction recovery of seven halogenated hydrocarbonsThe extraction conditions are as described in Section 2.2.
3.2.4萃取时间的确定DLLME方法的优势之一是萃取速度快,可在短时间内达到平衡[14~17]。考察了萃取时间从0.5~30 min范围内萃取率的变化。在0.5~10 min范围内测定结果基本一致,表明本体系仅需0.5 min即已达到萃取平衡。继续延长萃取时间,各目标物的萃取率反而降低,这可能与目标物挥发损失有关。本研究选择萃取时间为0.5 min。
3.2.5萃取温度的确定通常,温度变化会影响萃取平衡。分别在10℃、20℃、30℃的水浴条件下进行萃取,发现各目标物的萃取率变化很小。因此本方法不需严格控温,在室温下萃取即可。
3.2.6盐析剂和酸度的影响在卤代烃的萃取方法中,常通过盐析作用提高萃取率[8]。考虑到含Cl——的盐类有可能引起卤代烃的副反应[13,19],本研究考察了添加Na2SO4对目标物的盐析作用。当Na2SO4的加入量<50 g/L时,各目标物的萃取率变化均不明显。当Na2SO4的添加量更多时,水相密度显著增大,导致萃取剂悬浮,无法离心收集萃取剂。因此本研究在萃取时不添加无机盐。
饮用水的pH值一般在6.5~8.5范围内[3],但部分水样在采集时进行了酸化,以增加储存稳定性[13]。采用H2SO4和NaOH将水样分别调至pH=2.0、4.0、7.0、9.0进行萃取,实验结果表明,不同酸度下萃取率的变化很小。因此采集的水样若立即测定,可不控制pH值直接进行萃取;若需要保存,可适当酸化。
3.2.7沉积相的分离由于所用萃取剂密度大于水,离心约2 min即可破乳分层,离心转速在4000~6000 r/min范围内均可获得较好的效果。由于萃取剂与水几乎完全不互溶,有机相含水很少,无需干燥,可直接进行色谱测定[14~17]。由于萃取过程已经达到平衡,有机相浓度是均一的,在分离不完全的情况下也可获得一致的测定结果。
3.3 方法的检测性能
将工作标液用纯水稀释成不同浓度的标准系列,按2.2节方法进行测定,方法检测性能见表2。以各目标物的峰面积对其浓度进行线性回归,在表2所述的浓度范围内均可获得很好的线性关系,相关系数不低于0.998。
表2 本方法测定7种卤代烃的线性范围、检出限、定量限和富集倍率
Table 2 Linear ranges, limits of detection (LOD), limits of quantification (LOQ), and enrichment factors (EF) of 7 kinds of halogenated hydrocarbons
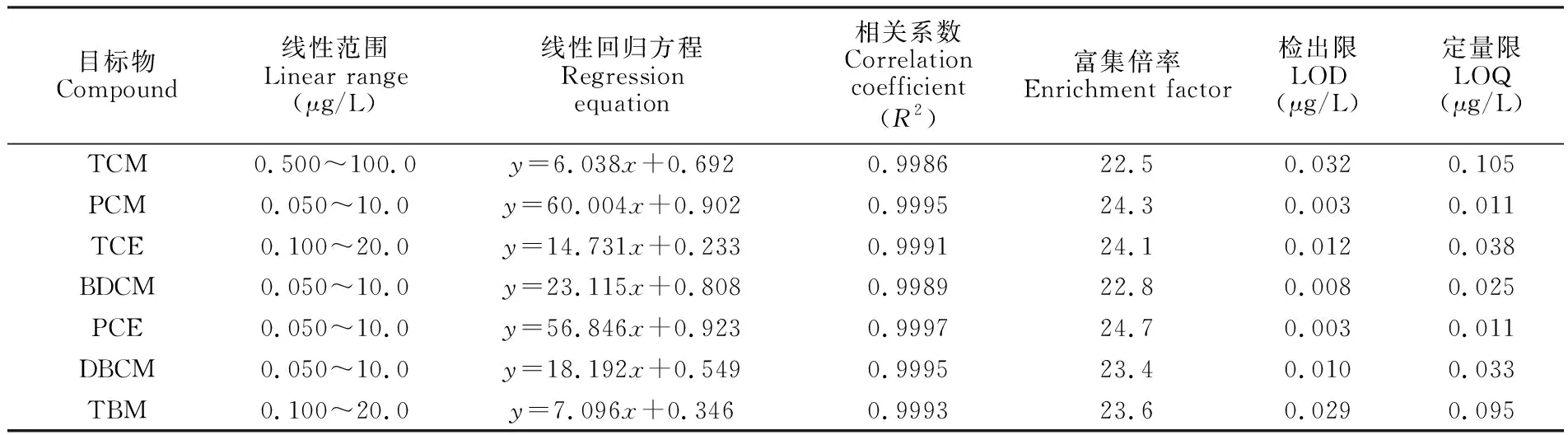
目标物Compound线性范围Linear range(μg/L)线性回归方程Regressionequation相关系数Correlationcoefficient(R2)富集倍率Enrichment factor 检出限LOD(μg/L)定量限LOQ(μg/L)TCM0.500~100.0y=6.038x+0.6920.998622.50.0320.105PCM0.050~10.0y=60.004x+0.9020.999524.30.0030.011TCE0.100~20.0y=14.731x+0.2330.999124.10.0120.038BDCM0.050~10.0y=23.115x+0.8080.998922.80.0080.025PCE0.050~10.0y=56.846x+0.9230.999724.70.0030.011DBCM0.050~10.0y=18.192x+0.5490.999523.40.0100.033TBM0.100~20.0y=7.096x+0.3460.999323.60.0290.095
根据最低浓度标样计算计算信噪比(S/N),并分别按S/N=3和S/N=10计算本方法的检出限和定量限,结果见表2。四氯化碳和四氯乙烯的检出限达到0.003 μg/L,灵敏度最低的三氯甲烷检出限也可达到0.032 μg/L。由于本研究通过萃取获得了22.5~24.7倍的富集倍率,因此灵敏度显著高于直接进样法[6]和顶空法[7]。由于分散液液微萃取使用的萃取剂体积很小,因此与传统的液液萃取-气相色谱法[8,12]相比能够获得更高的富集倍率。本方法的定量限远低于饮用水卫生标准的限值,完全可以满足饮用水中挥发性卤代烃的检测要求,有望用于天然水体中痕量卤代烃的测定。
3.4 实际样品分析
3.4.1水样分析选取自来水和2种不同的瓶装饮用水试样进行测定,3种水样均检出了不同种类的卤代烃,其含量见表3。其中自来水中检出了6种卤代烃(未检出三氯乙烯),其色谱图见图6A,萃取处理对各目标物富集效果明显,具有较高的灵敏度。在本色谱条件下分离效果良好,未见干扰峰。不同试样中各目标物测定结果的相对标准偏差(RSD)在2.1%~7.6%之间,说明本方法具有较好的精密度。以现行国标方法进行对照实验,对相同试样的测定结果也列于表3。对比表明,本方法的测定结果与标准方法基本一致,说明本方法具有较好的准确度。对于部分低含量的目标物,本方法能够检出,而对照方法未检出,这主要是由于对照方法的检出限为0.02~6.13 μg/L[7],目标物含量低于其检出限所致。
在实际样品的分析过程中,本方法处理一个试样仅需约3 min,与顶空法相比,速度显著提高;与传统的液液萃取法相比,本方法的操作明显简化,试剂用量也显著减少,更加符合绿色环保的要求。
表3 实际水样中7种卤代烃的测定结果及其精密度(n=7)
Table 3 Concentrations of seven halogenated hydrocarbons in water samples measured by this method (n=7)

目标物Compound自来水 Tap water测定值Detected(μg/L)相对标准偏差RSD (%)对照值*Referencevalue(μg/L)瓶装饮用水1(纯净水)Bottled water 1 (purified water)测定值Detected(μg/L)相对标准偏差RSD (%)对照值*Referencevalue(μg/L)瓶装饮用水2(矿泉水)Bottled water 2 (spring water)测定值Detected(μg/L)相对标准偏差RSD (%)对照值*Referencevalue(μg/L)TCM8.633.28.4512.82.612.50.2194.20.225PCM0.0166.4NotdetectedBelowthe LOQ-NotdetectedNotdetected-NotdetectedTCENotdetected-NotdetectedNotdetected-NotdetectedNotdetected-NotdetectedBDCM1.552.11.591.372.81.330.1214.30.116PCE0.0364.9NotdetectedNotdetected-NotdetectedNotdetected-NotdetectedDBCM0.2612.80.2470.1824.50.1910.1443.90.154TBM0.1714.7Notdetected0.1197.6Notdetected0.3753.3Notdetected* 采用2.3节所述对照方法进行测定。Measured by the control method described in Section 2.3.
3.4.2实际水样的加标回收实验以自来水试样为基体,分别进行了低浓度和高浓度两个不同水平的加标实验,结果见表4,其中低浓度加标样品的色谱图见图6B。在不同浓度水平下,本方法的加标回收率在93.0%~102.9%之间,这进一步说明方法的准确度较高。
表4 自来水样品的加标回收实验结果(n=7)
Table 4 Recovery of tap water sample (n=7)

目标物Compound本底值Background(μg/L)低浓度水平Recovery at low spiking levels加标量Added(μg/L)测定值Total found(μg/L)回收率Recovery(%)高浓度水平Recovery at high spiking levels加标量Added(μg/L)测定值Total found(μg/L)回收率Recovery(%)TCM8.6310.0018.1094.750.056.7096.1PCM0.0161.000.9896.65.004.7193.9TCENotdetected2.001.9899.010.010.20102.0BDCM1.551.002.4893.05.006.4497.8PCE0.0361.001.06102.45.005.18102.9DBCM0.2611.001.2194.95.005.29100.6TBM0.1712.002.18100.510.09.6294.5

图6 实际水样与加标水样的色谱图(A)自来水样; (B)自来水样低浓度加标,加标浓度水平见表4。色谱条件见2.2节所述。Fig.6 Chromatograms of real water sample and spiked water sample by using DLLME-GC-ECD methed(A) Tap water sample; (B) Tap water samples spiked with low concentration level of standard as described in Table 4. The chromatographic conditions are described in Section 2.2.
4 结 论
本研究采用联苯-联苯醚混合物作为高密度无卤素萃取剂,通过DLLME法分离富集水中的7种挥发性卤代烃,萃取率≥90%,富集倍率≈25。萃取液经DB-624毛细管柱分离,用ECD定量检测,检出限可达0.003~0.032 μg/L。本方法的试样处理仅需约3 min,具有简便快速的优点。 本方法的灵敏度和检测速度优于传统的顶空法和液液萃取法。
