猪圆环病毒2型广东分离株的基因序列分析
2018-09-11张梦珂杜柏槐陈绍红
张梦珂,杜柏槐,陈绍红,刘 铀*
(1.广东海洋大学农学院,广东 湛江 524088;2.广东海洋大学生化中心,广东 湛江 524088)
【研究意义】猪圆环病毒(PCV)是一种无囊膜包裹、单股负链的DNA病毒,为圆环病毒科、圆环病毒属的重要成员[1]。为深入了解PCV2及PCV2亚型在广东猪群的流行情况,分析其基因序列的遗传变异具有重要意义。【前人研究进展】PCV可分为PCV1和PCV2 2个血清型,其中PCV1基因组全长为1759 bp,核苷酸序列同源性大于99 %,对猪无致病性;而PCV2常与猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)等多种病原微生物混合感染,也是导致仔猪多系统衰竭综合症(PMWS)、猪皮炎与肾病综合征(PDNS)和免疫机能抑制的主要原因[2][3]。PCV2基因组全长为1766~1768 bp,包括ORF1和ORF2 2个主要的开放阅读框。根据ORF2核苷酸序列的差异,可将PCV2分为a,b,c和d 4个亚型[4]。研究证实国内猪群以PCV2a,PCV2b,PCV2d亚型感染为主[5-8]。【本研究切入点】广东省为养猪大省,而近年来由于PCV2与其他病原微生物的混合感染给养殖户带来了严重的经济损失。因此,本研究旨在为猪圆环病毒病的防治提供科学依据。【拟解决的关键问题】通过对同源性的比对和遗传进化树图分析猜测可能存在由PCV2b到PCV2d的变异,因此有必要进一步研究PCV2基因变异对其致病性与Cap蛋白抗原性的影响。
1 材料与方法
1.1 菌株、细胞与病料来源
大肠杆菌DH5α(广东海洋大学生化中心),PK15细胞(中山大学动物实验中心);疑似PMWS病死猪的淋巴结、脾脏、肺组织来自广东各地猪场。
1.2 工具酶及主要试剂
RNA/DNA提取试剂盒,DNA Marker,小量质粒回收试剂盒,DNA凝胶回收试剂盒,pMD-19T:大连宝生物工程有限公司产品;SacI,HindIII,T4 DNA连接酶:TOYOBO公司产品;蛋白酶K,dNTPs,TaqDNA聚合酶:北京鼎国生物科技公司产品;胎牛血清:Hylcone公司产品;DMEM低糖培养基:Gibco公司产品;FITC标记的羊抗鼠IgG:二抗Jackson公司产品;鼠抗PCV2阳性血清:本实验室制备。
1.3 PCV2的增殖
将疑似PMWS病死猪的淋巴结、脾脏和肺组织,加入含青霉素和链霉素1000 IU/mL的PBS (pH 7.2)匀浆,冻融3次,12 000 r/min离心15 min,取上清液用0.22 μm滤膜过滤除菌,接种PK15细胞,于37 ℃、50 mL/L CO2培养24 h,加入终浓度为作用30 min,PBS润洗3次,新鲜培养基,继续培养48 h,收获病毒或用间接免疫荧光试验检测PCV2。
1.4 间接免疫荧光试验检测PCV2
将1.3中感染病毒的PK15细胞用PBS洗涤3次,预冷甲醇固定15 min,用含0.05 %吐温-20 的PBST洗涤3次,5 % BSA封闭2 h,PBST洗涤3次,加入鼠抗PCV2血清,37 ℃孵育1 h,PBST洗涤3次,加入FITC标记的羊抗鼠IgG,37 ℃避光孵育1 h,PBST洗涤3次,在荧光显微镜下观察结果。
1.5 病毒DNA的提取
将1.3中感染病毒的PK15细胞反复冻融3次,按照大连宝生物工程公司DNA提取试剂盒说明书提取病毒DNA。
1.6 引物设计与合成
参考GenBank收录的PCV2基因组全序列,用DNAStar 7.0软件进行全基因组核苷酸序列比较,用Primer 5.0在保守区设计两对特异性的引物。PA1和PA2分别位于445~462 和1768 ~1750 nt,其核苷酸序列为PA1:5′-TGGTGACCGTTGCAGAGC-3′,PA2:5′-AATACTTACAGCGCACTTC-3′,扩增片段为760 bp;PB1和PB2分别位于1612~1629和603~586 nt,其核苷酸序列为PB1:5′-TTTTCCTTCTCCAACGGT-3′,PB2:5′-CAGCCCATTTGCTTTTAC-3′,扩增片段为1324 bp。
1.7 PCR产物的纯化和序列测定
PCR产物用10 g/L琼脂糖电泳分离,DNA凝胶回收试剂盒纯化,交由广州艾基生物技术公司测定其核苷酸序列,通过片段拼接得到PCV2全基因组序列。
1.8 基因序列的比较分析
利用DNAStar7.0软件对PCV2基因组、ORF1和ORF2序列进行同源性比较,用MEGA6.0绘制遗传进化树,分析比较PCV2广东分离株与其它有代表性的参考毒株(表1)的遗传进化关系。
2 结果与分析
2.1 PCV2的分离与鉴定
接种PCV2的PK15细胞培养48 h后,细胞生长良好,未见细胞明显上浮或病变,用鼠抗PCV2抗体和荧光标记的羊抗鼠IgG染色后,可见细胞内出现亮绿色的小点(图1A),而PK15细胞对照无此现象(图1B)。经IFA鉴定的PCV2分离株分别命名为GD-1、GD-2、GD-3、GD-4和GD-5。
2.2 PCV2分离株基因组的PCR扩增
以PA1和PA2、PB1和PB2为特异性引物、5个PCV2分离株基因组DNA为模板,用PCR扩增获得大小分别为760 bp的 A片段(图2A)和1324 bp的B片段(图2B),与预期结果相符。
2.3 PCV2分离株的基因序列分析
5个PCV2分离株中,GD-1和GD-2基因组全长为1767 bp,GD-3,GD-4和GD-5基因组全长为1768 bp。如表2所示,各分离株之间的核苷酸同源性为95.0 %~99.9 %,GD-3和GD-4分离株之间的同源性高达99.9 %;5个分离株与参考毒株之间的核苷酸序列同源性为93.8 %~100 %,其中GD-1与来自黑龙江的HM038017株核苷酸序列完全相同。
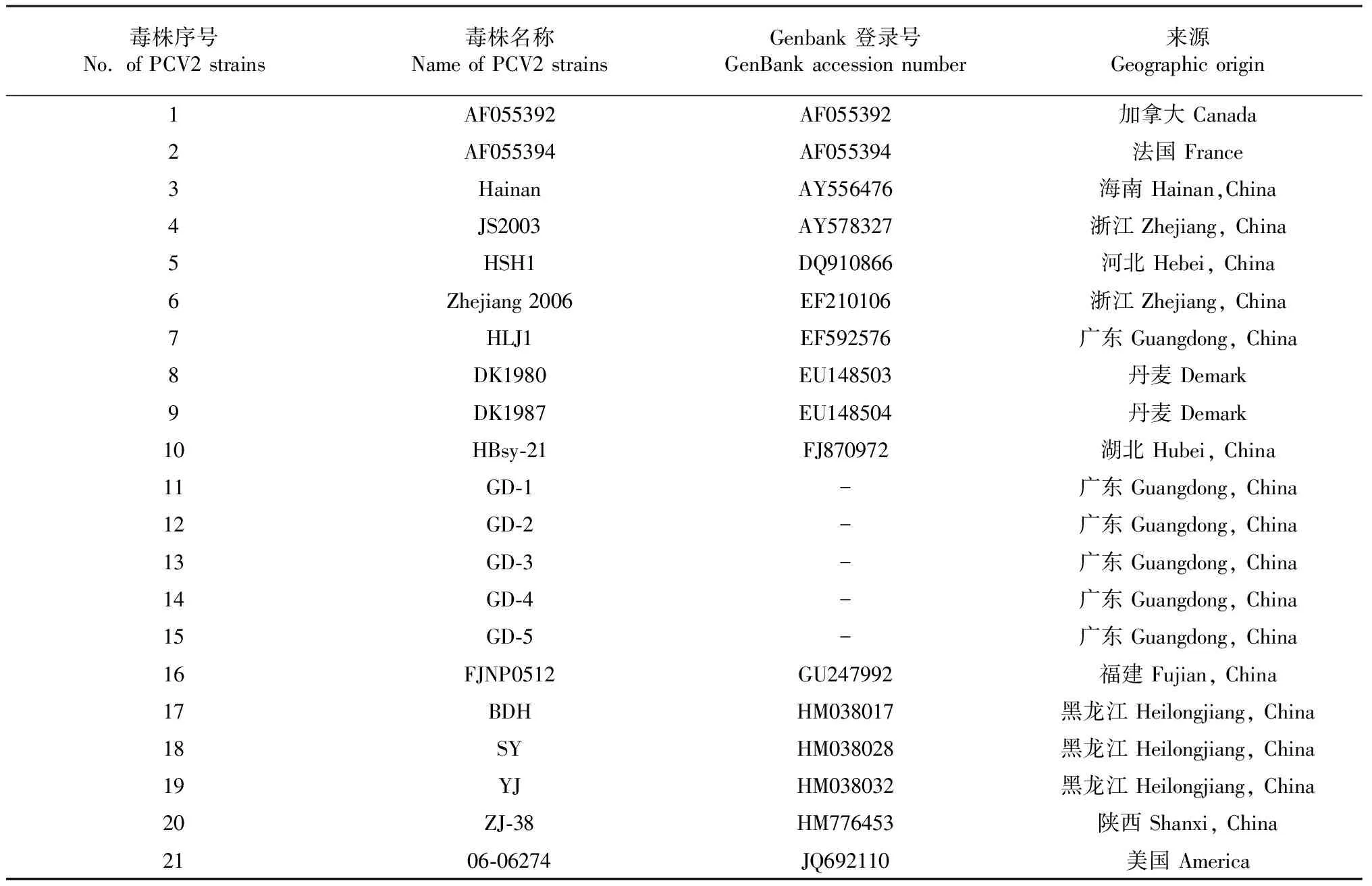
表1 PCV2参考毒株

A:接种PCV2的PK15细胞;B:PK15细胞对照A:PK15 cells infected by PCV2 isolates; B:PK15 cells control图1 IFA检测PCV2分离株Fig.1 Detection of PCV2 isolates by IFA
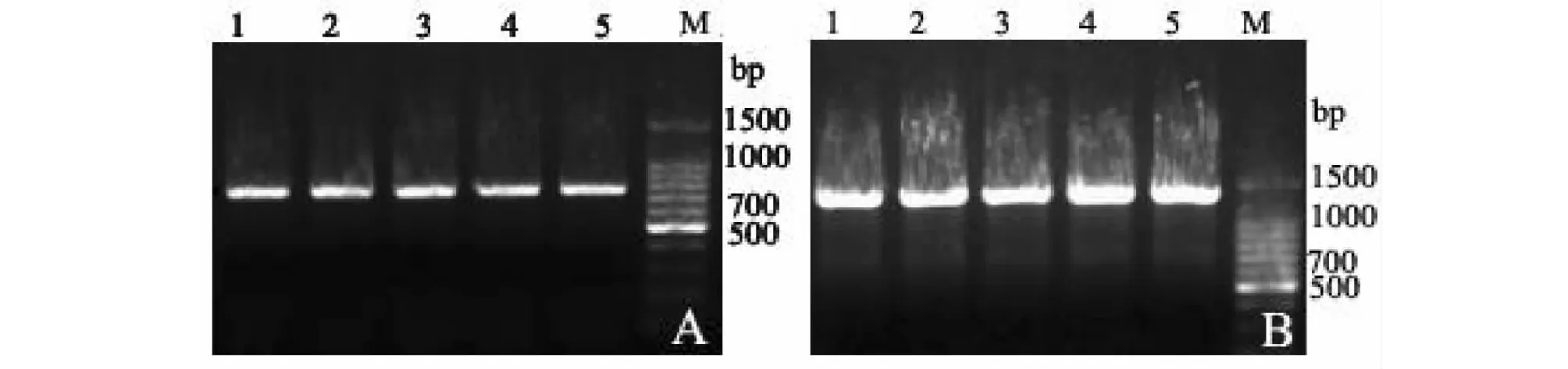
A:A片段的PCR扩增产物;B:B片段的PCR扩增产物;1~5:PCV2分离株的PCR扩增产物;M:100 bp DNA 分子量标准A:PCR product of A fragment; B:PCR product of B fragment;1-5:PCR amplified products of PCV2 isolates; M:100 bp DNA ladder图2 PCR扩增PCV2分离株基因组片段Fig.2 PCR amplification of gene fragments of PCV2 isolates

表2 PCV2全基因组核苷酸序列同源性比较
注:表2右上半部为PCV2基因组核苷酸序列同源性,左下半部为PCV2基因组核苷酸序列差异。
Note:The upper right part of the table 2 was homology of nucleotide sequences for PCV2 genome and the lower left part was difference of nucleotide sequences for PCV2 genome.
5个PCV2分离株ORF1的核苷酸序列全长为945 bp,编码315个氨基酸。5个分离株ORF1的核苷酸序列同源性和推导氨基酸序列同源性分别为96.8 %~100 %和99.4 %~100 %;5个分离株与参考株之间的核苷酸与推导的氨基酸序列同源性分别为96.5 %~100 %和96.8 %~100 %(表3)。

表3 ORF1的核苷酸及推导的氨基酸酸序列同源性比较

续表3 Continued table 3
注:表3右上半部为ORF1核苷酸序列同源性,左下半部为ORF1氨基酸序列同源性。
Note:The upper right part of the table 3 were homology of nucleotide sequences for ORF1 and the lower left part was homology of amino acid sequences of ORF1.
5个PCV2分离株中GD-1和GD-2的ORF2的长度为702 bp,编码233个氨基酸,GD-3、GD-4和GD-5的ORF2的长度均为705 bp,编码234个氨基酸。5个分离株ORF2的核苷酸序列同源性为89.9 %~99.9 %,推导的氨基酸序列同源性为88.0 %~100 %;5个分离株与参考株之间的核苷酸与推导的氨基酸序列同源性分别为86.8 %~100 %和83.7 %~100 %(表4)。
2.4 PCV2的遗传进化分析
由PCV2全基因组核苷酸序列构建的遗传进化树(图3)可见,GD-1和GD-2均属于PCV2d亚型。GD-1与源自陕西的ZJ-38(HM776453)、黑龙江的DBH(HM038017)、湖北的HBsy-21(FJ870972)位于相同的进化枝,且遗传距离较近,GD-2株位于单独的进化枝,与GD-1遗传距离较远;GD-3、GD-4和GD-5属于PCV2a亚型,遗传距离较近。

表4 ORF2的核苷酸及推导的氨基酸酸序列同源性比较
注:表4右上半部为ORF2核苷酸序列同源性,左下半部为ORF2推导的氨基酸序列同源性。
Note:The upper right part of the table 3 were homology of nucleotide sequences for ORF2 and the lower left part was homology of amino acid sequences of ORF2.
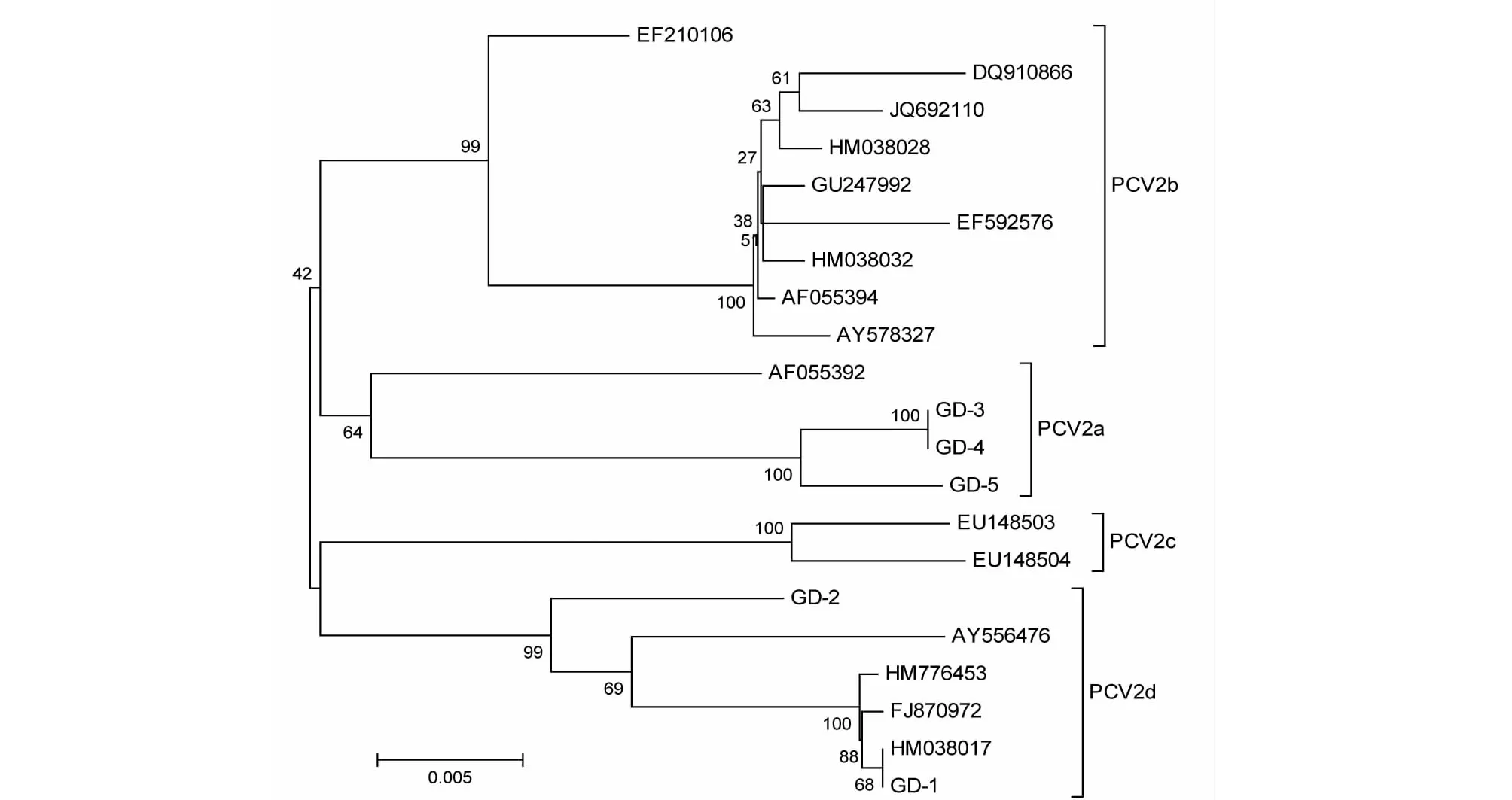
图3 基于PCV2全基因组序列构建的遗传进化树Fig.3 Phylogenetic tree based on the complete nucleotide sequences of PCV2 genome
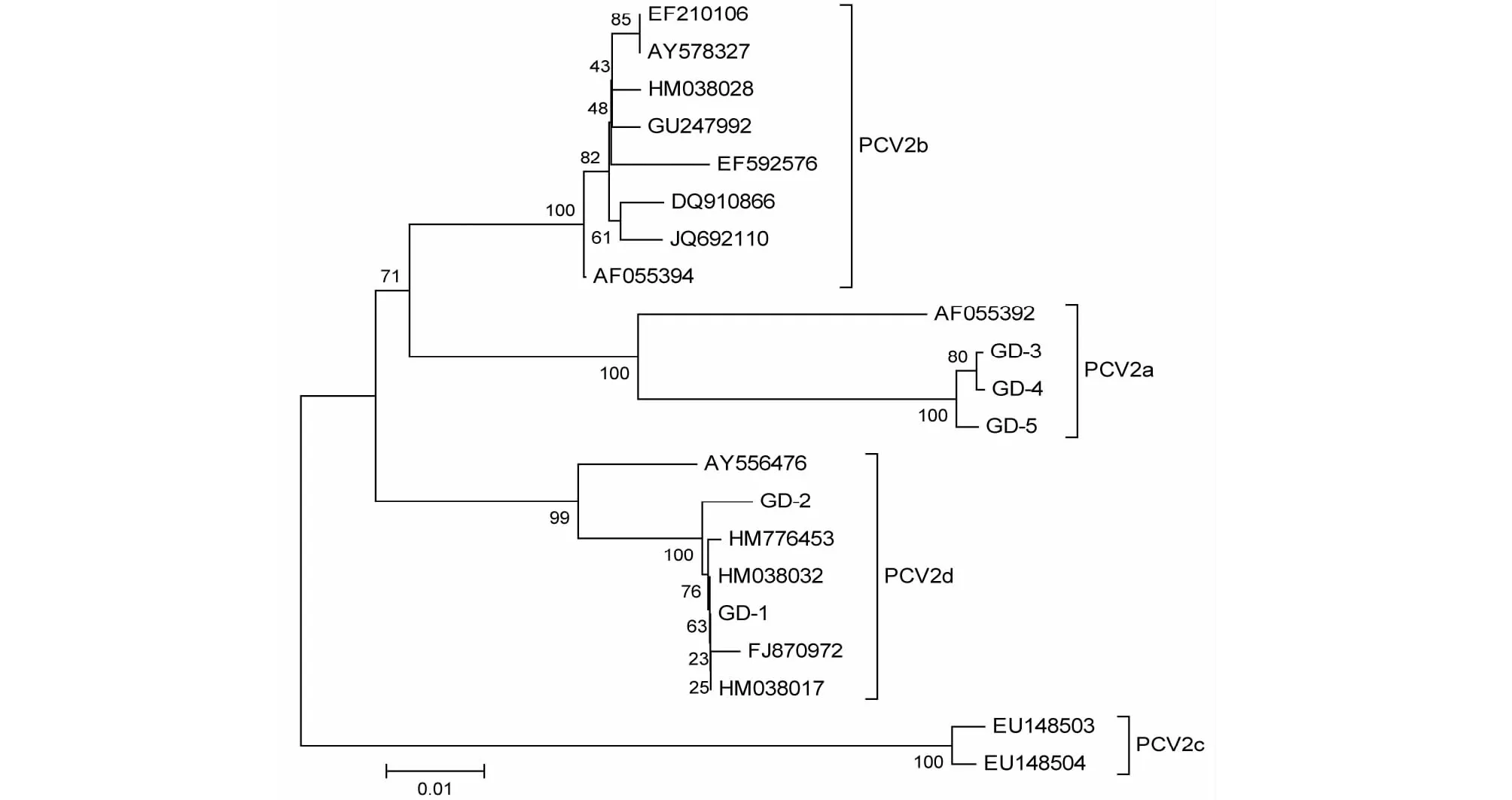
图4 基于ORF2核苷酸序列构建的遗传进化树Fig.4 Phylogenetic tree based on the ORF2 nucleotide sequences of PCV2
由ORF2核苷酸序列构建的遗传进化树(图4)上来看,GD-1、GD-2与参考毒株ZJ-38、YJ、DBH、HBsy-21位于同一进化枝,且遗传距离较近,均属于PCV2d亚型;而GD-3、GD-4和GD-5属于PCV2a亚型,位于单独的进化枝。
3 讨 论
近年来,规模化猪场PCV2感染呈上升趋势,由此导致母猪繁殖机能障碍、免疫抑制及仔猪生长发育不良、衰弱和死亡时有发生,加上PCV2常与繁殖呼吸综合征病毒(PRRSV)、伪狂犬病病毒(PRV)、肺炎支原体等的混合感染,给养猪业造成严重的经济损失[9]。从现有文献资料来看,广东猪群PCV2感染情况非常普遍[7-8]。本研究结果显示,来自广东不同猪群15份疑似PMWS的组织样品中,PCV2感染率为33.3 %。
ORF1编码的Rep蛋白与PCV2在宿主细胞的复制有关。5个分离株ORF1的核苷酸序列同源性和推导氨基酸同源性分别为96.8 %~100 %和99.4 %~100 %,GD-3和GD-4同源性达到100 %,5个分离株与参考株之间的核苷酸序列同源性与推导的氨基酸同源性分别为96.2 %~100 %和95.9 %~100 %,ORF1基因序列保守性较高。
ORF2编码的cap蛋白是病毒的主要结构蛋白,是主要宿主保护性抗原[10],Cap蛋白个别氨基酸突变可影响其空间构象和抗原表位,进而影响病毒在宿主细胞的增殖和致病性[11-12]。本研究分离鉴定的5个PCV2毒株中,GD-1和GD-2的ORF2长度为702 bp,编码233个氨基酸,GD-3、GD-4和GD-5的ORF2长度均为705 bp,编码234个氨基酸,其一级结构均含有特征性氨基酸基序86S-N-P-R-S-V91组成的结构域。
根据PCV2基因组和ORF2构建的遗传进化树,发现5个PCV2分离株中,GD-1和GD-2属于PCV2d亚型,与源自湖北、陕西和黑龙江的病毒株亲缘关系较近;GD-3、GD-4和GD均属于PCV2a亚型,位于独立进化枝。徐廷川等[7]发现2007-2011年分离的49个PCV2广东分属于PCV2b和PCV2d亚型;严妍等[8]对11个PCV2广东分离株的基因序列分析证实其中10个分离株为PCV2b亚型,仅1个为PCV2a亚型。上述差异可能与PCV2分离的地区不同有关,但不排除PCV2基因型由PCV2b到PCV2d的变异[7,13]。因此有必要进一步研究PCV2基因变异对其致病性与Cap蛋白抗原性的影响,为培育和筛选更为有效的疫苗株奠定基础。
4 结 论
通过对同源性的比对和遗传进化树图分析PCV2基因型可能存在由PCV2b到PCV2d的变异,因此有必要进一步研究PCV2基因变异对其致病性与Cap蛋白抗原性的影响,为培育和筛选更为有效的疫苗株奠定基础。
