大豆孢囊线虫扩展蛋白新基因(Hg-exp-1、Hg-exp-2)的鉴定及功能分析
2018-09-11张瀛东孔详超黄文坤孔令安李红梅彭焕彭德良
张瀛东,孔详超,,黄文坤,孔令安,李红梅,彭焕,彭德良
(1中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;2南京农业大学植物保护学院, 南京210095)
0 引言
【研究意义】大豆孢囊线虫病是由大豆孢囊线虫(soybean cyst nematode,Heterodera glycines)引起的一种大豆生产的毁灭性病害,该病害分布范围大、寄主范围广、传播途径多,造成经济损失严重,是一种公认的极难防治的大豆病害[1]。该病害在大豆主产国如中国、美国、加拿大、巴西、俄罗斯等均有发生分布,给全球大豆生产造成重大的经济损失。在中国一般造成大豆减产5%—10%,严重地块减产30%—50%,甚至绝收[2]。孢囊线虫在寄生过程中,食道腺细胞分泌一系列的效应蛋白,并通过口针注入到植物体内,在侵入、取食位点的建立与维持过程中发挥着关键作用[3-4]。细胞壁扩展蛋白 expansin是植物寄生线虫食道腺的一种重要分泌蛋白,它通过对植物细胞壁进行修饰来降解和松弛植物细胞壁以利于线虫侵入和迁移。通过克隆大豆孢囊线虫扩展蛋白,明确其结构、组织定位、发育表达特性和生物学功能,可为进一步明确大豆孢囊线虫的寄生和致病机制打下基础,对大豆孢囊线虫绿色可持续防控具有重要意义。【前人研究进展】植物寄生线虫expansin能够促使细胞的伸展和细胞壁的降解,利于线虫的侵入,而植物寄生线虫侵染植株首先要穿透细胞壁才能取食,无论是植物寄生线虫本身分泌还是诱导植物合成,expansin在线虫的整个侵染过程中都起到了关键的作用。马铃薯金线虫(Globodera rostochiensis)的GrExpb1是第一个从植物寄生线虫中克隆得到的expansin基因。QIN等[5]利用cDNA克隆技术,获得了编码细胞壁扩展蛋白的基因Grexpb1,来自 expansin多基因家族。Gr-EXPB1与植物expansin具有同源性,并且在体外实验中对植物细胞壁延长具有诱导活性;KIKUCHI[6]从松材线虫(Bursaphelenchus xylophilus)和拟松材线虫(B.mucronatus)中分别克隆到了编码expansin-like蛋白的基因,并且证实在这两种线虫的不同种群中均存在expansin基因。由于在非致病的拟松材线虫中存在expansin-like蛋白,认为expansin-like蛋白只在线虫穿行于植物组织过程中起到一定作用,而不是在致病力方面起到作用;HAEGEMAN[7]从非洲茎线虫(Ditylenchus africanus)中克隆出一个编码expansin-like蛋白的基因;PENG等[8]从马铃薯腐烂茎线虫(D. destructor)中克隆出两个expansin蛋白基因,通过结构域和内含子分析,推测两个 expansin可能来源于细菌的水平基因转移,并且具有不同的祖先来源;LIU等[9]从小麦禾谷包囊线虫中分离出一个expansin蛋白HaEXPB2,并证实其能够引起细胞凋亡,该蛋白定位于细胞壁,具有明显纤维素结合活性;原位杂交显示HaEXPB2在2龄幼虫的食道腺合成,在侵染后的2龄幼虫表达量最高,体外RNAi可以使2龄幼虫的侵染率下降53%;ALI等[10]证明了马铃薯金线虫expansin蛋白GrEXPB2能够抑制植物的防御反应以及NB-LRR信号在细胞质中的诱导作用,GrEXPB2特定的序列可以诱发马铃薯和番茄的防御反应。在已报道的南方根结线虫(Meloidogyne incognita)、北方根结线虫(M. hapla)、马铃薯孢囊线虫(Globodera pallida)和松材线虫等植物寄生线虫基因组中分别发现了20、6、7、8个expansin基因[11-15]。【本研究切入点】尽管大豆孢囊线虫的效应蛋白最先被研究,但是对于大豆孢囊线虫扩展蛋白基因的克隆和功能尚未见报道。【拟解决的关键问题】通过同源克隆和RACE技术获得两个大豆孢囊线虫expansin基因的cDNA全长,构建系统进化树,明确其在基因组中的拷贝数、在线虫体内的表达位点和表达时间,并通过RNA干扰对该基因的功能进行研究,为大豆孢囊线虫致病机理的解析及制定相应的防治策略打下基础。
1 材料与方法
试验于 2014—2017年在中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室完成。
1.1 供试线虫
大豆孢囊线虫4号生理小种采自中国农业科学院植物保护研究所廊坊实验基地,在中国农业科学院植物保护研究所温室扩繁。采用蔗糖离心法将成熟的孢囊从土壤中分离后,灭菌水洗涤后置于3 mmol·L-1的氯化锌溶液中,25℃孵化。收集孵化的大豆孢囊线虫2龄幼虫经过灭菌水洗涤,离心后,液氮速冻,-80℃低温保存备用。
1.2 试剂
Trizol试剂、SuperScriptTMⅢ First-Strand Synthesis System、5′ RACE System for Rapid amplification of cDNA Ends Version2.0、GeneRacerTMKit购于美国Invitrogen公司;DNeasy Blood & Tissue Kit购于德国QiaGen公司;大肠杆菌感受态细胞DH5α、琼脂糖凝胶DNA回收试剂盒购于天根生化科技有限公司;EX Taq酶、3′-Full RACE Core Set Ver 2.0试剂盒、pMD18-T easy Vector等购于大连TaKaRa公司;DIG High Prime DNA Labeling and Detection Starter Kit I、PCR DIG Probe Synthesis Kit、蛋白酶K和杂交尼龙膜购于德国Roche公司;章鱼胺、明胶、亚精胺购于美国Sigma公司;异硫氰酸荧光素(FITC)购于生工生化(上海)有限责任公司;MEGAscript High Yield Transcription Kit和MEGAclearTMKit购于美国ABI公司,其他试剂购于美国Sigma公司或国产分析纯。
1.3 方法
1.3.1 基因组DNA、总RNA提取与第一链cDNA合成大豆孢囊线虫基因组 DNA参照 QiaGen公司的DNeasy Blood & Tissue Kit基因组纯化试剂盒说明书提取;总RNA提取采用Trizol试剂参考彭焕等[16]冻融法进行,第一链cDNA和扩增3′和5′末端的cDNA参照SuperScriptTMⅢ First-Strand Synthesis System和GeneRacerTMRACE Kit试剂盒说明书合成。
1.3.2 大豆孢囊线虫expansin基因EST片段的克隆根据已报道的线虫expansin基因的保守序列设计上下游简并引物EXP1和EXP2(表1),以大豆孢囊线虫cDNA第一链为模板进行PCR反应,反应体系:2.5 μL 10×PCR Buffer,2 μL dNTP Mixture(2.5 mmol·L-1),1 μL 引物 EXP1 和 EXP2,0.5 μL Ex Taq DNA 聚合酶,2 μL第一链cDNA模板,双蒸水补齐25 μL体系。PCR反应条件为94℃预变性5 min;94℃ 30 s,55℃/57℃ 30 s,72℃ 1 min,35个循环;72℃延伸10 min,PCR产物电泳分离、回收、连接并送样测序。
1.3.3 expansin基因全长克隆 根据EST扩增序列分别设计3′ RACE特异性引物EXPB1-1、EXPB1-2、EXPB2-1、EXPB2-2 和 5′RACE 特异性引物 EXPB1-3、EXPB1-4、EXPB2-3、EXPB2-4(表 1),以大豆孢囊线虫cDNA第一链为模板,参考3′-Full RACE Core Set Ver 2.0试剂盒和 5′ RACE System for Rapid amplification of cDNA Ends Version2.0,GeneRacerTMKit说明书分别进行3′ RACE和5′ RACE扩增。扩增产物经1%琼脂糖电泳检测、回收、连接并送样测序。测序拼接后,设计两组特异性引物 HgEXP1F1和HgEXP1R1、HgEXP2F1和HgEXP2R1(表1),以第一链cDNA为模板进行cDNA全长扩增验证,以基因组DNA为模板进行扩增,进行基因组全长扩展,PCR扩增产物进行回收测序。
1.3.4 序列分析 序列采用DNAstar 7.1和DNAman软件对 cDNA进行拼接和比对;使用 CLC sequence viewer 6进行开放阅读框查找、蛋白质翻译和序列比对;使用 EBI在线软件 SignalP 3.0 Server[17]和TMHMM 软件进行预测蛋白质前体信号肽和跨膜结构域预测;使用pI/Mw tool在线工具预测蛋白质分子量和等电点;使用GSDS在线软件进行基因组结构分析;使用PHYML[18]软件和MEGA5.0[19]软件最大似然法(maximum likelihood,ML)进行系统进化树构建。
1.3.5 Southern杂交 根据Hg-exp-1cDNA序列设计探针引物exp1-tz-F和exp1-tz-R(表1),以cDNA第一链为模板进行扩增,回收产物,回收产物采用DIG High Prime DNA Labeling and Detection Starter KitⅠ试剂盒进行探针标记。约 5 µg大豆孢囊线虫基因组DNA被EcoRⅤ和Hind Ⅲ限制性内切酶切完全后,经过0.8%琼脂糖凝胶电泳分离,DNA片段转膜、固定并与DIG标记的探针进行杂交,杂交过程参照DIG High Prime DNA Labeling and Detection Starter KitⅠ进行,洗脱和显色后,观察照相。
1.3.6 原位杂交 原位杂交过程参考DE BOER等[20]的方法进行。根据expansin基因序列,设计探针引物exp1-tz-F、exp1-tz-R、exp2-tz-F和exp2-tz-R(表1),采用PCR DIG Probe Synthesis Kit进行探针标记合成。新孵化的大豆孢囊线虫 2龄幼虫 4%多聚甲醛固定后用手术刀将虫体切断,使用蛋白酶K、甲醇和丙酮对虫体进行消化和通透,虫体用杂交液重悬,加入DIG标记的探针,参考DIG High Prime DNA Labeling and Detection Starter KitⅠ说明书进行杂交和洗脱。经过黑暗显色16 h后,使用0.05%吐温20溶液停止显色,无菌水重悬线虫,在Leica DM2500显微镜下观察照相。
1.3.7 发育表达分析 参考 ELLING等[21]方法,略作改进,分离侵染后的2—4龄幼虫和白雌虫,在接种40 d后分离孢囊,收集新孵化的2龄幼虫和卵。参照Dynbeads® mRNA DIRECTTM Kit说明书,提取不同龄期大豆孢囊线虫 mRNA,使用 SuperScriptTMⅢFirst-Strand Synthesis System试剂盒进行第一链cDNA合成。以exp1-tz-F和exp1-tz-R,exp2-tz-F和exp2-tz-R为引物,以不同龄期大豆孢囊线虫cDNA为模板进行PCR扩增,特异性引物act-F和act-R扩展Actin作为内参,扩增体系同1.3.2,反应条件:94℃ 5 min;94℃ 30 s,56/59℃ 30 s,72℃ 1 min,27 个循环;72℃ 10 min。扩增产物在1.5%的琼脂糖凝胶上分离,EB染色照相。
1.3.8 体外RNA干扰功能 根据Hg-exp-1的cDNA全序列,设计特异引物EXP1-T7-F和EXP1-T7-R,采用 MEGAscript High Yield Transcription Kit(Ambion)和MEGAclearTM试剂盒进行dsRNA体外转录和纯化。参考URWIN等[22]方法将5 000头新鲜收集的大豆孢囊线虫2龄幼虫转入含有M9 buffer 40 µL,亚精胺(30 mg·mL-1)20 µL,明胶(5%)2 µL,章鱼胺(200 mg·mL-1)50 µL,FITC(10 mg·mL-1)5 µL,dsRNA(2 mg·mL-1)浸泡液中,25℃浸泡24 h,以gfp dsRNA和无菌水替代 dsRNA作为对照。浸泡完的线虫去除 dsRNA和FITC后,置于显微镜下观察线虫活力及线虫对FITC的取食程度。
收集不同处理的线虫约100头,提取mRNA并反转录合成 cDNA作为模板,以 exp1-tz-F、exp1-tz-R和actin-R、actin-F(表1)为引物进行PCR反应,反应体系与条件参照1.3.2所述,进行基因沉默检测。不同dsRNA处理和清水处理的线虫,按每株300头接种大豆苗,每个处理10次重复。置于光照培养箱25℃培养。10 d后,收集大豆根系品红染色后,在显微镜下统计根内线虫数目。35 d后分离大豆根上和土壤中的雌虫计数,结果采用SAS软件运用邓肯法进行显著性分析。
2 结果
2.1 Expansin基因克隆
通过简并引物,从大豆孢囊线虫cDNA中克隆长度分别为351和316 bp的片段,经过blast分析比对,与马铃薯金线虫的Grexpb1同源性最高。以351 bp序列为基础,RACE扩增到长度分别为379和542 bp的3′和5′ cDNA末端,序列拼接后获得了长度为1 047 bp的cDNA序列,命名为Hg-exp-1(GenBank登录号:HM798586)。以长度为316 bp的EST为核心片段,扩增长度分别为352和575 bp的3′和5′ cDNA末端,序列拼接后获得了长度为1 037 bp的cDNA序列,命名为Hg-exp-2(GenBank登录号:HM798586)。根据两个基因的拼接序列,设计基因特异性引物,以H.glycines的cDNA为模板进行PCR扩增,获得长度分别为900和961 bp的片段(图1-A、1-B),比对分析发现,其与拼接序列完全一致。采用Hg-exp-1和Hg-exp-2的全长引物,以大豆孢囊线虫2龄幼虫基因组DNA为模板,分别扩增出全长为2 108和2 927 bp的片段(图1-C、1-D),分析发现Hg-exp-1和Hg-exp-2基因组DNA均包含6个大小不等的内含子,Hg-exp-1最大的内含子为 791 bp,最小的为 63 bp,Hg-exp-1最大的内含子为524 bp,最小的为150 bp,所有内含子均符合GT-AG的剪接规则,6个内含子将Hg-exp-1分割为7个外显子(图1-E)。
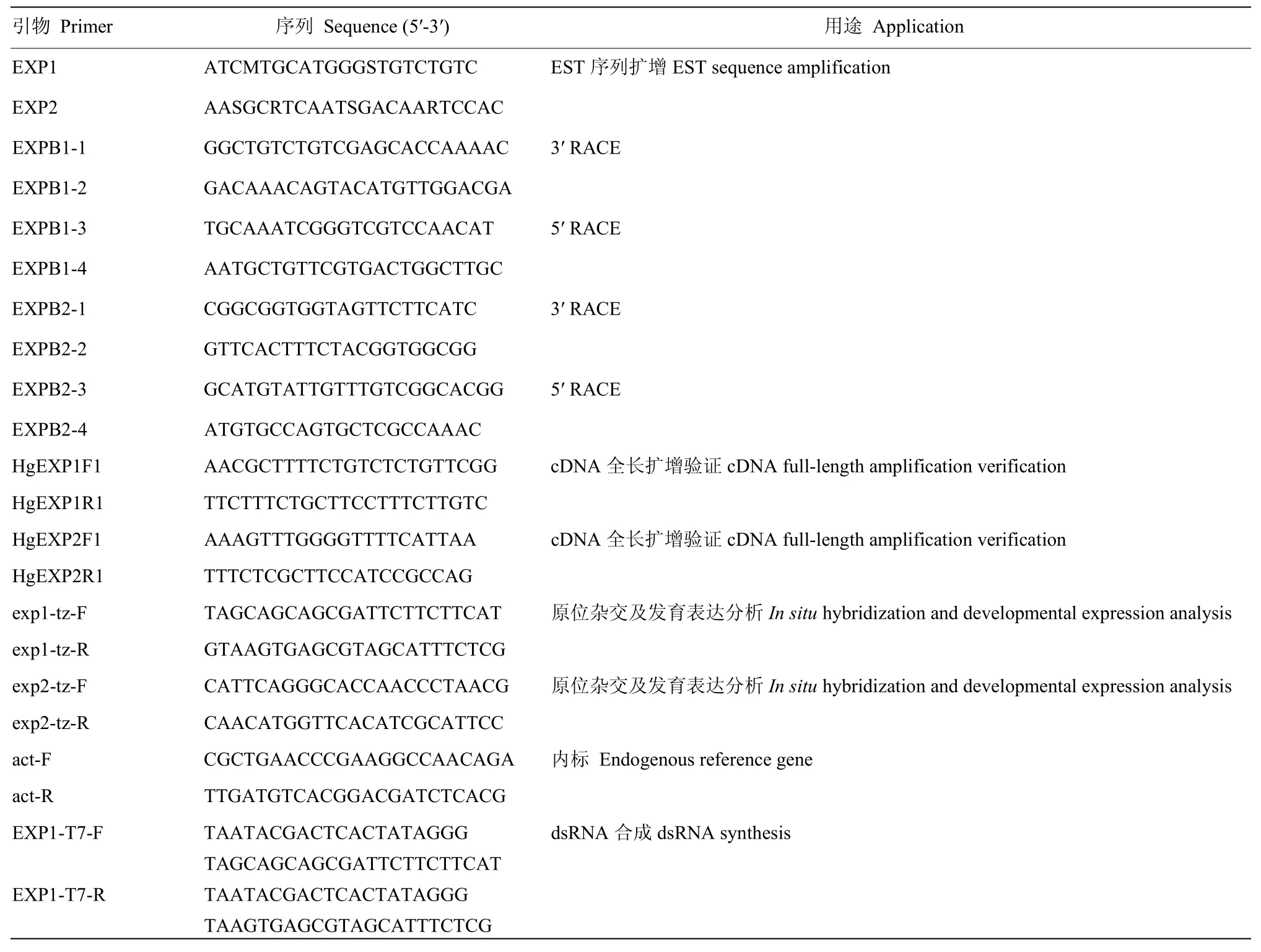
表1 PCR引物序列Table 1 The PCR primer sequences
2.2 Hg-exp-1和Hg-exp-2序列分析
Hg-exp-1cDNA全长为1 047 bp,包含一个长度为867 bp 开放阅读框(ORF),5′端和3′端非编码区分别为38和142 bp,编码一个长度为288个氨基酸残基的多肽,HG-EXP-1的预测分子量为27.401 kD,等电点为 8.54,含有一个N-糖基化位点为 Asn273。Hg-exp-2cDNA全长为1 037 bp,其5′端非编码区为97 bp,3′端非编码区为48 bp,开放阅读框的长度为888 bp。推测编码的蛋白质HG-EXP-2含有295个氨基酸,预测分子量为28.010 kD,等电点为7.68。信号肽和跨膜结构域分析发现,HG-EXP-1和 HG-EXP-2分别包含一个长度为23和22个氨基酸残基的信号肽,均无跨膜结构域,表明其为分泌型蛋白。
预测蛋白序列比对发现,HG-EXP-1(ADL29728)和HG-EXP-2(ADY02960)之间的相似性为80%。多个植物线虫 EXP蛋白比对发现,植物线虫扩展蛋白DPBB结构域中存在着3个在植物EXP蛋白中保守的半胱氨酸和1个HFD位点(图2)。Blast比对分析发现,大豆孢囊线虫HG-EXP-1序列与马铃薯金线虫的GR-EXPB1(CAC83611)和GR-EXPB2(CAC84564)、非洲茎线虫的DA-EXPB1(ADJ57307)、松材线虫的BX-EXPB1(BAG16537)、拟松材线虫的BM-EXPB1(BAG16534)和细胞性黏菌(Polysphondylium pallidum)的 PP-EXPB1(EFA74732)氨基酸序列相似性为22%—79%,与马铃薯金线虫GR-EXPB1的相似性为66%,与松材线虫和拟松材线虫的expansin-like蛋白的相似性分别为23%和22%,与马铃薯腐烂茎线虫和禾谷孢囊线虫的一致性分别为44%和71%。将已报道的植物寄生线虫扩展蛋白序列和部分其他物种相似性较高的序列采用MEGA软件的ML方法构建系统发育树(图 3),结果表明大豆孢囊线虫 HG-EXP-1和HG-EXP-2与禾谷孢囊线虫HA-EXP-1和4个马铃薯孢囊线扩展蛋白(GR-EXP-1、GR-EXPB-1、GP-EXP-1和 GP-EXPB-1)聚为一分支,3个根结线虫扩展蛋白(MH-EXP和MI-EXP)聚为一分支,马铃薯腐烂茎线虫DD-EXP-1、DD-EXP-2与非洲茎线虫Da-EXP-1聚为一分支,以上3支聚在一更大的分支,松材线虫和拟松材线虫的扩展蛋白(BX-EXP Like-1/2/3和BM-EXP-Like-1/2)聚为一支,爪哇根结线虫MJ-EXPB-1单独聚为一支。植物线虫和细菌与真菌的扩展蛋白聚在一个大的分支中。
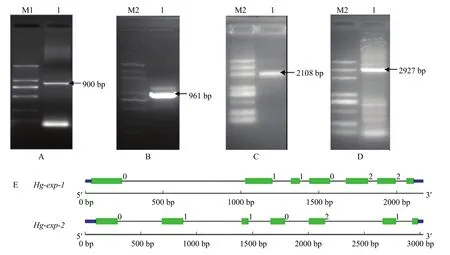
图1 PCR扩增基因cDNA全长(A、B)、基因组全长(C、D)电泳结果及Hg-exp-1、Hg-exp-2内含子、外显子分布示意图(E)Fig. 1 Agarose gel electrophoresis of PCR products, full length sequence of cDNA (A, B) and genomic DNA (C, D). Intron and exon distribution of Hg-exp-1 and Hg-exp-2 (E)
2.3 Southern杂交
以EcoRⅤ和HindⅢ两种限制性内切酶酶切大豆孢囊线虫基因组DNA,经过转膜、杂交和显色后,结果显示,EcoRⅤ和HindⅢ限制性内切酶酶切的基因组DNA和地高辛标记的Hg-exp-1的探针杂交均出现5—6个杂交信号(图4),表明Hg-exp-1存在于大豆孢囊基因组中,为多拷贝或多基因家族。
2.4 原位杂交
以地高辛标记标记杂交探针,原位杂交结果表明,两个基因的负链探针在大豆孢囊线虫2龄幼虫的亚腹食道腺细胞中具有明显的杂交信号,地高辛正链探针杂交均没有观察到杂交信号(图 5),表明 expansin基因在大豆孢囊线虫2龄幼虫的亚腹食道腺细胞转录表达。同时还发现,两个基因的杂交信号没有明显的差异。
2.5 Hg-exp-1和Hg-exp-2发育表达分析
半定量 PCR检测结果表明,大豆孢囊线虫Hg-exp-1和Hg-exp-2主要在线虫的寄生前和寄生后2龄幼虫中表达,在寄生期3龄幼虫表达量降低,在4龄幼虫、卵和雌虫中不表达(图6)生时间的不断延长逐渐降低。

图2 大豆孢囊线虫细胞扩展蛋白(HG-EXP-1、HG-EXP-2)与其他线虫细胞扩展蛋白的氨基酸序列比对Fig. 2 Alignment of amino acid sequences of H. glycines expansin proteins (HG-EXP-1, HG-EXP-2) with other expansin proteins
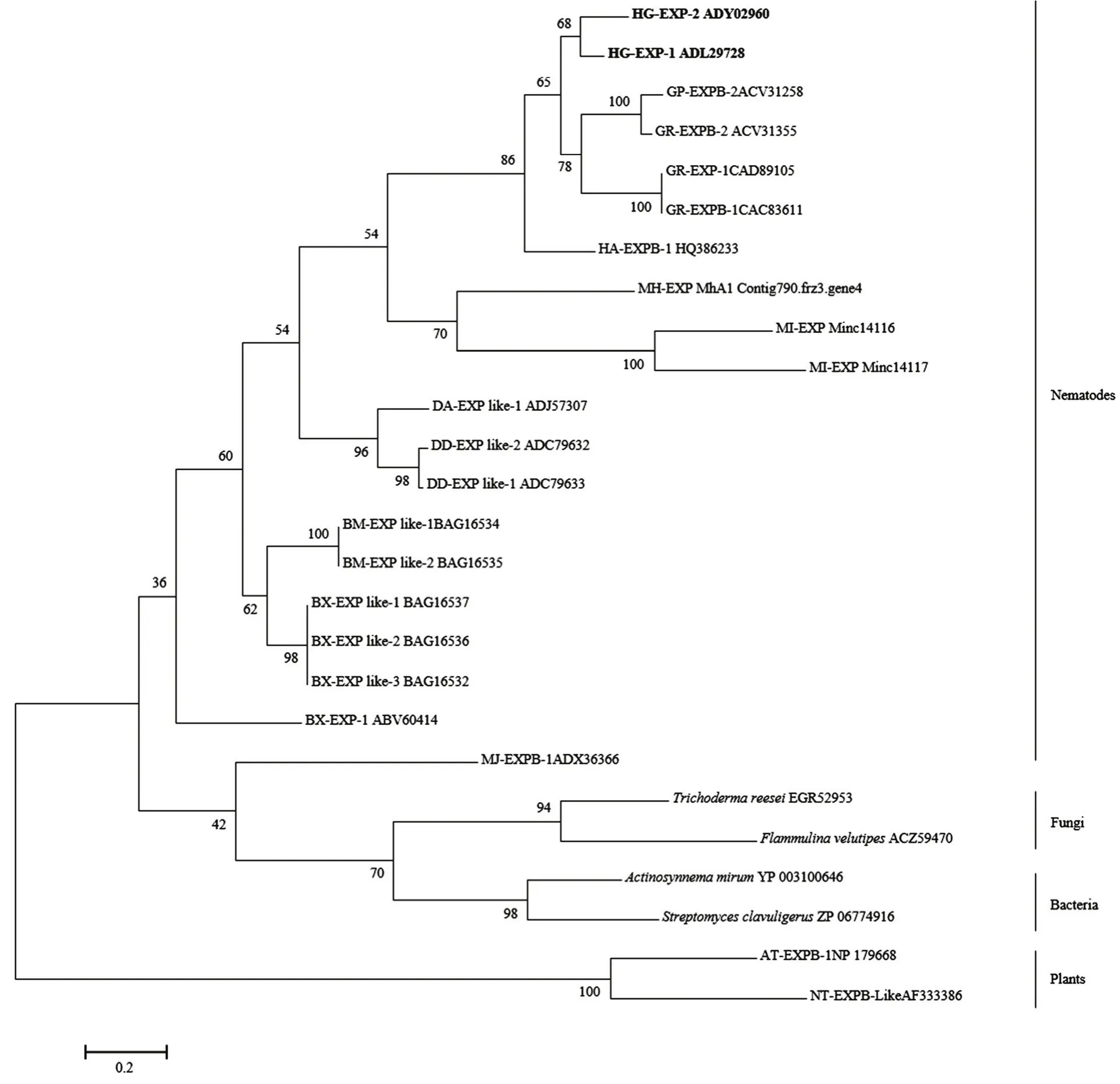
图3 基于最大似然法(ML)构建的扩展蛋白进化树Fig. 3 Unrooted phylogenetic tree of expansin proteins constructed by maximum likelihood analysis
2.6 大豆孢囊线虫expansin基因RNA干扰功能
dsRNA 浸泡4、8、12、16和20 h后,采用半定量PCR进行Hg-exp-1转录水平检测。结果表明,在去除dsRNA 12 h内,基因的表达量下降不明显,在16 h后Hg-exp-1转录水平大幅度下调,到 20 h后Hg-exp-1转录水平达到最低。在Actin对照中,不同处理的基因转录无明显变化(图 7)。表明优化的浸泡体系成功诱导Hg-exp-1基因沉默。
经过Hg-exp-1dsRNA处理的大豆孢囊线虫10 d后寄生到植物根部的数目比 GFP-dsRNA对照和清水对照的线虫数目下降 38.3%(图 8-A—D),35 d后Hg-exp-1dsRNA处理的大豆孢囊线虫新形成的雌虫数下降43.4%(图8-E)。
3 讨论
植物寄生线虫侵染植株首先要透过细胞壁形成取食结构,无论是植物寄生线虫本身分泌还是诱导植物合成,expansin在线虫的整个侵染过程中都起到了关键作用,本研究从大豆孢囊线虫中分离鉴定出两个扩展蛋白的基因,并对其基因结构、表达部位、拷贝数和基因功能等进行了系统研究,明确了其在大豆孢囊线虫侵染早期起着关键作用。
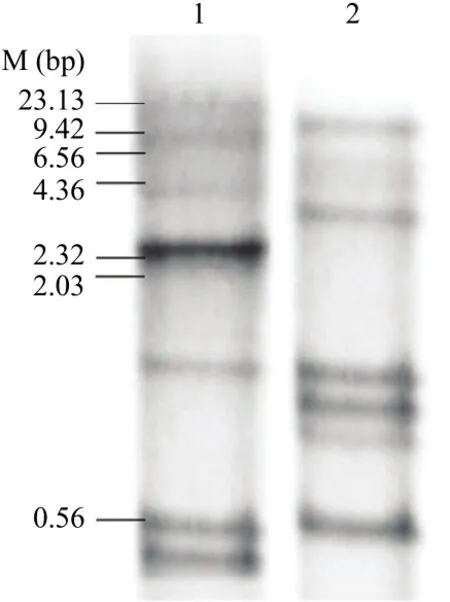
图4 Southern杂交结果Fig. 4 The Southern blot result of expansin from H. glycines

图5 大豆孢囊线虫expansin 基因的组织定位Fig. 5 Tissue localization of expansin mRNA using in situ hybridization
HG-EXP-1和HG-EXP-2的氨基酸序列与马铃薯金线虫GR-EXPB1的同源性最高,推测其可能具有与GR-EXPB1相似的功能,即破坏植物细胞壁的共价键,松驰细胞壁,从而利于线虫侵入[5]。序列比对结果表明,DPBB结构域比较保守,具有多个植物扩展蛋白中保守存在的半胱氨酸和一个 HFD位点[23],其中 3个半胱氨酸位点和植物扩展蛋白保守,2个在植物线虫中保守,在植物线虫中HFD主要表现为HVD。Blast结果表明Hg-exp-1和Hg-exp-2的氨基酸序列与植物寄生线虫expansin序列相似性较高,最高达71%以上,而与植物来源的expansin蛋白相似度极低,证明其可能与植物expansin起源不同。
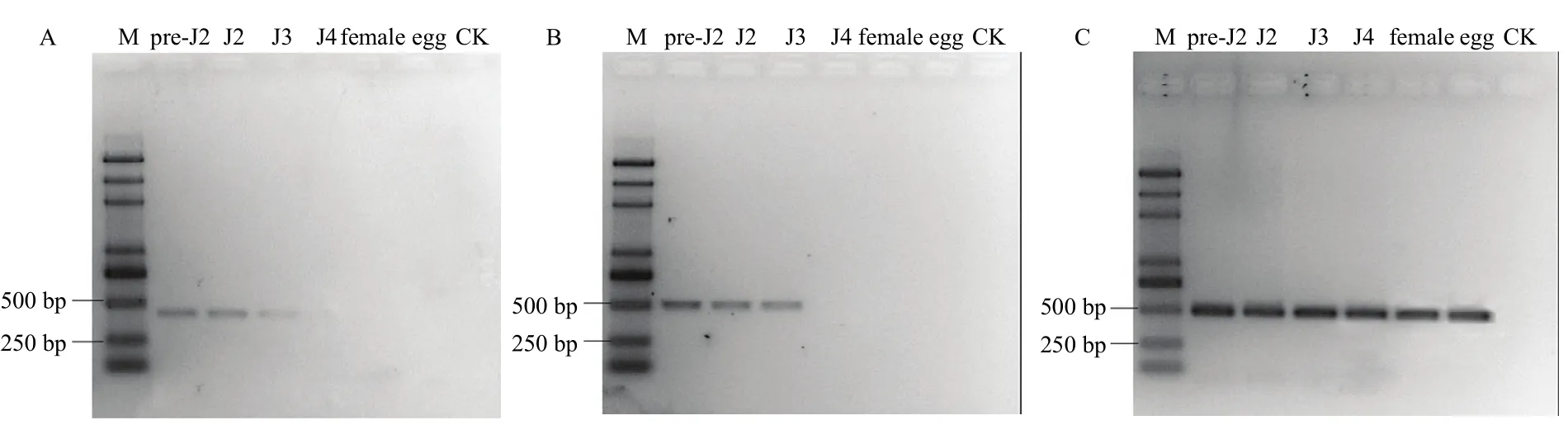
图6 大豆孢囊线虫expansin基因发育表达分析Fig. 6 Expression of expansin genes in developing stages of H. glycines
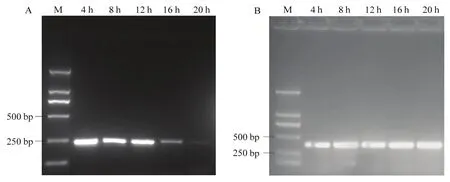
图7 RNA干扰后Hg-exp-1的转录水平Fig. 7 The expression level of Hg-exp-1 by vitro RNAi
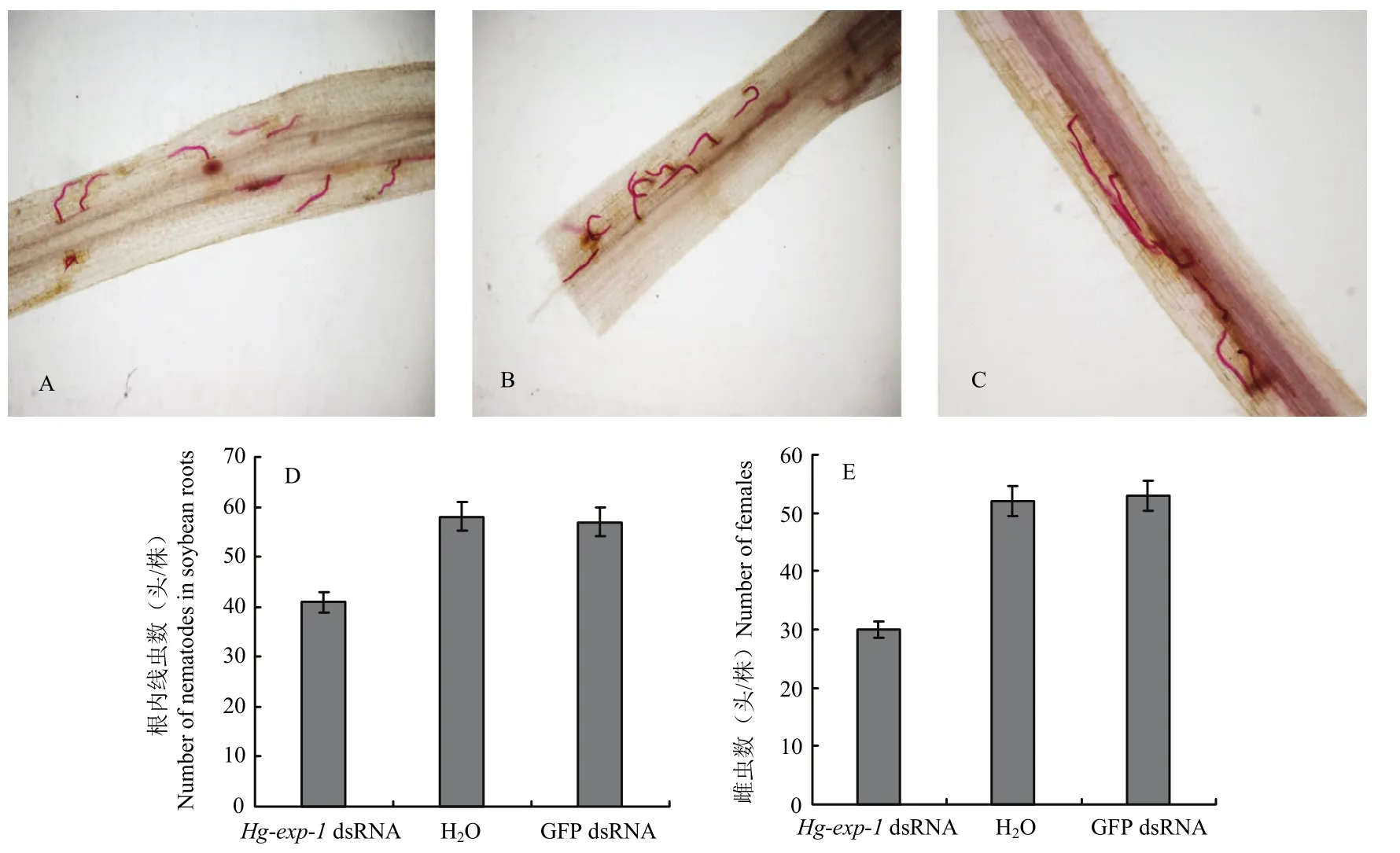
图8 Hg-exp-1 dsRNA浸泡处理后的大豆孢囊线虫侵染大豆的染色结果和侵染率检测Fig. 8 Infection of in soybean roots with nematode following Hg-exp-1 dsRNA treatment and the number of nematodes in soybean roots
聚类分析结果表明,植物线虫聚为一个大的分支,其中大豆孢囊线虫expansin蛋白与其他孢囊线虫聚为一支,根结线虫聚为一支,松材线虫和拟松材线虫聚为一支。同时多个细菌和真菌的expansin蛋白也与植物线虫的expansin蛋白聚在一个更大的分支中。植物中的EXP单独聚为一个分支。细菌中也存在着相似的蛋白,这些基因都存在内含子和PolyA尾,表明这些基因编码的蛋白可能是通过基因水平漂移(genehorizantol transfer,GHT)从细菌获得的。对非洲茎线虫和马铃薯腐烂茎线虫的研究也表明在植物寄生线虫expansin基因聚在一个单独的大分支中,与真菌、细菌与植物分开,且植物寄生线虫expansin基因中存在相同的内含子,位于相同的位置,由此推测植物寄生线虫中的expansin基因可能有相同的起源[8],据此笔者推测,包括大豆孢囊线虫在内的植物线虫的扩展蛋白基因可能来源于植物线虫水平基因转移。
发育表达分析结果表明,大豆孢囊线虫两个expansin基因主要在线虫的寄生前和寄生后2龄幼虫中大量表达,在寄生期3龄幼虫中表达量降低,在4龄幼虫、卵和雌虫中不表达。总体趋势是随着寄生时间的不断延长表达量逐渐降低,在禾谷孢囊线虫研究中发现,ha-expb1和ha-expb2在侵染后2龄表达量最高[24-25]。孢囊线虫在侵染过程中,2龄幼虫必须通过口针的机械压力和口针分泌物的共同作用,降解植物细胞壁,建立取食位点,才能开始侵染循环。在植物线虫口针分泌物中,目前已经发现了一系列对细胞壁具有降解和修饰活性的效应蛋白,包括纤维素酶、半纤维素酶、果胶酶、扩展蛋白等。这些酶类的表达均在侵染前2龄幼虫和侵染后2龄幼虫最高[26-27]。一旦寄生关系建立,固着性内寄生线虫将从固定取食细胞获得营养,不需要再次穿刺植物细胞壁,因此表达量逐渐降低。
原位杂交结果表明,Hg-exp-1和Hg-exp-2在大豆孢囊线虫的亚腹食道腺中大量表达,其结果和其他植物线虫的expansin基因原位杂交结果一致[5-6,28]。序列分析发现,Hg-exp-1和Hg-exp-2编码的氨基酸序列5′端均含有一个分泌信号肽,推测该类基因编码的蛋白是由线虫食道腺细胞分泌,通过线虫口针的穿刺随口针分泌物进入植物组织。该结果进一步证明了亚腹食道腺的分泌物主要在线虫侵染植物降解植物细胞壁和建立取食位点过程中起作用的观点[29-30]。
Southern杂交结果表明,大豆孢囊线虫Hg-exp-1存在其基因组中且以多拷贝或多基因家族存在,在其他植物线虫中均发现了扩展蛋白基因属于多基因家族,同时基因组测序发现,南方根结线虫、北方根结线虫、马铃薯孢囊线虫、松材线虫等植物寄生线虫基因组中分别发现了20、6、7、8个expansin基因[11-15]。
RNA干扰功能研究发现,大豆孢囊线虫Hg-exp-1dsRNA处理16 h后,转录水平均大幅下调,在20 h后,基因转录水平降至最低,说明dsRNA成功导入大豆孢囊线虫体内,介导了对应靶基因的沉默。Hg-exp-1干扰后,线虫的入侵率和雌虫数分别下降 38.3%和43.4%,说明Hg-exp-1在大豆孢囊线虫侵染过程中起关键作用。与禾谷孢囊线虫扩展蛋白基因HaEXPB2和细胞壁修饰基因Ha-eng-2相似,RNA干扰后线虫的入侵率都显著减少,而对入侵后线虫产生孢囊没有明显影响[9],对大豆孢囊线虫其他细胞壁修饰酶的研究发现,对大豆孢囊线虫的果胶裂解酶基因Hg-pel-6进行 RNA干扰同样减少其对寄主的侵染率[26],因此Hg-exp-1的功能可能是在早期通过修饰细胞壁来促进线虫的侵染。LIU等的研究证明,禾谷孢囊线虫和马铃薯金线虫的扩展蛋白基因HaEXPB2和GrEXPB2均能诱导激活寄主植物的防御反应[9-10],而 HG-EXP-1在作用于植物细胞壁时是否会被寄主感知并进一步激活寄主的防御反应,以及其如何修饰寄主细胞壁来促进侵染仍有待进一步研究。
4 结论
从大豆孢囊线虫2龄幼虫中成功鉴定出两个长度分别为1 047和1 037 bp的扩展蛋白基因Hg-exp-1和Hg-exp-2。Hg-exp-1体外 RNA干扰后,根内线虫 2龄幼虫数和雌虫数分别下降 38.3%和 43.4%,由此确认其在大豆孢囊线虫寄生早期过程中起重要作用。
