环境因子对腐烂病菌在苹果枝条木质部内生长扩展的影响
2018-09-11王晓焕潘彤彤练森王彩霞李保华
王晓焕,潘彤彤,练森,王彩霞,李保华
(青岛农业大学植物医学学院/山东省植物病虫害综合防控重点实验室,山东青岛 266109)
0 引言
【研究意义】苹果树腐烂病是由苹果黑腐皮壳(Valsa mali)引起的枝干病害[1-2],主要造成死枝、死树,甚至毁园,严重影响苹果产业的发展[1,3]。腐烂病菌在苹果枝条木质部内的存活与生长扩展,是导致旧病斑复发和剪锯口发病的重要原因[4-5]。揭示苹果树腐烂病菌在木质部内的生长扩展机制、影响因素和周年扩展动态,可深入了解苹果腐烂病的发生流行规律,为病害的流行预测和防控提供依据。【前人研究进展】自1916年辽宁省南部发现苹果腐烂病[6],至今已有4次大的流行[7],每次流行都造成大批苹果树死亡,大批果园毁坏,给苹果生产造成重大损失[1]。腐烂病是苹果树的重要病害,在中国各苹果产区果园内都有分布,而且还有严重危害的趋势。据2008年调查,苹果主产区腐烂病的总体病株率为 52.7%,部分地区发病率高达85%以上[8]。自20世纪初,日本和中国对苹果树腐烂病菌的病原学、发生流行规律、 防治技术等方面开展了大量研究,提出了多种防控措施[8-16]。近年来,又从分子和生理生化层面对病菌的致病机制[17-22]开展了大量研究,但腐烂病仍未得到有效控制。剪锯口是腐烂病菌的重要侵染孔口[2],旧病斑复发是造成腐烂病连年发病的重要原因[4,14]。2011年春季对烟台苹果产区的调查发现,80%的新发病斑来自剪锯口的侵染,60%新发病斑为旧病斑复发后的病斑[2]。组织学研究结果已证明,腐烂病菌能从剪锯口侵染苹果枝干木质部,在木质部导管内生长扩展,并长期潜伏[5],在枝干木质部内潜伏的腐烂病菌,在适宜条件下生长扩展到达皮层的活体细胞后,产生毒素和木聚糖酶、纤维素酶、果胶酶等细胞壁降解酶,杀死皮层组织,引发腐烂病[2,23-29]。腐烂病菌在苹果枝干木质部内的生长扩展,也是导致旧病斑复发的重要原因[4,16]。【本研究切入点】腐烂病菌在木质部内的生长扩展是影响腐烂病发生与流行的重要环节。木质部内的腐烂病菌生长速度快,扩展距离长,到达皮层的数量多,复发病斑数量多,剪锯口发病重;相反,木质部腐烂病菌的生长速度慢,腐烂病发病就轻[2]。目前,对于腐烂病菌在木质部的生长扩展及其影响因素了解很少。为了更深入地了解腐烂病的发生与流行机制,本研究采用菌饼接种剪锯口的方法,测试温度、枝条龄期、枝条含水量等对腐烂病菌在木质部生长扩展的影响。【拟解决的关键问题】通过接种后观测病菌在木质部的生长扩展情况,明确腐烂病菌在木质部的生长扩展机制及影响因素,深入了解苹果腐烂病的发生流行规律,为病害的有效防控提供参考依据。
1 材料与方法
1.1 腐烂病菌来源及处理
2010年自山东莱阳一个苹果园内采集腐烂病枝,经75%的酒精消毒后,切取病健交界处的皮层组织,转入马铃薯葡萄糖琼脂培养基(PDA)中,用直径0.8 mm的毛细管自菌落边缘挑取单菌丝,纯化病菌。分离菌株在-18℃的冰箱内保存。试验前,将腐烂病菌在PDA培养基中活化,在25℃继代培养3 d,用直径为0.5 cm的打孔器打取菌落外缘的菌饼,备用。
1.2 木质部内病菌扩展距离的检测
腐烂病菌在木质部内的扩展距离采用活体皮层检测法。8—9月份苹果树生长旺盛期,剪取直径 0.8—1.5 cm健康的苹果枝条,保存于1—5℃的冷藏箱内。使用前,将枝条剪成2 cm长的茎段,从茎段一侧割口后,剥取完整的皮层,作为检测皮层。
将待检测枝段剥除皮层,露出木质部,从接种端开始,顺序剪下7个茎段,每段长度1 cm,并顺序标号。将剪取茎段在75%的酒精中浸泡30 s,待表面的酒精挥发后,检测枝干木质部内是否潜带有腐烂病菌(具体检测方法请查阅国家知识产权网,专利申请号2015106262642)。
1.3 温度对腐烂病菌在苹果枝条木质部内生长扩展的影响
测试8个温度(0、5、10、15、20、25、30和35℃)对腐烂病菌在苹果枝条木质部内生长的影响,每个温度接种 5根枝条。温度由 8台恒温箱控制(MGC-250BP-2,上海一恒)。2015年苹果树落叶后,自3—5年生的富士果树上,剪取基部直径0.8—1.2 cm当年生的长枝条,截除梢部的20 cm,将余下枝段截成15 cm长的枝段,随机选取5根作为一组,平放于8个保湿缸内。每个保湿缸中加入300 mL蒸馏水,用于保持 100%的相对湿度。保湿缸密封后,转入相应的恒温箱中预处理12 h。接种时,从保湿缸中取出枝段,将菌饼放置在枝段的顶端,菌丝面紧贴剪口,用保鲜膜包扎后,再放回到保湿缸内,转入相应的恒温箱中保湿培养。72 h后取出接种枝段,测量腐烂病斑长度,检测腐烂病菌在木质部内的扩展距离。
1.4 枝条相对含水量对腐烂病菌在苹果枝条木质部内生长扩展的影响
苹果树落叶后,自3—5年生的富士果树上剪取当年生苹果枝条,截除梢部的20 cm,将余下枝段截成15 cm长的枝段。选取30个粗度一致的枝条,完全浸泡于蒸馏水中,使其充分吸水,24 h后全部取出,晾干表面的水分,用天平(1/1 000 g)称取每个枝段的质量,并记录。将浸水枝段分成6组,每组5根,分别在室内自然条件下放置0、3、6、12、24和48 h,使枝条自然失水,然后再逐一称重,计算每个枝段的相对含水量。相对含水量=100%×[1-(失水前的质量-失水后的质量)/失水前的质量]。称重后,将所有枝条,在50℃融化的石蜡中浸蘸1 min,将枝段包被蜡衣,防止水分散失。接种时,用消毒果枝剪剪除顶端 0.5 cm,再接种腐烂病菌。接种枝条在 25℃下保湿培养72 h后,测量病斑长度,检测病菌在枝条木质部内的扩展距离。同时,接种未浸泡处理新鲜枝条和浸泡处理未经晾干处理的枝条各5根,25℃下保湿培养7 d,测量木质部内病菌扩展距离。
1.5 枝条龄期对枝条木质部内腐烂病菌生长扩展的影响
苹果树落叶后,自5年生的富士苹果树上随机剪取当年生、1年生、2—3年生的苹果枝条。当年生和1年生枝条基部直径约1 cm,2—3年生枝条直径约2 cm。当年生枝条截除梢部的20 cm,将所有枝条截成15 cm长的枝段,每个龄期10段。枝段顶端接种腐烂病菌,在25℃下保湿培养72 h后,检测病菌在木质部的生长扩展距离。
1.6 腐烂病菌在活体、离体和高温处理枝条木质部内的生长扩展
3—4月份苹果顶芽开始膨大后,选择3—5年生的富士苹果树 5株,每株树上随机选取基部直径 0.8—1.0 cm的1年生枝条3枝,在离基部15 cm处剪断枝条,在剪口处立即接种腐烂病菌,接种后用保鲜膜包扎。同时,从所剪除枝条的基部再剪取15 cm的枝段,接种腐烂病菌,同一株树上的3个枝条一组,插入口径5.5 cm组培瓶中,放置相应的树下,加入60 mL蒸馏水水培。培养期间温度在10—20℃。7 d后测量病斑长度,检测病菌在木质部的扩展距离。11—12月苹果落叶后,将盆栽苹果树移入玻璃温室内,重复同样试验。
为了验证苹果枝条对腐烂病菌在木质部内生长扩展是否存在抗性,12月苹果树休眠期,从一年生苹果枝条上剪取15 cm的枝段20个,随机分为两组,其中一组在121℃下高温处理20 min后接种,另一组直接接种腐烂病菌。接种后25℃下保湿培养7 d,检测木质部内病菌扩展距离。
1.7 腐烂病菌在苹果枝干不同组织配制培养基内的生长扩展
为了解腐烂病菌在木质部生长扩展所需要的营养成分,7—9月份剪取一年生的苹果枝条,将木质部与韧皮部剥离,置于65℃的烘箱内烘干24 h。将烘干的木质部和韧皮部用高速万能粉碎机粉碎成粉末状。称取10 g韧皮部粉末,2 g琼脂粉,加入100 mL蒸馏水,制成固体韧皮部培养基(EPH),不加琼脂粉制成液体EPH,121℃灭菌20 min。称取10 g木质部粉末,按同样方法制成固体、液体木质部培养基(EXY)。
称取10 g韧皮部粉末,加水煮沸20 min,10 000 r/min离心5 min,将上清液和残渣分离后,分别定容至100 mL,再加入2 g琼脂粉,分别制成韧皮部上清液培养基(SPH)和韧皮部残渣培养基(RPH);不加琼脂粉制成液体培养基SPH和RPH,121℃灭菌20 min。称取10 g木质部粉末,按同样的方法制成固体、液体木质部上清液培养基(SXY)和固体、液体木质部残渣培养基(RXY)。
称取10 g木质部粉末,放入烧杯中,加入5%的浓硫酸50 mL,在100℃水中水浴20 min,静置1 min后,滤除硫酸溶液,残渣加入50 mL蒸馏水,100℃水浴20 min,滤除水;用同样方法将残渣反复冲洗直至pH为7.0,定容至100 mL,加入2 g琼脂,121℃灭菌20 min,制成酸处理木质部残渣培养基(AXY)。称取10 g木质部材料,放入烧杯中,加5%的氢氧化钠50 mL,按同样的方法,制成碱处理木质部残查培养基(BXY)。
将每种固体培养基倒3个平板,在平板中央接一个腐烂病菌的菌饼,25℃下培养72 h后,采用十字交叉法测量菌落直径。以标准的马铃薯葡萄糖琼脂培养基(PDA)和2%琼脂培养基(WAG)为对照,比较腐烂病菌在不同组分培养基上的菌落直径。
1.8 腐烂病菌在富士枝条上生长扩展的周年动态
自2015年10月15日开始,每半月1次,于青岛农业大学实验基地选取3—5年生的富士苹果树,在每株树上随机选取基部直径0.8—1.0 cm的枝条1—2枝,每次共接种5个枝条,在离基部15 cm处剪断枝条,在剪口处立即接种腐烂病菌的菌饼,使菌丝紧贴剪口,接种后用保鲜膜包扎,室外自然条件培养。同时,从剪除枝条的基部再剪取15 cm的枝段,接种腐烂病菌,5个枝段为一组,插入口径5.5 cm组培瓶中,加入60 mL蒸馏水,转入25℃的恒温箱中培养。接种7 d后,测量病斑长度,剥去皮层测量木质部内变色组织长度,检测腐烂病菌在木质部的扩展距离。全部试验至2017年8月30日结束,共接种45批次,225个活体枝条和相对应的225个离体枝条。
1.9 数据分析
以每个木质部内病菌扩展距离、病斑长度和菌落直径的观测值为基本数据单元,用ANOVA分析温度、枝条相对含水量、不同枝条组织和枝条龄期对腐烂病菌在木质部内和皮层内生长扩展的影响,比较病菌在木质部和皮层生长扩展的差异。用T测验比较腐烂病菌在离体枝条与活体枝条,高温处理枝条和未经高温处理枝条内的扩展距离。ANOVA用广义线模型(GLM)实现,在GLM模型中所有观测值假设为正态分布,调用Gaussian函数。不同处理间的差异显著性用Tukey多重比较(用glht完成)广义线性模型的预测值实现。
用温度模型f(t)=A·[(M-t)/(M-O)]·{(t/O)^[O/(M-O)]}拟合温度与病斑长度及腐烂病菌在木质部内的扩展距离的关系。其中,t为温度(℃),f(t)为病斑长度或木质部内菌丝的扩展距离,M、O和A为拟合参数,M为病菌生长扩展温度上限(℃),O为最适生长温度(℃),A为最大病斑长度或木质部内病菌最大扩展距离(cm)。
用指数模型f(w)=A·exp{-B[(100-w)/100]}拟合枝条相对含水量与腐烂病斑长度的关系。其中,w为枝条相对含水量(%),f(w)为病斑长度(cm),B和A为拟合参数,B为指数增长速率,A为最大病斑长度(cm)。用直线模型拟合枝条失水时间与相对含水量之间的关系。
所有数据分析用R语言完成,在Var. 3.4.0实现。
2 结果
2.1 温度对腐烂病菌在枝条木质部内生长扩展的影响
接种腐烂病菌的枝条,在 5—35℃的范围内培养72 h后,木质部内都能检测到病菌。在0℃下培养的枝条,距接种点 1 cm的木质部内没有检测到腐烂病菌。在8个测试温度120个接种枝段中,腐烂病菌在木质部内的平均扩展距离为0.66 cm,最大为3 cm,腐烂病斑平均长度为0.45 cm,最长为2.5 cm。腐烂病菌在木质部内的扩展距离显著长于在皮层形成病斑的长度(P<0.01)。
接种到富士苹果离体枝条剪口上的腐烂病菌在30℃扩展最快,培养72 h后,病菌在木质部内的扩展距离为1.4 cm,病斑长度为0.95 cm,其次是25℃和35℃。0℃下病菌扩展最慢,病斑长度只有0.23 cm,木质部内菌丝扩展距离没有达到1 cm(图1)。腐烂病菌在苹果离体枝条上形成的病斑长度和在木质部内生长距离随温度的变化可用温度模型描述(表 1、图1)。模型可描述病斑长度总变异度的 99.10%,木质部内病菌扩展距离的99.92%。依据模型,腐烂病斑扩展的最适温度为29.6℃,最高38.6℃,培养72 h病斑最大长度为0.86 cm;木质部内腐烂病菌最适扩展温度为30.1℃,最高为42.2℃,病菌的最大扩展距离为1.29 cm(表1、图1)。
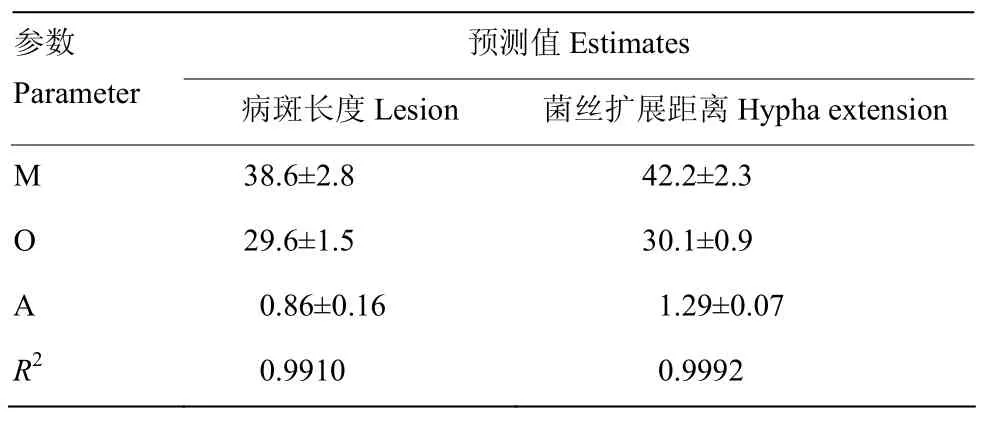
表1 拟合腐烂病菌在离体枝条上生长扩展温度模型的参数估测值Table 1 Parameter estimates of the temperature model fitted the growth and extension of V. mali in the detached branches
2.2 枝条相对含水量对腐烂病菌在枝条木质部内生长扩展的影响
苹果枝条在蒸馏水中浸泡24 h后,再接种腐烂病菌,在25℃下培养7 d后,病菌在木质部内扩展距离平均为3.20 cm,显著(P<0.05)短于在未浸水枝条木质部内的扩展距离4.03 cm(图2)。
经蒸馏水浸泡的枝条,随在室内失水时间的延长,枝条相对含水量呈直线下降。48 h后,枝条相对含水量降至 86.38%。失水时间与枝条相对含水量的关系可用直线模型Y=99.32-0.2806X描述(图3-A),
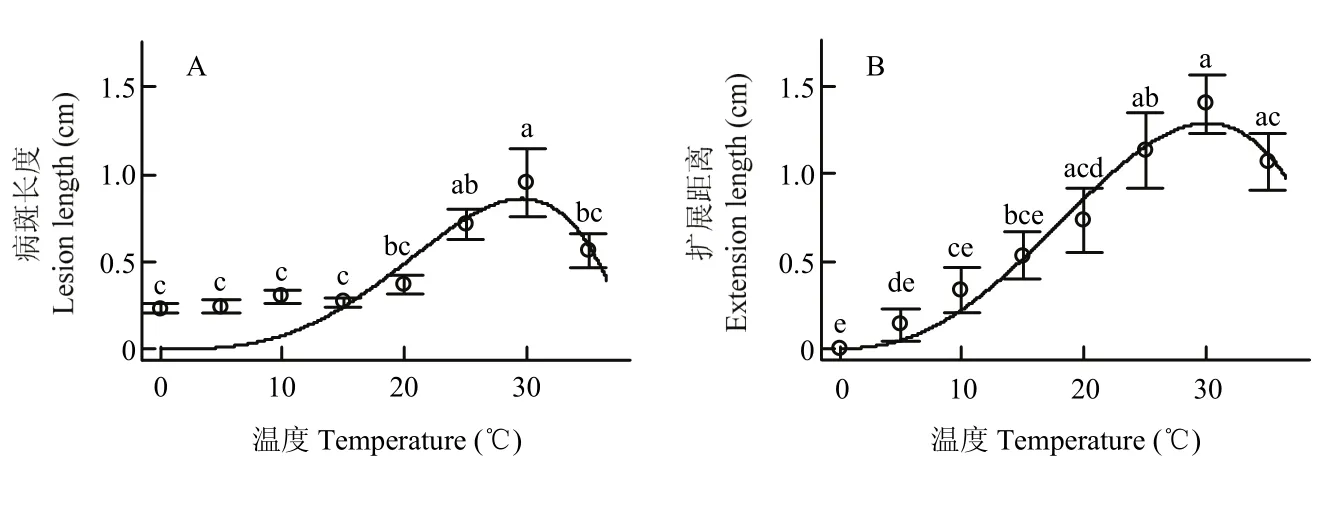
图1 接种到富士苹果离体枝条上的腐烂病菌在不同温度下培养72 h后形成的病斑长度(A)和在木质部内的扩展距离(B)Fig. 1 The length of lesions (A) and the extension distances in the xylem (B) of V. mali when inoculated to the detached Fuji apple branches and cultured at different temperatures for 72 hours
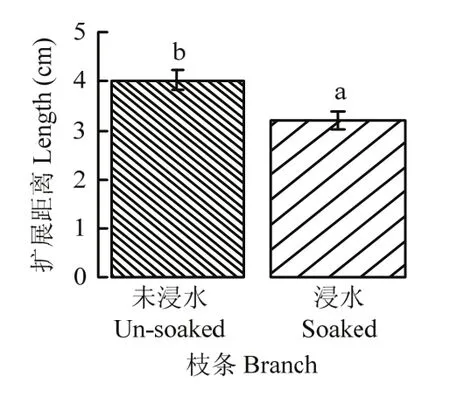
图2 腐烂病菌在浸水和未浸水枝条木质部内25℃下培养7 d的扩展距离Fig. 2 The extension distances of V. mali in the xylem when the pathogen inoculated to the soaked and un-soaked apple branches in distill water and cultured at 25℃ for 7 days
其中X为失水时间(h),Y为相对含水量(%)。
当枝条相对含水量大于90%时,枝条木质部内的病菌生长扩展速度快,平均每天达1 cm以上,枝条相对含水量对木质部内病菌生长扩展无显著影响(P>0.05)。当枝条的相对含水量降至 90%以下时,病菌的扩展速度明显减缓,病菌扩展速度显著慢于枝条含水量大于90%时的病菌扩展速度(P<0.05)(图3-B)。
随枝条相对含水量的降低,病菌在皮层内扩展速度减缓,所形成腐烂病斑长度变小。枝条的相对含水量对腐烂病菌在皮层内生长扩展形成的病斑长度的影响可用指数模型Y=1.46exp(-12.47(100-X)/100)描述(图3-C)。其中,X为枝条相对含水量(%),Y为病斑长度(cm),模型可以描述 90个观测值总变异度的24.44%。依据该模型,病斑的最大扩展长度为A=1.46 cm(图3-C)。
2.3 枝条龄期对腐烂病菌在枝条木质部内生长扩展的影响
接种到当年生、1年生和2—3年生枝条木质部的腐烂病菌,25℃下恒温培养72 h后,木质部内病菌的扩展距离分别为3.10、2.57和2.40 cm,病菌在2—3年生枝条木质部的生长扩展速度显著慢于在当年生枝条木质部的生长扩展速度(P<0.05)(图4)。
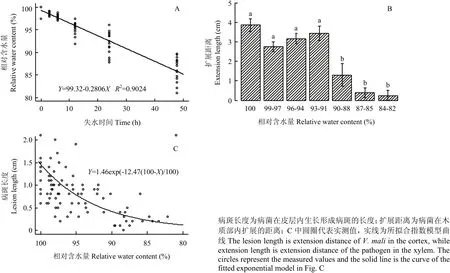
图3 浸水24 h的苹果枝条失水不同时间后的相对含水量(A)及接种到枝条上的腐烂病菌经25℃下培养72 h后在木质部内和皮层内的扩展距离(B、C)Fig. 3 The relative water content of apple branches when the branches placed indoor for different times after soaking in distill water for 24 hours (A), and the extension distances of V. mali in the xylem and cortex (B, C)
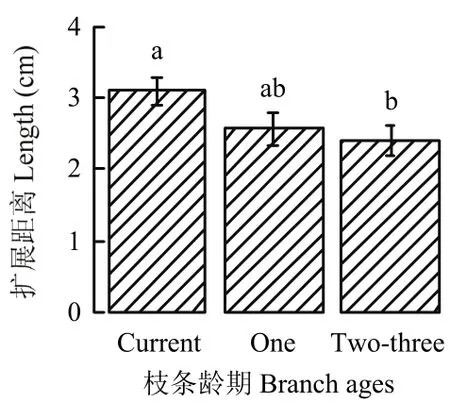
图 4 接种到不同龄期枝条木质部内腐烂病菌在 25℃下培养72 h的生长扩展距离Fig. 4 The extension distances of V. mali in the xylem when inoculated to branches of different ages and cultured at 25℃ for 72 hours
2.4 腐烂病菌在离体、活体及高温处理枝条木质部内的生长扩展速度
3—4月份苹果萌芽期,接种到苹果离体枝条剪口上的腐烂病菌,自然条件下(10—20℃)培养7 d后,在木质部内的生长扩展距离平均为2.00 cm,显著长于在活体枝条木质部内病菌的生长扩展距离1.04 cm(P<0.01)。离体枝条上所形成腐烂病斑的平均长度为0.82 cm,也显著长于在活体枝条上所致病斑长度0.18 cm(P<0.01)(图5-A)。11—12月份苹果休眠期,接种到苹果离体枝条剪口上的腐烂病菌,在温室内(10—20℃)培养7 d后,在木质部内的生长扩展距离平均为1.04 cm,显著短于在活体枝条上的生长扩展距离2.20 cm(P<0.01)(图5-B)。12月份,剪取苹果枝条在121℃下处理20 min,接种腐烂病菌。腐烂病菌在高温处理枝条木质部内的生长扩展距离平均为4.37 cm,显著长于未经高温处理枝条内腐烂病菌的生长扩展距离2.87 cm(P<0.01)(图5-C)。
2.5 腐烂病菌在苹果枝条不同组织所配制培养基内的生长扩展
腐烂病菌在苹果枝条不同部位配制的培养基中均能生长,所形成菌落直径都显著大于在水琼脂中的菌落直径(1.79 cm)(P<0.05)。腐烂病菌在木质部(EXY)和韧皮部(EPH)培养基中的菌落直径分别为5.60和5.15 cm,两者无显著差异(P>0.05),但显著大于在PDA中的菌落直径4.12 cm(P<0.05)。在韧皮部上清液(SPH)、韧皮部残渣(RPH)、木质部上清液(SXY)和木质部残渣(RXY)中,腐烂病菌的菌落直径与在 PDA中的菌落直径无显著差异(P>0.05)(图6)。然而,在韧皮部培养基上,腐烂病菌菌落的菌丝浓密,气生菌丝多,呈绒毛状;在木质部培养基中,腐烂病菌落的菌丝稀疏,气生菌丝很少,而基质内的扩展菌丝多(图 7)。在强酸处理木质部残渣培养基中(AXY),腐烂病菌的菌落直径为3.64 cm,与在未经处理木质部残渣培养基中的菌落直径(4.29 cm)无显著差异(P>0.05),而在强碱处理木质部残渣培养基中的菌落直径为2.10 cm,显著小于未经处理木质部残渣培养基中的菌落直径(P<0.05)(图6)。
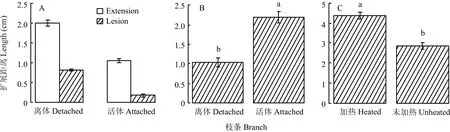
图5 腐烂病菌在活体、离体和高温处理枝条木质部内培养7 d后的生长扩展距离Fig. 5 The extension distances of V. mali in the xylem of the in vivo, in vitro and high temperature treated apple branches after 7 days incubation
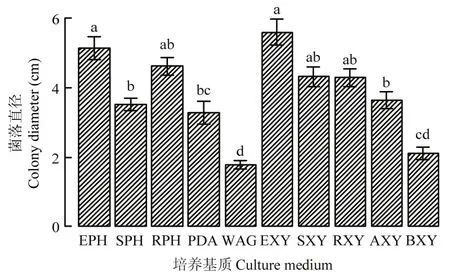
图 6 腐烂病菌在苹果枝条不同组织所配制培养基中 25℃培养3 d后的菌落直径Fig. 6 Colony diameter of V. mali cultured in medium made of different parts of apple branch tissues at 25℃ for 3 days
2.6 腐烂病菌在苹果枝条上生长扩展的周年动态
自2015年10月15日至2017年8月31日共接种45批枝条,共450个活体枝条和离体枝条,其中4个活体枝条在试验中丢失。在221个活体枝条上,腐烂病菌在木质部内的生长扩展距离为 1.75 cm,最长为5.0 cm;在韧皮部形成病斑的长度为0.88 cm(图8),最大长度为2.9 cm,出现在2016年的9月16日,最小病斑长度为0,出现在12月至次年3月的12次接种(图9);病菌导致木质部组织变色长度为0.93 cm。腐烂病菌在木质部的扩展距离显著长于(P<0.01)在韧皮部扩展所形成的病斑长度,及在木质部内造成组织变色的长度。在225个离体枝条上,腐烂病菌在木质部内的扩展距离为2.48 cm(图8),最长5.0 cm,最短1.0 cm(图9);在韧皮部造成的病斑长度为1.98 cm,最长4.6 cm,最短0.6 cm,在木质部造成组织变色的长度为1.99 cm。病菌在木质部的扩展距离也显著长于(P<0.01)在韧皮部造成病斑的长度,及在木质部造成组织变色的长度(图8)。
不同时期腐烂病菌在苹果活体枝条上的生长扩展速度变化较大。自12月至次年3月中旬,腐烂病菌在活体枝条上的生长扩展速度慢,在木质部的扩展距离最短,不超过1 cm,在韧皮部所造成病斑的长度最小,长度都不超过0.5 cm。进入5月份以后,病菌的扩展速度明显加快,接种1周后,在木质的扩展距离都在2.0 cm以上,其中8、9月份距离最长,都超过4.0 cm;在韧皮部形成病斑的长度都在1 cm以上,其中7、8月份高温季节所形成病斑的长度最大,多在2.0 cm以上。进入11月份,病菌枝条上的生长扩展速度明显减缓(图9)。

图7 腐烂病菌在韧皮部残渣(RPH)和木质部残渣(RXY)培养基中25℃培养3 d的菌落形态Fig. 7 Colony morphology of V. mali in the medium of RPH and RXY cultured at 25℃ for 3 days
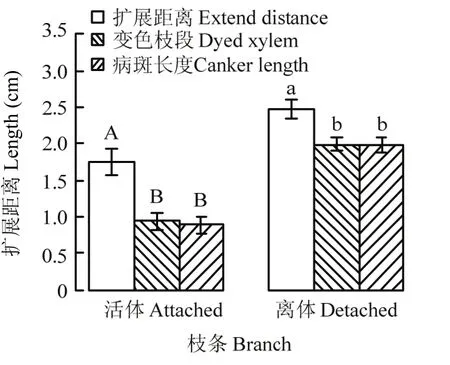
图8 腐烂病菌在苹果活体枝条(自然温度下培养)和离体枝条(25℃下培养)木质部内生长扩展距离、所致木质部组织变色的长度及所造成病斑长度Fig. 8 The extension distance of V. mali in the xylem, the length of changed color xylem and the length of canker lesion on the attached branches (cultured at natural temperature) and the detached branches(cultured at 25℃)
3 讨论
腐烂病菌在苹果枝条木质部内生长扩展距离显著长于在皮层内扩展形成腐烂病斑的长度,以及木质部组织变色的长度。木质部组织变色的长度与病斑的长度基本一致。在木质部中能切片显微观测到腐烂病菌的部位,并未发现到木质部变色现象[5]。由此推测,木质部变色可能是腐烂病菌在皮层扩展致病所产生的有害物质、毒素、色素等所致,而不是由腐烂病菌在木质部生长扩展所致。实际生产中,在刮治腐烂病斑时,以刮净木质部的变色组织为标准。然而,依据本研究的结果,刮净木质部的变色组织,并没有彻底刮除木质部内的腐烂病菌。
在 5—35℃下,腐烂病菌在苹果枝条木质部内都能生长扩展,最适为30℃,最高42℃,伦莹莹等研究表明腐烂病菌菌丝生长的最适温度为25—30℃,最高为40℃[30],与本研究结果基本一致。自然条件下,接种到剪口上的腐烂病菌,在接种初期的生长扩展主要受温度的影响,而受寄主抗病性的影响较小,病菌在木质部内的生长扩展速度,与病斑发展速度基本一致。12月至次年3月,病菌在枝条上的生长速度很慢,培养7 d后在皮层所形成病斑的长度几乎为0,在木质部的扩展距离也不足1 cm。6—9月,腐烂病菌在枝条上的生长速度最快,培养7 d所形成的病斑长度都超过1 cm,在木质部内扩展距离都超过2.5 cm。晚秋、冬季或早春侵入皮层的腐烂病菌,受温度的影响,病斑扩展很慢,所形成的病斑很小,外观难以察觉[31]。进入2、3月份,遇温暖天气或树体局部高温,小病斑可迅速扩展形成大型病斑,形成春季发病高峰。春季发病高峰的出现应是秋、冬、春季病菌积累生长的结果。
枝条的相对含水量对腐烂病菌在木质部内生长扩展具有显著影响。当枝条相对含水量在90%以上时,不同处理间差异不显著,生长扩展均比较快,但当枝条的相对含水量低于90%时,病菌的生长速度明显减缓。陈策等研究发现树皮的充水度对枝条愈伤能力、抗扩展能力有显著的影响[32],枝条充水度低,抗病性差,病斑扩展速度快。本研究则仅测试了枝条含水量对病菌在木质部内生长扩展的影响。腐烂病菌主要从剪锯口和表层的腐烂病斑进入木质部。苹果修剪后,剪锯口常裸露,刮除腐烂病斑后,木质部也裸露,从而导致木质部失水,相对含水量降低,进而抑制腐烂病菌在木质部生长扩展。然而,持续的阴雨会浸透木质部,可能会导致腐烂病菌在木质部快速生长。前一个生长季节的降雨量和降雨持续时间是否能提高腐烂病旧病斑复发率和剪锯口发病率,还需进一步验证。
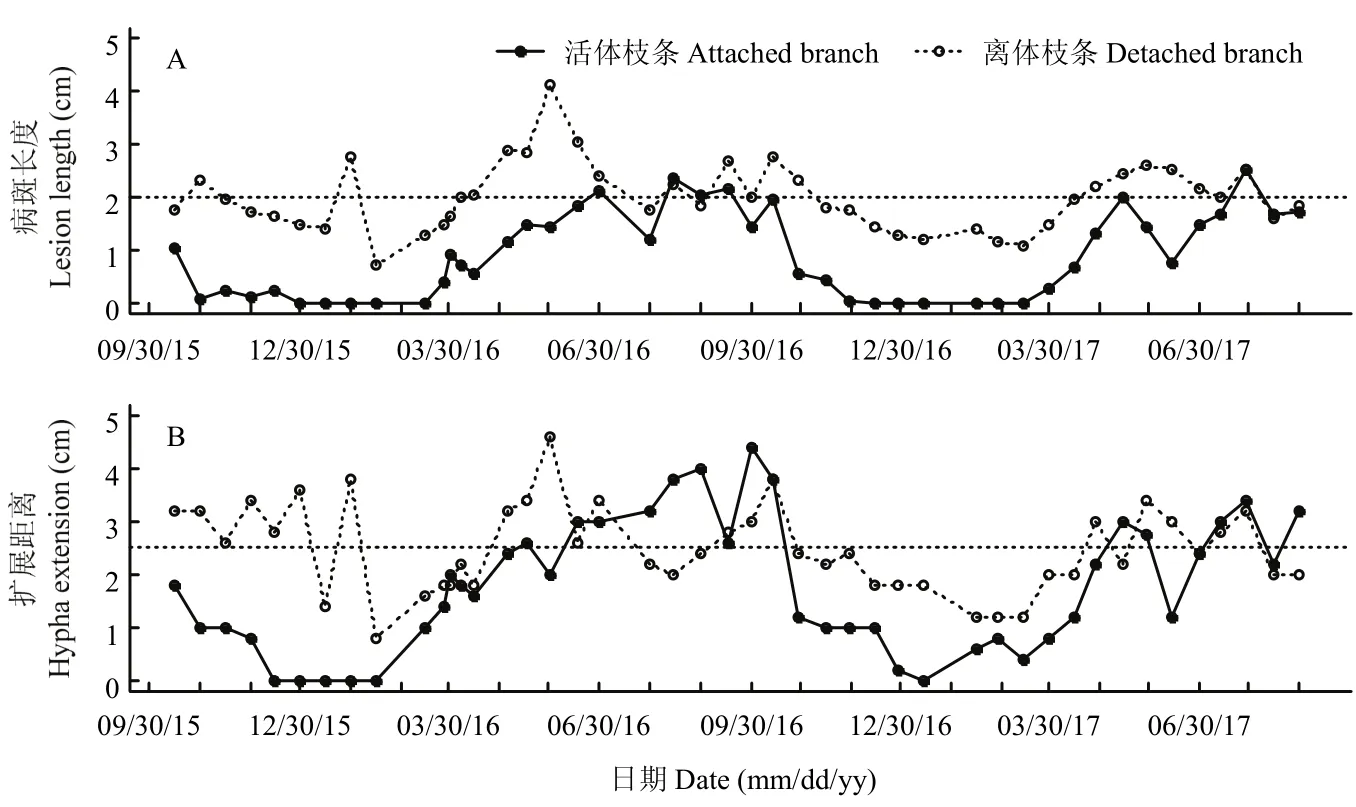
图9 腐烂病菌在离体枝条(25℃下培养)和活体枝条(自然温度下培养)木质部和皮层内生长扩展动态Fig. 9 The growth dynamics of V. mali in the xylem and cortex of detached branches (cultured at 25℃) and attached branches(cultured at natural temperatures)
腐烂病菌能够在木质部的浸出液中生长扩展,而且所形成的菌落直径与在 PDA上形成的菌落直径无显著差异。由此推断,腐烂病菌能够或主要利用木质部内的可溶性养分在木质部内生长扩展,木质部导管内可溶性养分的浓度可能是影响腐烂病菌在苹果枝干木质部内生长扩展的重要因素。苹果枝条浸水后,腐烂病菌在木质部内的生长速度明显减缓,可能与木质部内可溶性养分的浓度降低有关,或因导管充水,阻碍病菌扩展造成的。PÉREZ-DONOSO等报道了内生细菌Xylella fastidiosa产生的内切葡聚糖酶和多聚半乳糖醛酸酶能够使葡萄藤管间纹孔膜的孔径变大,从而使内生细菌在植物体内的蔓延更加便利,有利于在植物体内定殖[33]。腐烂病菌在木质部导管内生长扩展,但没有发现导管结构被破坏的现象[5]。在病斑的刮治过程中,也没有发现复发病斑内的木质部受到腐烂病菌的破坏。对于腐烂病菌能否产生各种酶类分解或改变木质部结构组分,还有待于深入研究。
在多年生枝条上,病菌的扩展速度慢,在当年生的枝条上扩展速度快,这可能与枝条木质部的结构有关。多年生枝条木质部的结构比较致密,当年生枝条的结构相对疏松,致密的结构抑制了病菌快速扩展。腐烂病菌在高温处理枝条内生长扩展速度快,在未经高温处理枝条上生长扩展速度慢,在离体和活体枝条上的扩展速度也不同。对于导致这一现象的确切原因还不清楚。一种解释是高温破坏了木质部的结构,消除了病菌扩展过程中所遇到的障碍,从而加快了病菌的扩展速度;另一种解释是高温处理破坏木质部的结构或某些组分,增加了木质部内可溶性养分的浓度,促进了腐烂病菌的生长;第三种可能的解释为,苹果枝条存在由活体组织产生的抗性,经高温处理或剪离母体后,会失去抗性或抗性降低。
4 结论
腐烂病菌在苹果枝条木质部内主要利用可溶性养分生长扩展,其扩展速度显著快于在皮层内的扩展速度;腐烂病菌在木质部内的生长扩展主要受温度、枝条含水量、木质部的致密程度等因素的影响。
