猪葡萄球菌感染BALB/c小鼠血清中细胞因子表达的抗体芯片分析
2018-09-11蔡汝健蒋智勇勾红潮楚品品李春玲
李 艳,王 磊,蔡汝健,蒋智勇,勾红潮,楚品品,宋 帅,李春玲
(广东省农业科学院动物卫生研究所/广东省畜禽疫病防治研究重点实验室/农业部兽用药物与诊断技术广东科学观测实验站,广东 广州 510640)
仔猪渗出性皮炎(exudative epidermit, EE)是由葡萄球菌感染引起的一种急性传染病,仔猪感染后会出现全身性皮炎,最终导致脱水和全身衰竭而死亡,死亡率可达70%[1-2]。该病的发生给我国养猪业造成了巨大的经济损失,丹麦、日本、德国、俄罗斯等国家也有该病发病及病原的研究[3-6]。猪葡萄球菌可分为有毒力型和无毒力型菌株,其分泌的脱落毒素是主要的毒力因子[7-8]。目前已有5种猪葡萄球菌分泌的表皮脱落毒素被发现并命名,分别是丹麦学者鉴定的ExhA、ExhB、ExhC和ExhD,以及日本学者鉴定的SHETB[9-10]。
已有研究显示,炎性细胞因子在疾病的发展过程中发挥重要作用[11]。同时检测多种炎性细胞因子的表达水平将有助于深入了解猪葡萄球菌的感染过程,而且有可能发现关键的致病性因子。抗体芯片技术是一种检测生物样品中蛋白表达模式的方法,其凭借高通量、高灵敏度、高特异性和低样本量等特点,为蛋白质表达的快速、平行分析提供了技术平台[12]。此外,抗体芯片对疾病相关生物标签的发现、药物靶点的筛选等具有重要作用[13-15]。
本研究通过抗体芯片技术检测了猪葡萄球菌感染BALB/c小鼠后血清炎性细胞因子的表达,旨在研究炎性细胞因子在猪葡萄球菌感染过程中的作用,同时筛选可能的疾病相关生物标签。
1 材料与方法
1.1 试验材料
菌株CF-1(JQ728492)分离自广东省暴发渗出性皮炎的某猪场病猪;AAM-CYT-G2炎症因子抗体芯片购自广州RayBiotech公司;4周龄BALB/c小鼠购自南方医科大学。
1.2 试验方法
1.2.1 血清采集 将4周龄BALB/c小鼠24只随机分为2组,每组12只。试验组的每只小鼠经肌肉和皮下注射菌液0.2 mL(CF-1含量1.0×108CFU),对照组的小鼠注射灭菌的PBS液。均在注射后24、48 h采集血液,收集血清,于-80℃保存备用。
1.2.2 细菌的分离鉴定 无菌条件下,采集小鼠的内脏,分别接种于血琼脂平板、营养琼脂培养基,37℃培养18 h,次日挑取单个菌落进行染色镜检,并进行划线纯培养。
1.2.3 血清细胞因子的检测 血清细胞因子的检测采用RayBiotech Mouse Cytokine Antibody Array G Series 5 芯片技术测定(含RayBiotech公司原装试剂盒),AAM-CYT-G2芯片布局见表1。将玻片芯片取出,每张玻片4个样本实验区,每个样本实验区的微阵列中固定了32种细胞因子的抗体及阳性和阴性对照,每个细胞因子位点重复测定2次。主要操作步骤如下:(1)每个芯片孔中加入100 μL封闭液,封闭30 min。抽去封闭液,每孔加入100 μL样品,每个阵列1个样品,孵育过夜。(2)使用Thermo Scientific Wellwash Versa 芯片洗板机清洗玻片,每孔加入250 μL洗液Ⅰ,清洗6次;每孔加入250 μL洗液Ⅱ,清洗5次。(3)加入70 μL生物素标记抗体,孵育1 h,清洗玻片同步骤(2)。(4)每孔加入70 μL荧光素标记的链霉抗生物素蛋白,在室温下避光孵育1~2 h,清洗玻片同步骤(2)。(5)采用GenePix 4000B Microarray Scanner激光扫描仪扫描芯片,用AAM-CYT-G2数据分析软件进行数据分析。
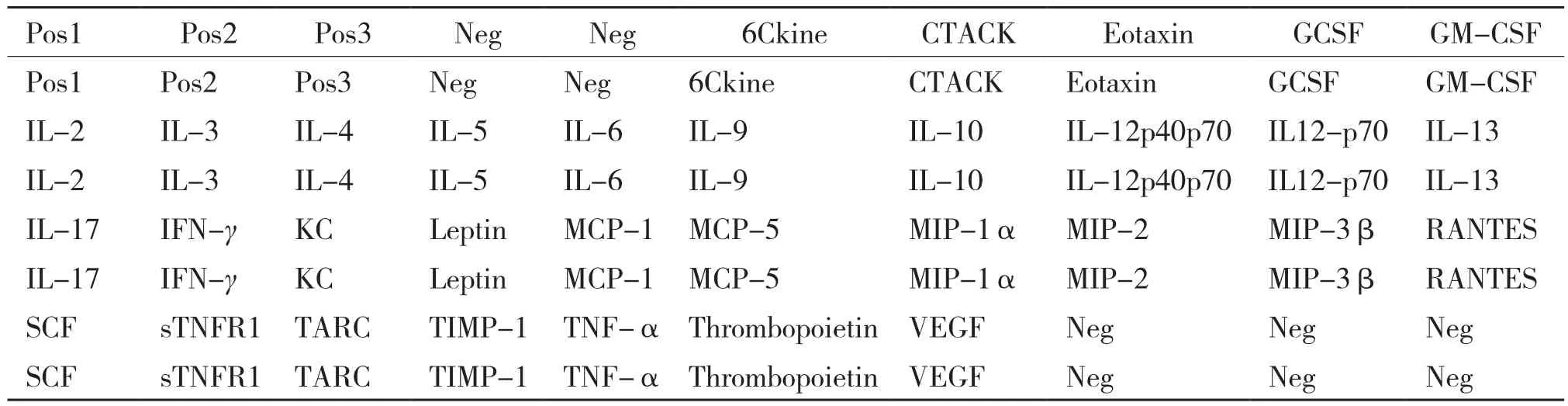
表1 AAM-CYT-G2芯片膜上细胞因子位置
1.2.4 数据分析 使用微阵列(SAM)软件对数据进行显著性分析,差异值≥2.0倍表明细胞因子的表达上调显著,差异值≤0.5倍表明细胞因子的表达下调显著,细胞因子的表达在0.5~2倍之间表明无显著差异。
2 结果与分析
2.1 细菌的分离鉴定
细菌在普通营养琼脂培养基和绵羊鲜血平板培养基上生长良好,菌落形态光滑湿润,呈瓷白色;在血平板上不溶血,在麦康凯培养基上不能生长。通过显微镜观察到蓝紫色葡萄状球菌(图1,封三)。
2.2 不同处理小鼠血清细胞因子的差异表达
2.2.1 感染后24 h血清细胞因子的表达 感染后24 h试验组与对照组的小鼠血清细胞样本芯片扫描结果如图2(封三)所示。芯片扫描结果显示,与对照组相比,试验组中共有5个血清细胞因子表达出现了显著性变化,其中表达升高2倍以上的细胞因子有4个,包括G-CSF、IL-6、KC和MCP-5,IL-12的表达低于对照组一半。由表2可知,试验组血清中G-CSF、IL-6、KC和MCP-5的表达分别为对照组的3490.13、9.98、44.25、7.05倍,IL-12的 表 达量为对照组的0.49倍。
2.2.2 感染后48 h血清细胞因子的表达 感染后48 h试验组与对照组的小鼠血清细胞样本芯片扫描结果如图3(封三)所示。芯片扫描结果显示,与对照组相比,血清细胞因子中共有4个细胞因子表达出现了显著性变化,其中表达升高2倍以上的细胞因子有3个,包括G-CSF、KC和MCP-5;IL-12的表达同样低于对照组一半。由表2可知,试验组血清中G-CSF、KC和MCP-5的表达分别为对照组的1423.58、3.78、3.44倍,IL-12的表达量仅为对照组的0.47倍。
2.3 CF-1感染BALB/c小鼠后小鼠血清细胞因子差异表达
CF-1感染BALB/c小鼠后24、48 h,血清细胞因子芯片扫描(图2、图3,封三)及差异表达分析结果(表2)显示,感染后24、48 h有3种细胞因子表达水平均升高2倍以上,分别为G-CSF、KC和MCP-5;表达水平均低于对照一半的细胞因子为IL-12。
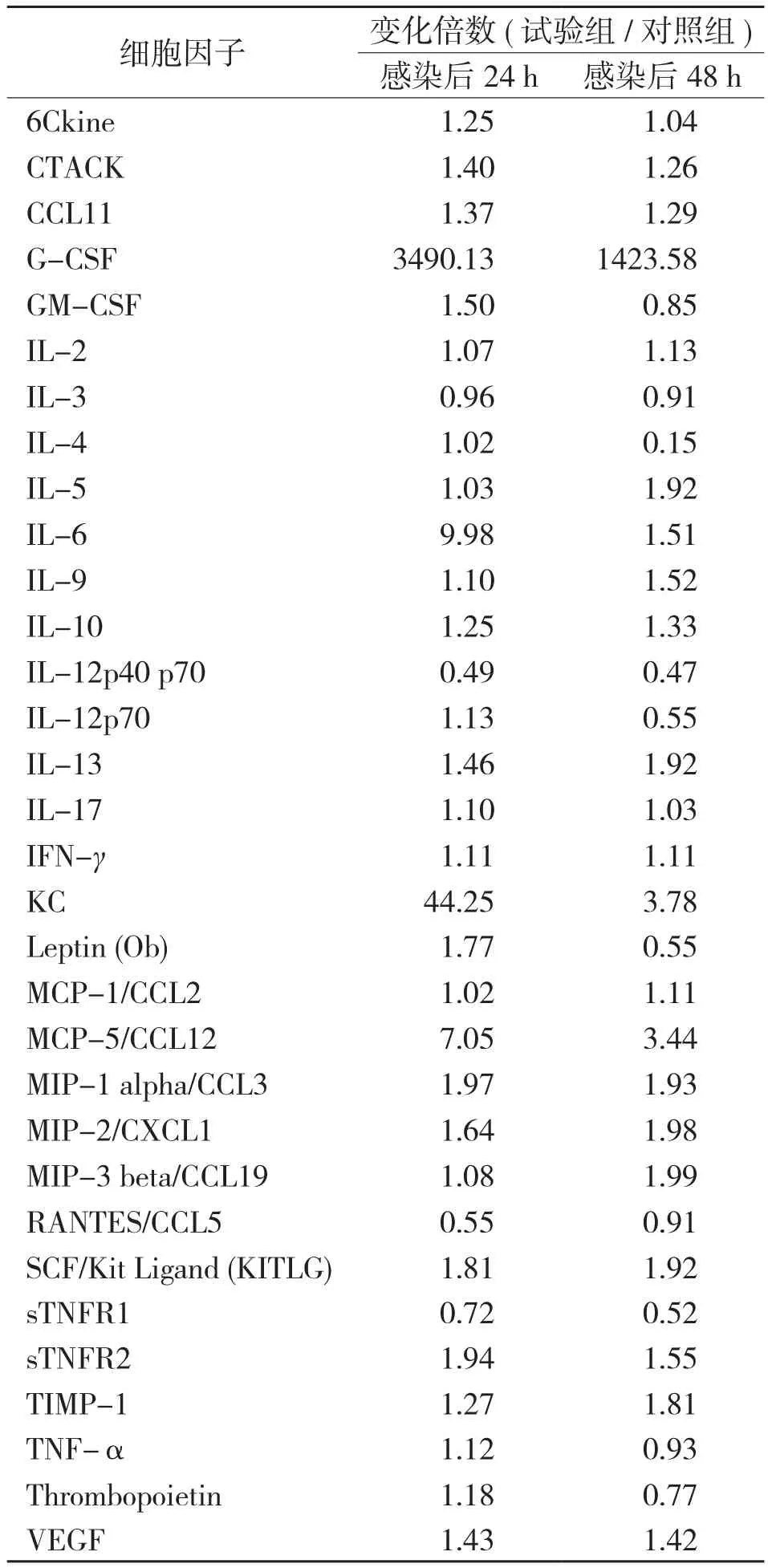
表2 细胞因子差异表达变化倍数
3 结论与讨论
近年来,蛋白质芯片技术已被广泛应用于蛋白质谱分析、新药研发、药物靶标识别、临床诊断及预后标记筛选。抗体芯片作为最常用的一种蛋白质芯片,具有全面准确反映疾病发生、发展过程中蛋白质表达水平等特点,已成为生物样品中蛋白质分子检测的重要手段[16]。细胞因子是炎症性疾病的重要调节因子,是目前发病机制研究的热点之一[17-18]。猪葡萄球菌感染过程中可能涉及免疫系统的异常激活和抑制以及促炎/抗炎反应等,单一细胞因子检测不能为疾病的进展情况提供可靠信息,系统细胞因子检测如细胞因子抗体微阵列技术能提供全面的细胞因子表达数据。细胞因子抗体芯片研究现已应用于糖尿病、肿瘤、心血管疾病、类风湿性关节炎等疾病研究[19-20],因此我们使用细胞因子抗体芯片技术检测感染猪葡萄球菌CF-1株BALB/c小鼠血清中细胞因子的表达,了解猪葡萄球菌感染过程中炎性细胞因子表达的相关性。在本研究中,使用小鼠细胞因子抗体微阵列技术同时检测32种细胞因子,并筛选了5种具有显著差异的细胞因子,其中4个细胞因子(G-CSF、IL-6、KC、MCP-5)在猪葡萄球菌感染小鼠血清中上调表达,IL-12在猪葡萄球菌感染的小鼠的血清中下调表达。在前期研究报道中,我们采用细胞因子抗体芯片技术检测了猪葡萄球菌ZC-4株感染BALB/c小鼠血清中细胞因子的表达[21],发现了4种具有显著差异的细胞因子,其中G-CSF、IL-6及KC上调表达,下调表达的是IL-12。综合猪葡萄球菌ZC-4株和CF-1株感染小鼠血清细胞因子差异表达结果,筛选猪葡萄球菌感染小鼠血清差异表达细胞因子,其中表达上调的细胞因子为G-CSF、IL-6及KC,下调表达的是IL-12。提示这些细胞因子有可能作为猪葡萄球菌感染血清的蛋白分子标记物。
IL-6主要由巨噬细胞产生,在免疫系统功能调节、炎症感染反应、骨髓组织造血功能调控等方面具有多效性。IL-6是一种非常重要的炎症因子,参与炎症和免疫反应,在慢性炎症和自身免疫性疾病中发挥病理作用[22]。本研究中促炎因子IL-6在感染早期表达显著升高,暗示在猪葡萄球菌感染早期的炎症过程中发挥了主要作用。粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)是一种多肽链的细胞生长因子。近年来,已发现G-CSF不仅特异性地调节粒细胞的增值和分化,而且还增强了成熟粒细胞的功能,同时具有免疫调节、血管保护、抗动脉粥样硬化和保护神经作用[23]。G-CSF通过调节多种免疫细胞来影响机体的免疫反应[24]。KC也称为CXCL1,属于CXC趋化因子家族,CXC趋化因子参与细胞内外多种生命活动,如炎性反应、损伤修复等[25],肿瘤组织中CXCL1的高表达与疾病的不良预后相关[24-26]。本研究中,G-CSF和KC的表达也显著升高,其在猪葡萄球菌感染中的作用需要进一步研究。
本研究采用细胞因子抗体芯片技术获得了一组非常有意义的数据,初步筛选了猪葡萄球菌感染小鼠后的血清蛋白标记物。同时,在筛选过程中发现,还有一些细胞因子可能在猪葡萄球菌的感染过程中起作用,为了解猪葡萄球菌感染的分子机制提供参考。
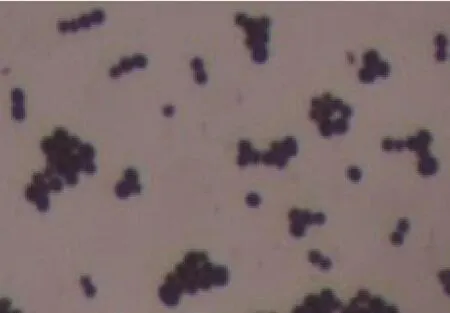
图1 分离菌革兰氏染色镜检结果(×100)
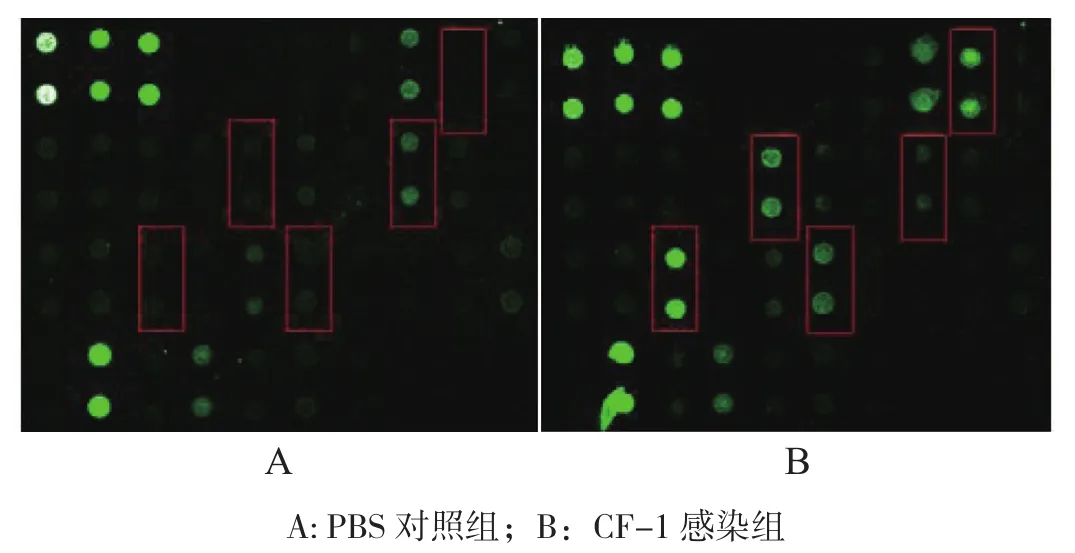
图2 感染后24 h 血清AAM-CYT-G2细胞因子抗体芯片检测结果
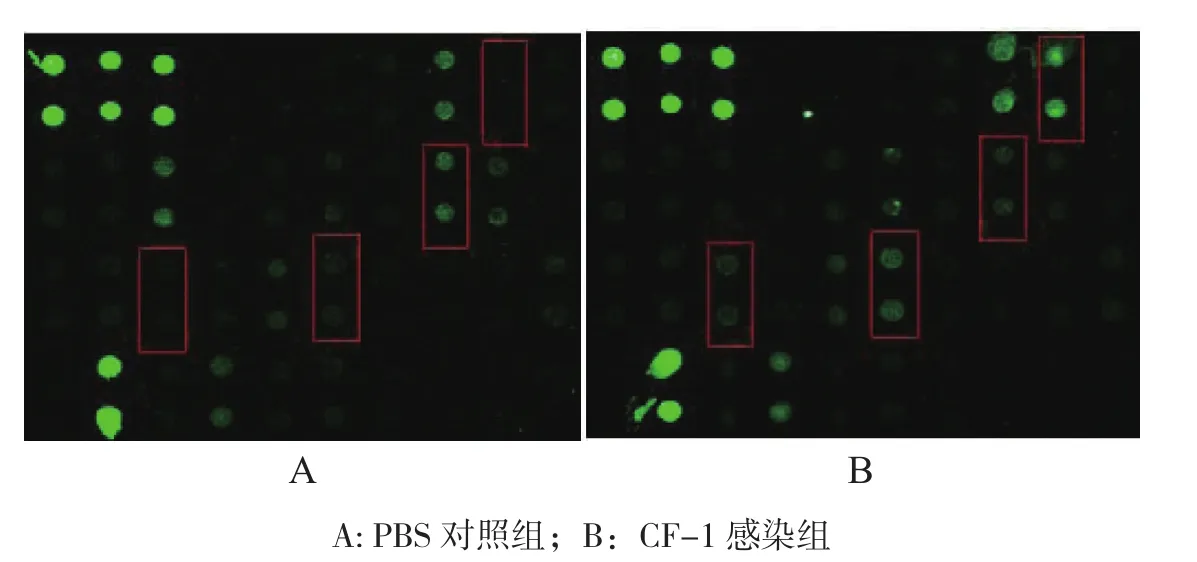
图3 感染后48 h 血清AAM-CYT-G2细胞因子抗体芯片检测结果
