中华鳖(Pelodiscus sinensis)迟缓爱德华氏菌(Edwardsiella tarda)的分离鉴定与药物敏感性分析
2018-09-11朱凝瑜曹飞飞郑晓叶郑天伦
朱凝瑜,曹飞飞,郑晓叶,郑天伦
(浙江省水产技术推广总站,浙江省水生动物防疫检疫中心,杭州 310023)
中华鳖(Pelodiscussinensis)是中国水产养殖名优产品中的主要品种之一,在浙江、安徽、江苏、湖北、湖南、江西、广东等地区广泛养殖,营养价值与经济价值高,深受广大养殖者与消费者青睐。但随着养殖规模的扩大和集约化程度的提高,中华鳖病害的发生日趋严重,造成严重的经济损失,阻碍了中华鳖养殖业的健康发展。总体来说,细菌性疾病在中华鳖中最为常发[1-2],如穿孔病、溃烂病、白点病、白底板病、红底板病和红脖子病等。引起细菌性疾病的病原种类繁多,目前报道较多的有嗜水气单胞菌[3-4]、温和气单胞菌[1-5]、迟缓爱德华氏菌[6-7]、弗氏柠檬酸杆菌[8-9]等。其中,白底板病具有发病面广、发病率和死亡率高等特点,已成为严重危害中华鳖产业发展的细菌病之一。该病在5~8月份流行,发病高峰期水温22~32 ℃,将鳖由温窒移往外塘时易患此病,气温突变(如寒潮、连续阴雨天等)也容易诱发该病[10]。
2017年,本实验室从萧山某中华鳖规模化养殖场暴发白底板病的病鳖中分离到1种优势菌,稚鳖回归感染实验证实其具有致病力,进一步对该菌株的主要生物学性状、16S rRNA基因序列与系统发育、药敏试验等进行了研究,旨在为该病的诊断及防治提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂与耗材
脑心浸液培养基(BHI)、琼脂粉购于北京陆桥技术有限责任公司;DNA提取试剂盒、PCR试剂、引物购于上海生工生物技术有限公司;药敏纸片购于杭州天和微生物试剂有限公司。
1.1.2 实验动物
患白底板症状的病鳖(约400 g)于7月底采自杭州萧山某规模化养殖场。用于回归感染试验的健康稚鳖购于天福养殖场,4~6 g/只。暂养一周,养殖用水为曝气2 d的自来水,pH 7.2,水温(25±2) ℃。
1.2 方法
1.2.1 细菌分离培养
75%酒精棉球擦拭体表消毒后,无菌手术刀剪开病鳖腹部,采集病鳖的肝脏、脾脏、肾脏等,用接种环蘸取后划线接种于BHI琼脂平板上。30 ℃恒温培养24 h后,挑取优势单菌落纯化后扩大培养于BHI液体培养基中,加甘油(直至25%,V/V) 于-80 ℃保存备用。
1.2.2 生化鉴定
革兰氏染色,根据结果选择相应鉴定卡,于全自动微生物鉴定仪(VITEK 2,法国梅里埃)中进行菌种鉴定。
1.2.3 分子鉴定
采用Ezup柱式基因组DNA抽提试剂盒提取纯化菌株的基因组模板,采用细菌16S rRNA通用引物:F(5′-AGAGTTTGATCCTGGCTCAG-3')和R(5′-GGTTACCTTGTTACGACTT-3′),进行PCR扩增。扩增产物经1%的琼脂糖凝胶电泳后,送上海生工生物技术有限公司测序。
1.2.4 16S rRNA 基因序列系统进化树构建
将测序所得的菌株16SrRNA序列在GenBank数据库中经Blast比对,选取相似性较高的序列,采用Clustal X(1.83)进行多序列同源性比对(Multiple alignments),按邻接法(Neighbor-joining method)用MEGA 4.0软件构建系统进化树。
1.2.5 回归感染实验
取分离株接种于BHI液体培养基,30 ℃培养
24 h后,离心后用无菌生理盐水将细菌沉淀调成4.5×105、4.5×106、4.5×107及4.5×108CFU/mL。将50只稚鳖平均分为5组,每组10只。试验组4组,分别经腹腔向每只稚鳖注射4.5×105~4.5×108CFU/mL不同浓度的菌液0.1 mL;对照组注射等量无菌生理盐水。连续观察7 d,记录其发病及死亡情况。
1.2.6 药敏试验
按常规纸片扩散法进行[11]。通过比浊法调整细菌浓度至108CFU/mL,吸取200 μL纯培养物均匀涂布于BHI琼脂平板,用无菌镊贴上各种药敏纸片,30 ℃培养24 h,测定抑菌圈直径。每个药物均设3个平行,取平均值后参照NCCLS的判断标准进行判定。
2 结果
2.1 病鳖症状及剖检变化
病鳖行动迟缓,浮于水面,摄食减少,体表完好无损,底板苍白(图1A)。解剖可见,血液量减少,肝脏肿胀色深,质脆易碎、有花纹(图1B),肾肿涨,胃充盈有积液(图1C),肠套叠、梗死,出血严重,肠道内有出血块(图1D)。

图1 病鳖症状及病理变化图A1:病鳖白色底板,A2 正常鳖底板;B:肝脏肿胀,有花纹(箭头处);C:胃充积液(箭头处);D:肠内血凝块。Fig.1 The pathological symptoms of diseased Chinese soft-shelled turtleA: white abdominal shell of diseased turtle (A1) and healthy turtle (A2); B: liver with swollen, brittle and pattern(Showed with arrow);C: swelling stomach with fluid (Showed with arrow); D: infracted intestinal tract with blood clot.
2.2 细菌分离及菌落形态观察
从病鳖肝脏、脾脏、肾脏等组织及胃积液分离到一种外观特征较一致的优势菌落,其表面湿润光滑、微隆起、半透明,呈灰黄色。菌株革兰氏染色阴性,镜检形态为短杆状。
2.3 生化鉴定
基于VITEK 2的64个生化反应的分析提示,分离株t39-w-1呈L-阿拉伯醇、β-半乳糖苷酶、α-葡萄糖、蔗糖、D-甘露醇阴性,葡萄糖发酵、H2S、D-麦芽糖、D-葡萄糖、赖氨酸脱羧酶等阳性,鉴定结果为迟缓爱德华氏菌(Edwardsiellatarda),其具体生理、生化特性见表1。
2.4 分子鉴定
用细菌16S rRNA通用引物对上述菌株的基因组模板进行PCR扩增,获得长度约1 400 bp的片段。序列经Blast比对分析后,与迟缓爱德华氏菌同源性均在98%以上。从NCBI基因序列数据库中下载3株迟缓爱德华氏菌,16株其他肠杆菌科的菌株,包括沙门氏菌属(Salmonella)、耶尔森菌属(Yersinia)、埃希氏菌属(Escherichia)、克雷伯菌属(Klebsiella)、变形杆菌属(Proteus)、爱德华氏菌属(Edwardsiella)等6个菌属,构建系统进化树(图2)。结果显示,分离株与迟缓爱德华氏菌聚为一支。综合形态、生化特征以及16S rRNA序列分析结果,确定分离株t39-w-1为迟缓爱德华氏菌。

表1 分离菌株的生理性状Tab.1 Physiological and biochemical characterizations of the isolated bacterium
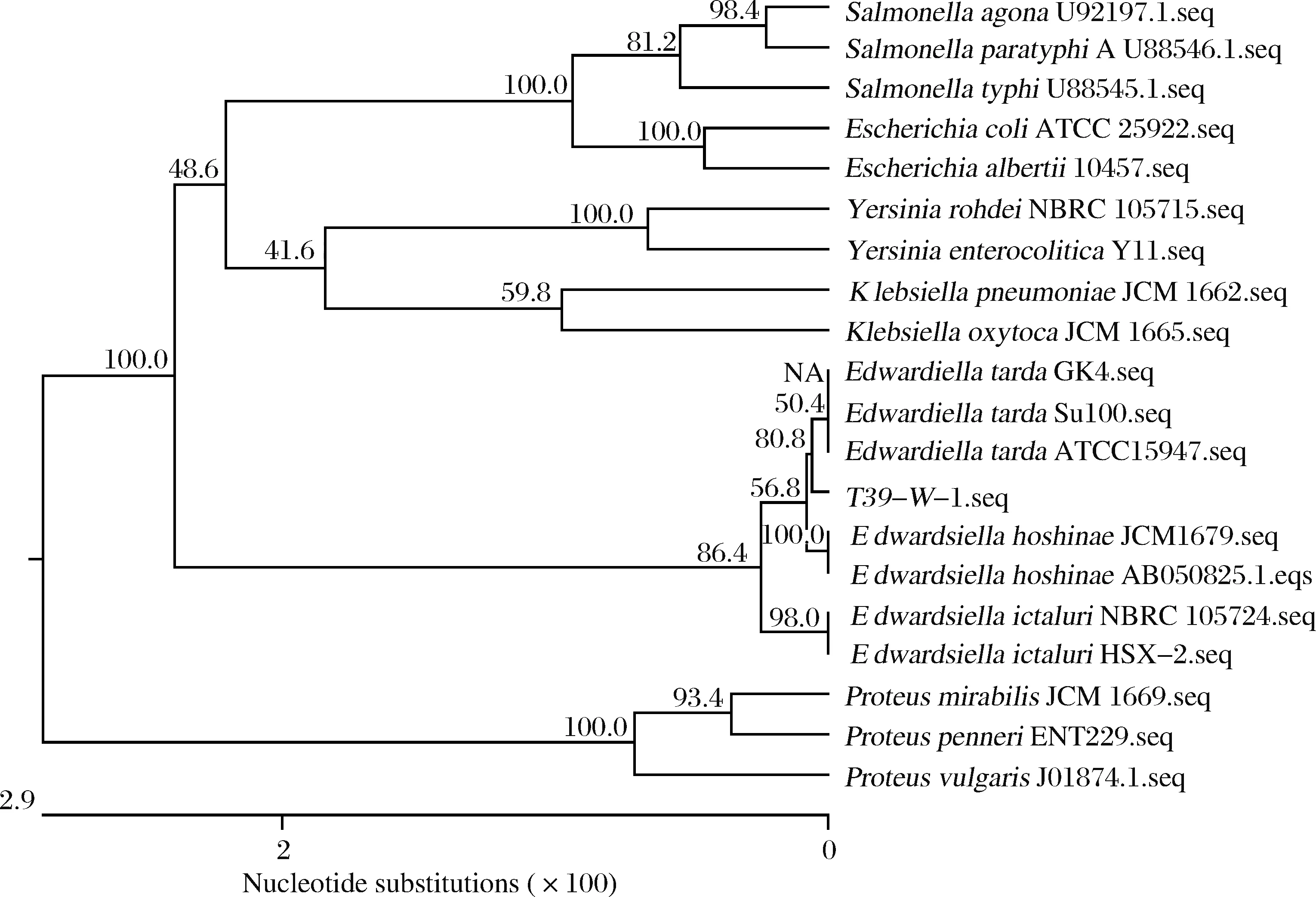
图2 基于16S rRNA 构建的菌株系统进化树Fig.2 Phylogenetic tree of the isolated strain based on 16S rRNA
2.5 回归感染实验
分离株t39-w-1 对健康稚鳖的回归感染实验结果见表2。结果显示,高剂量组(4.5×107CFU)的稚鳖攻毒后24 h内死亡7只,48 h内全部死亡;中剂量组(4.5×106CFU)7 d内死亡8只;低剂量(4.5×105和4.5×104CFU)组未见异常,无死亡。对照组稚鳖未见异常。从人工感染稚鳖的肝脏、肾脏中分离到纯度较高、与接种菌株形态相同的菌落,经VITEK 2鉴定同样为迟缓爱德华氏菌,生化特征与接种菌株一致,提示该菌为引起中华鳖发病死亡的病原菌。

表2 t39-w-1 菌株对健康稚鳖的感染试验结果Tab.2 Results of artificial infection of t39-w-1 to healthy juvenile turtles
2.6 药敏实验
取分离株t39-w-1开展药敏实验,结果显示,该菌株对庆大霉素、阿米卡星、新霉素、头孢哌酮、氨曲南等5种抗生素高度敏感,对恩诺沙星中度敏感,而对青霉素G、氟苯尼考、四环素、多西环素、林可霉素、万古霉素、复方新诺明等7种抗生素耐药(表3)。
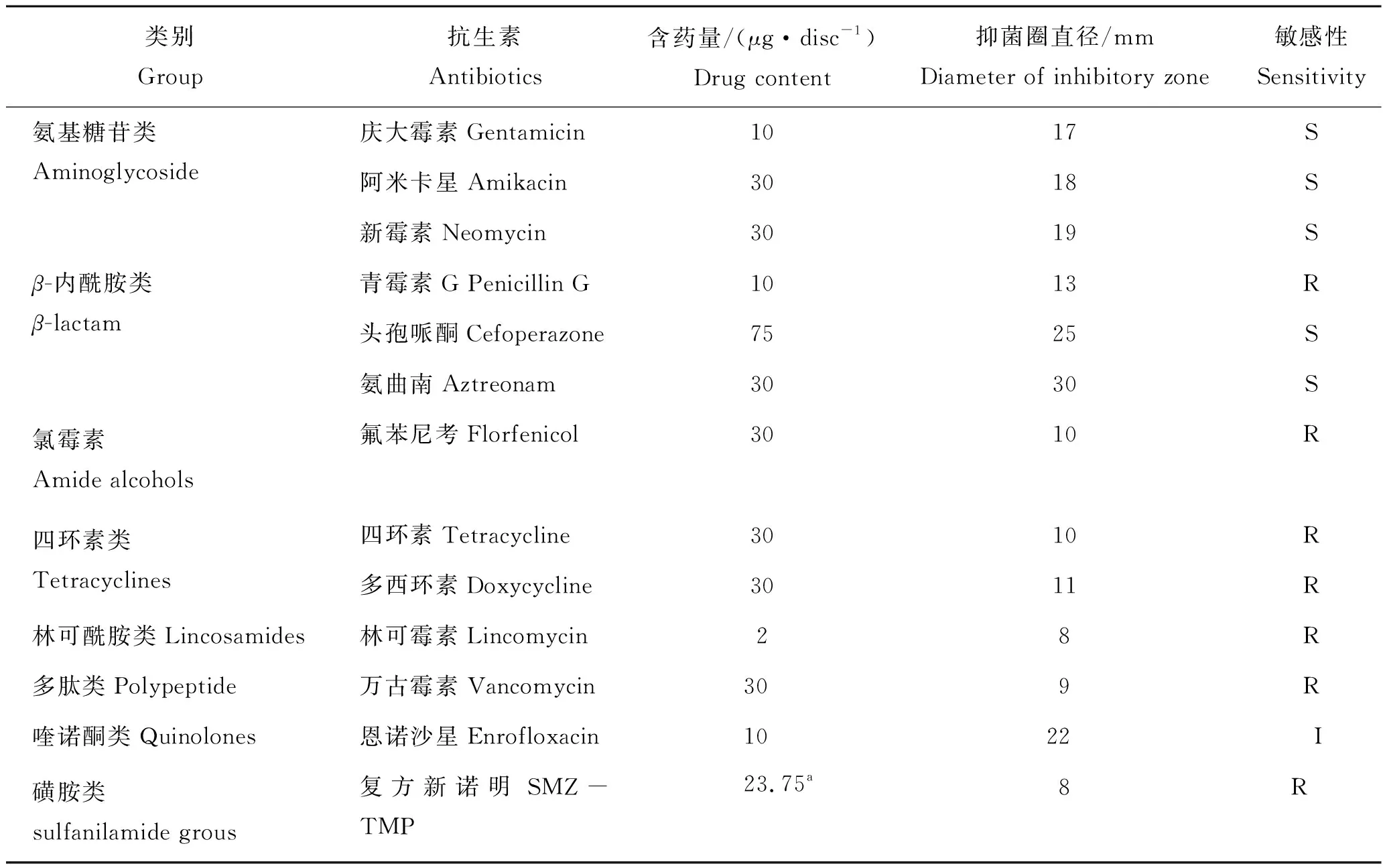
表3 t39-w-1菌株的药敏试验结果Tab.3 Results of antimicrobial sensitive test of t39-w-1
3 讨论
迟钝爱德华氏菌属肠杆菌科爱德华氏菌属,为革兰氏阴性条件致病菌,无荚膜,不形成芽胞,周鞭毛,有运动力。该菌在世界范围内广泛存在,为人畜鱼共患病原菌[12],一定条件下能引起人的胃肠炎和免疫系统的破坏[13]。由于它的广盐性,在水产养殖中危害也很大,能引起多种水生生物的出血性败血症、腹水病、溃烂病等,如欧洲鳗鲡、乌鳢、大菱鲆、异育银鲫等[14-18]。本研究中,病鳖的底板苍白,肝脏肿胀质脆,胃积水,肠套叠、梗死,从其肝脏、肾、胃积液中分离到一致的唯一优势菌——迟缓爱德华氏菌,通过回归感染试验能导致稚鳖死亡,证实其存在致病性。
16S rRNA基因序列测定已被广泛用于细菌分类和鉴定上,但由于16S rRNA序列的高度保守性,特异性区域相对较少,因此常难以区分同一属内的相近种。另外,爱德华氏菌属的各种之间差异较小,不时有新种出现[10],因此很难凭借16S rRNA鉴定到种。在细菌分类鉴定时,将分子鉴定与生化特性相结合,可使鉴定结果更可靠、准确、科学。本研究中的分离株t39-w-1在序列比对时,发现其与迟缓爱德华氏菌、保科爱德华氏菌、鲇鱼爱德华氏菌的同源性均在98%以上。结合菌落的形态特征及生化特性,并做系统进化分析,综合判定分离菌为迟缓爱德华氏菌。
目前,引起白底板病的主要病因尚无定论,许多研究发现其是由一种或多种病菌共同引起的,如江为民等[19]从病鳖体内仅分离到迟缓爱德华氏菌一种细菌,且能重新复制出该病症状;陈晓风等[20]认为中华鳖白底板病的病原为细菌,且为嗜水气单胞菌、迟缓爱德华氏菌和普通变形杆菌混合感染致病;沈锦玉等[10]认为白底板病由病毒和嗜水气单胞菌、迟钝爱德华氏菌混合感染引起。另有学者认为,当饲料酸值超过20时,中华鳖易患白底板病[21];鳖的白底板病与出血性肠道坏死症有着密切联系[22]。可见,中华鳖白底板病的成因较为复杂,细菌性病原、病毒性病原、饲料以及环境因素均能引起该病的发生。本研究从具有明显白底板症状的患病中华鳖中仅分离到迟缓爱德华氏菌一种优势菌,回归感染试验中能使稚鳖出现血液减少,肝脏肿大症状,与发病病鳖症状相同,并能引起稚鳖死亡,证实其致病性。后期将继续选用幼鳖、成鳖进行实验,以进一步丰富和验证白底板病的发病原因。
中华鳖的细菌性疾病多以症状命名,可能存在一症多病和一病多症的情况,不同症状可能是同一病原在不同阶段的不同表现, 而不同病原也有可能引起相同的症状[23]。本研究中药物敏感试验表明,分离到的迟缓爱德华氏菌对庆大霉素、阿米卡星、新霉素、头孢哌酮、氨曲南等5种抗生素高度敏感,为该病的防治提供了一定的科学依据。但与其他分离菌株药敏结果[8,10,17]有所差异,有的甚至呈现截然不同的结果,说明细菌的药物敏感性与菌株本身、地域用药习惯及环境等有关[8]。因此,在生产过程中,简单的“对症下药”并不完全可行,有必要针对病原进行药敏试验,筛选敏感药物进行疾病防治,在提高治疗效果的同时,也可避免因乱用、滥用药物造成的药物残留超标和环境污染等问题。
4 结论
本研究从患白底板病的病鳖中分离到1种优势菌,经形态观察、生理生化鉴定和16S rRNA序列分析确定为迟缓爱德华氏菌。回归感染实验表明分离到的迟缓爱德华氏菌具有致病性。药敏试验表明该菌对庆大霉素、阿米卡星、新霉素、头孢哌酮、氨曲南等5种抗生素较为敏感。在实际生产中,建议针对病原进行药敏试验,筛选敏感药物进行疾病防治,科学合理使用药物。
