2-(1- 取代苄基 -1H-[1,2,3]三唑 -4- 甲硫基)-4,6-二甲基嘧啶类化合物的制备及生物活性评价
2018-09-10杓学蓓李清寒杨学军
张 刚,杓学蓓,李清寒,杨学军
(西南民族大学化学与环境保护工程学院 中国成都610041)
嘧啶是一类重要的含氮六元杂环化合物,在制药工业上有着广泛的应用,许多研究结果证明嘧啶类化合物具抗菌、抗病毒、抗肿瘤及杀虫等药理特性[1-3].而且在DNA和RNA的结构中均发现具有嘧啶环结构.因此,基于嘧啶环结构进行药分子设计合成已成为目前药物化学研究的一个热点领域[4].现已经报道了许多不同结构的嘧啶衍生物及生物活性研究结果.特别是目前以嘧啶环结构为基础制备的嘧菌酯、嘧菌环胺、嘧霉胺及氟嘧菌胺等农药已在实际的粮食作物病虫害防治中得到了广泛的使用[5-8].为了进一步寻找高效低毒的新型药物,对嘧啶环进行修饰改造仍然是药物化学的研究热点.
1,2,3-三氮唑具有抗菌、抗炎、抗病毒、抗肿瘤、抗HIV等广泛的生物活性,常用于制药、染料、光稳定剂及防腐蚀剂的制备9-14],受到了药物化学家的高度重视.对于1,2,3-三氮唑化合物的经典合成通常是用炔烃和叠氮化合物通过在高温和使用固体支撑物来进行环化制得[15-17].近年来,文献报道了许多制备1,2,3-三氮唑化合物的新方法[18-22],特别是Click反应是一种非常有效的合成方法[23],因而大量的1,2,3-三氮唑化合物被合成了出来.目前对于1,2,3-三氮唑类衍生物的合成及生理活性的研究已有许多报道[24-26],但是对其中2-(1-取代-1H-[1,2,3]三唑-4-甲硫基)-4,6-二甲基嘧啶衍生物的制备及药理活性研究的报道相对较少.由于具有不同生理活性的官能团拼接在同一个分子结构中可显著改善化合物的生理活性,该研究在我们已取得的相关研究成果上[27-30],应用活性亚结构拼合的原理,将1,2,3-三氮唑功能团引入到2-巯基-4,6-二甲基嘧啶化合物中,设计合成系列新的2-(1-取代-1H-[1,2,3]三唑 -4- 甲硫基)-4,6- 二甲基嘧啶类衍生物,通过体外生物活性评价,初步筛选到具有良好抗肿瘤活性和实际应用前景的化合物.合成路线见图1.
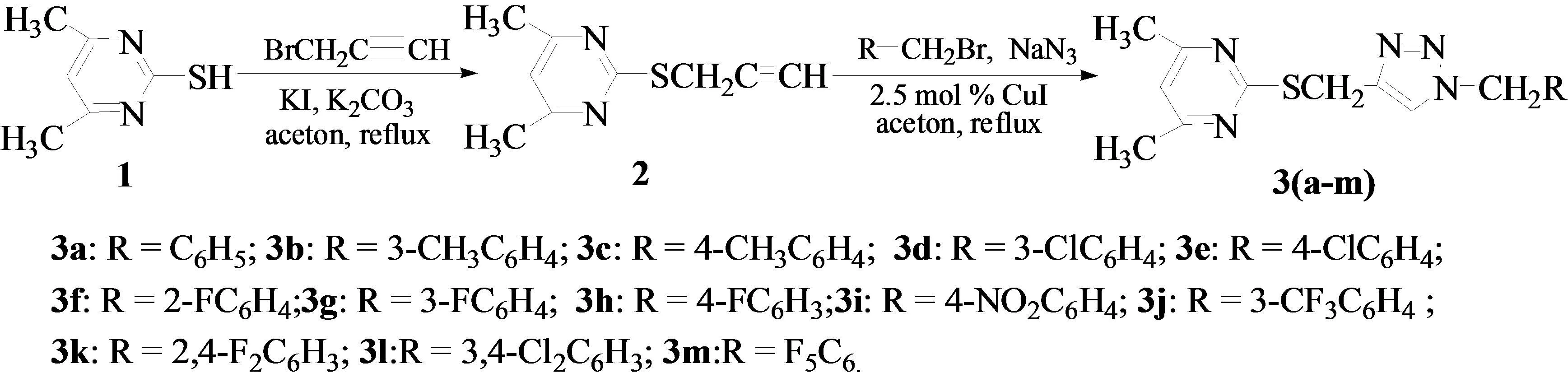
图1 化合物3(a~m)的制备路线
1 实验部分
1.1 仪器和试剂
1HNMR和13CNMR由Varian400MHz核磁共振仪(Me4Si为内标,CDCl3为溶剂)测定;化合物质谱分析由Finnigan-MAT4510型质谱仪测定(离子源为ESI);FT-IR169型红外光谱仪(固体用KBr压片,液体用液膜法);中间体1按照文献[27]合成;实验中所用试剂均为市售化学纯或分析纯,除特别注明外,其它试剂直接购买使用.
1.2 化合物2的合成
向干燥的50mL圆底烧瓶中加入中间体1(2.8g,20 mmol),无水碳酸钾(10.6g,100 mmol)及 3- 溴丙炔(1.9 mL,20 mmol),丙酮30 mL,加热回流反应3h,TLC跟踪反应进程.反应完毕后,将反应液冷却至室温,旋蒸除去溶剂,得粗品,柱层析(PE:EA =3:1)得纯品.黄色固体.收率98%.mp 90~91oC.1H NMR(400MHz,CDCl3,ppm) δ:6.65(s,1H,pyrimidine),3.90(s,2H,S-CH2),2.34(s,6H,CH3),2.10(s,1H,CH).13C NMR(CDCl3,100 MHz,ppm) δ:169.4,166.4,115.40,76.2,69.7,22.4,18.5.EI-MS(m/z):178(M+).
1.3 目标化合物3的合成
将中间体2(0.45g,2.5 mmol),叠氮化钠(0.17 g,2.5 mmol)和碘化亚铜(0.005 g,2.5 mol%)加入干燥无水的反应管中,在氮气保护下向反应管中加入溶剂丙酮(15 mL)以及取代苄溴(2.5 mmol),于油浴中回流3~4 h,TLC跟踪反应进程.反应完毕后,抽滤,弃去滤渣,将溶剂旋蒸干,得棕褐色油状物,经柱层析分离得到目标产物3(石油醚:乙酸乙酯=3:1),收率30-99%.
2-(1-苄基 -1H-[1,2,3]三唑 -4-甲硫基)-4,6-二甲基嘧啶(3a):淡黄色色固体.收率72%.m.p.92 ~ 94oC.1H NMR(400MHz,CDCl3,ppm) δ:7.41(s,1H,triazole),7.31-7.29(m,2H,Ar-H),7.24-7.22(m,1H,Ar-H),7.19-7.17(m,2H,Ar-H),6.67(s,1H,pyrimidine),5.41(s,2H,SCH2),4.48(s,2H,Ph-CH2),2.35(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:169.1,164.5,144.3,138.9,129.2,128.7,125.5,122.3,110.7,54.1,30.9,25.6.IR(KBr) ν:3142(Ar-H),2951(CH3),2914,1589(C = C),1534,1481,1432(CH2),1337,1266,1242,1040 cm-1;EI-MS(m/z):311.21(M+).
2-{1-(3-甲基苄基)-1H-[1,2,3]三唑 -4-甲硫基}-4,6-二甲基嘧啶(3b):淡黄色色固体.收率 30%.m.p.100~101oC.1H NMR(CDCl3,400 MHz,ppm) δ:7.42(s,1H,triazole),7.32-7.30(m,1H,Ar-H),7.18-7.16(m,3H,Ar-H),6.68(s,1H,pyrimidine),5.42(s,2H,S-CH2),4.47(s,2H,Ph-CH2),2.35(s,6H,CH3),2.32(s,3H,Ph-CH3).13C NMR(CDCl3,100 MHz,ppm) δ:170.1,167.0,145.7, 138.9, 134.5, 129.4, 128.9, 128.7,125.1, 122.3, 115.8, 54.1, 30.9, 25.6, 23.8.IR(KBr) ν:3147(Ar-H),2955(CH3),2918,1588(C= C),1532,1486,1435(CH2),1339,1269,1241,1041 cm-1.ESI-MS m/z(%):325.98(M+)
2-{1-(4-甲基苄基)-1H-[1,2,3]三唑 -4-甲硫基}-4,6-二甲基嘧啶(3c):淡黄色色固体.收率 56%.m.p.90~91oC.1H NMR(CDCl3,400 MHz,ppm),δ:7.39(s,1H,triazole),7.31(d,J =8.4 Hz,2H,Ar-H),7.14(d,J = 3.6 Hz,2H,Ar-H),6.68(s,1H,pyrimidine),5.42(s,2H,S-CH2),4.47(s,2H,Ph-CH2),2.36(s,6H,CH3),2.34(s,3H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:170.2,167.1,143.2, 138.6, 133.2, 129.7, 129.3, 128.1,53.9,30.9,25.8,23.8.IR(KBr) ν:3128(Ar-H),2917(CH3),1580(C = C),1530,1437(CH2),1265,1211,1056 cm-1.ESI-MS m/z(%):326.0 9(M+1).
2-{1-(3-氯苄基)-1H-[1,2,3]三唑 -4-甲硫基}-4,6-二甲基嘧啶(3d):白色固体.m.p.88~89 °C. 收率 80%.1H NMR(CDCl3,400 MHz,ppm),δ:7.45(s,1H,triazole),7.31-7.28(m,2H,Ar-H),7.20(s,1H,Ar-H),7.10(d,J = 6.8 Hz,1H,Ar-H),6.69(s,1H,pyrimidine),5.44(s,2H,S-CH2),4.48(s,2H,Ph-CH2),2.36(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm).δ:170.0,167.1 146.1, 136.6, 134.9, 130.3, 128.8, 127.9,126.3,122.3,115.8,53.3,30.9,25.5.IR(KBr) ν:3140(Ar-H),2952(CH3),1590(C = C),1539,1435(CH2),1392,1268,1039cm-1.ESI-MS m/z(%):346.04(M+1)
2-{1-(4-氯苄基)-1H-[1,2,3]三唑 -4-甲硫基}-4,6-二甲基嘧啶(3e):淡黄色固体.收率99%.m.p.105 ~106 °C.1H NMR(CDCl3,400 MHz,ppm),δ:7.44(s,1H,triazole),7.31(d,J =8.4 Hz,2H,Ar-H),7.09(t,J = 8.4 Hz,2H,Ar-H),6.70(s,1H,pyrimidine),5.44(s,2H,S-CH2),4.47(s,2H,Ph-CH2),2.36(s,6H,CH3).13C NMR(CDCl3,100 MHz, ppm) δ:170.2,167.1, 146.0,134.8,133.2,129.3,129.2,122.1,115.9,53.3,30.9,25.5.IR(KBr) ν:3164(Ar-H),2920(CH3),1578(C = C),1528,1473,1435(CH2),1343,1244,1016 cm-1.ESI-MS m/z(%):345.97(M+).
2-{1-(2-氟苄基)-1H-[1,2,3]三唑 -4-甲硫基}-4,6-二甲基嘧啶 (3f):白色固体.m.p.91 ~92 °C.收率79.18%.1H NMR(CDCl3,400 MHz,ppm),δ:7.52(s,1H,triazole),7.31(q,J =7.6 Hz,1H,Ar-H),7.21(t,J = 6.8 Hz,1H,Ar-H),7.11(q,J =6.4 Hz,2H,Ar-H),6.68(s,1H,pyrimidine),5.51(s,2H,S-CH2),4.46(s,2H,Ph-CH2),2.36(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:170.1,167.1,161.3,145.9,130.8,130.8, 130.6, 124.8, 122.5, 115.8, 47.6, 25.6,23.7.IR(KBr) ν:3151(Ar-H),2958(CH3),1585(C = C),1535,1492,1431(CH2),1272,1235,1170,1123,1046 cm-1.ESI-MS m/z(%):330.14(M+1)
2-{1-(3-氟苄基)-1H-[1,2,3]三唑 -4-甲硫基}-4,6-二甲基嘧(3g):黄色固体.收率67%.m.p.75 ~ 76oC.1H NMR(CDCl3,400 MHz,ppm),δ:7.48(s,1H,triazole),7.34-7.30(m,1H,Ar-H),7.20(s,1H,Ar-H),7.06-7.02(m,1H,Ar-H),6.90(d,J = 9.6 Hz,1H,Ar-H),6.71(s,1H,pyrimidine),5.48(s,2H,S-CH2),4.49(s,2H,Ph-CH2),2.37(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:170.1,167.1,162.3,141.8,137.8,130.5,128.4,124.2,122.5,115.9,112.6,52.9,25.5,23.8.IR(KBr) ν:3152(Ar-H),2953(CH3),1577(C = C),1519,1438(CH2),1343,1248,1241,1045 cm-1.ESI-MS m/z(%):330.12(M+1)
2-{1-(4-氟苄基)-1H-[1,2,3]三唑 -4-甲硫基}-4,6-二甲基嘧啶(3h):淡黄色固体.收率 90%.m.p.75 ~ 76oC.1H NMR(CDCl3,400 MHz,ppm),δ:7.49(s,1H,triazole),7.29(d,J = 7.6 Hz,2H,Ar-H),7.09(d J = 8.0 Hz,2H,Ar-H),6.75(s,1H,pyrimidine),5.53(s,2H,S-CH2),4.48(s,2H,Ph-CH2),2.36(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:169.9,167.1,160.3,143.3,135.9,131.3, 129.8, 125.5, 115.8, 53.4, 35.5, 23.7.IR(KBr) ν:3167(AR-H),2988(CH3),2957,1582(C= C),1514,1473,1439(CH2),1343,1218,1049 cm-1.ESI-MS m/z(%):329.96(M+).
2-{1-(4-硝基苄基)-1H-[1,2,3]三唑 -4-甲硫基}-4,6-二甲基嘧啶(3i):淡黄色固体.收率 82%.m.p.97~98oC.1H NMR(CDCl3,400 MHz,ppm) δ:8.16(d,J =8.4 Hz,2H,Ar-H),7.48(s,1H,triazole),7.32(d,J = 8.8 Hz,2H,Ar-H),6.67(s,1H,pyrimidine),5.56(s,2H,S-CH2),4.47(s,2H,Ph-CH2),2.34(s,6H,CH3).13C NMR(CDCl3, 100 MHz, ppm) δ: 170.0, 164.1, 146.1,142.3,137.1,130.3,123.4,122.3,115.8,53.4,30.9,25.5.IR(KBr) ν:3146(Ar-H),2956(CH3),2920,1590(C = C),1533,1450(CH2),1254,1241,1042 cm-1.ESI-MS m/z(%):356.95(M+)
2-{1-(3-三氟甲基苄基)-1H-[1,2,3]三唑-4-甲硫基}-4,6-二甲基嘧啶(3j):淡黄色固体.收率73%.m.p.67 ~68oC.1H NMR(CDCl3,400 MHz,ppm) δ:7.49(s,1H,triazole),7.45-7.43(m,3H,Ar-H),7.41(d,J =8.4 Hz,1H,Ar-H),6.68(s,1H,pyrimidine),5.42(s,2H,S-CH2),4.47(s,2H,Ph-CH2),2.36(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:167.3,164.2,143.1,138.5,133.2,131.6,129.3, 129.6, 128.1, 124.2, 122.3, 115.8,53.8,30.9,25.8.IR(KBr) ν:3134(Ar-H),2970(CH3),2925,1581(C = C),1540,1438(CH2),1341,1265,1157,1112,1048 cm-1.ESI-MS m/z(%):380.09(M+1).
2-{1-(2,4- 二氟苄基)-1H-[1,2,3]三唑-4-甲硫基}-4,6-二甲基嘧啶(3k):黄色固体.收率 73%.m.p.95~96oC.1H NMR(CDCl3,400 MHz,ppm),δ:7.53(s,1H,triazole),7.27-7.23(m,1H,Ar-H),7.10(d,J =8.8 Hz,2H,Ar-H),6.68(s,1H,pyrimidine),5.46(s,2H,S-CH2),4.45(s,2H,Ph-CH2),2.37(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:170.1,167.2,164.5,161.9,159.3,145.9,131.8, 122.4, 115.9, 112.1, 104.23, 46.9,29.6,25.5.IR(KBr) ν:3158(Ar-H),2961(CH3),2910,1587(C = C),1507,1492,1427(CH2),1273,1243,1219,1170,1138,1046 cm-1.ESI-MS m/z(%):347.99(M+)
2-{1-(3,4- 二氯苄基)-1H-[1,2,3]三唑-4-甲硫基}-4,6-二甲基嘧啶(3l):淡黄色固体.收率34%.m.p.98 ~101oC.1H NMR(CDCl3,400 MHz,ppm),δ:7.42(s,1H,triazole),7.39(d,J =7.6 Hz,1H,Ar-H),7.15(d,J = 7.6 Hz,1H,Ar-H),7.04(d,J =7.4 Hz,1H,Ar-H),6.68(s,1H,pyrimidine),5.40(s,2H,S-CH2),4.46(s,2H,Ph-CH2),2.35(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:169.9,167.1,146.3,134.8,133.2,133.0, 131.0, 129.8, 122.2, 115.9, 52.7, 30.9,25.6.IR(KBr) ν:3122(Ar-H),2955(CH3),2923,1582(C = C),1532,1473,1442(CH2),1261,1241,1033 cm-1.ESI-MS m/z(%):380.30(M+1)
2-{1-(2,3,4,5,6- 五氟苄基)-1H-[1,2,3]三唑-4-甲硫基}-4,6-二甲基嘧啶(3m):白色固体.收率98%.m.p.67~68oC.1H NMR(CDCl3,400 MHz,ppm) δ:7.60(s,1H,triazole),6.69(s,1H,pyrimidine),5.54(s,2H,S-CH2),4.44(s,2H,Ph-CH2),2.38(s,6H,CH3).13C NMR(CDCl3,100 MHz,ppm) δ:170.0,167.1,146.2,139.5,135.8,122.4,115.9,112.2,50.7,30.9,25.4.IR(KBr) ν:3141(Ar-H),2994(CH3),1661,1578(C = C),1509,1439(CH2),1368,1273,1123,1123,1025 cm-1.ESI-MS m/z(%):401.96(M+)
1.4 目标化合物(3)对细胞周期分裂蛋白25B(CDC25B)的抑制活性测试
由于细胞周期分裂蛋白25B(CDC25B)具有原癌基因的特性,通过在体外测试目标化合物对细胞周期分裂蛋白25B(CDC25B)增殖的抑制率大小可初步评价目标化合物的抗癌强弱.
测试方法[28]:首先用CDC25B对荧光底物OMFP进行去磷酸化处理得到OMF,然后用485 nm的光激发OMF产生535 nm的可检测的荧光信号,通过观察酶的活性变化情况以及测试样品对酶的抑制作用得出目标物对细胞周期分裂蛋白25B(CDC25B)的抑制活性大小.实验中所采用的阳性参照化合物为Na3VO4,阴性参照物为DMSO.
2 结果与讨论
2.1 溶剂对反应的影响
首先以CuI为催化剂,对溶剂进行了筛选,实验结果表明,丙酮的反应效果优于乙醇,其目标物三氮唑的分离收率可达72%.因此丙酮是该反应的最佳溶剂.
2.2 金属铜对反应的影响
以丙酮为反应溶剂对金属铜盐进行了筛选,实验结果表明,CuI的催化效果优于 CuBr,CuCl,CuBr2及CuO的催化效果,其目标物三氮唑的分离收率可达72%.因此,CuI是该反应的最佳催化剂.
由此确定该反应的最佳反应条件为:2.5%mol CuI做催化剂,丙酮作溶剂,60℃回流反应(表1,序号2).
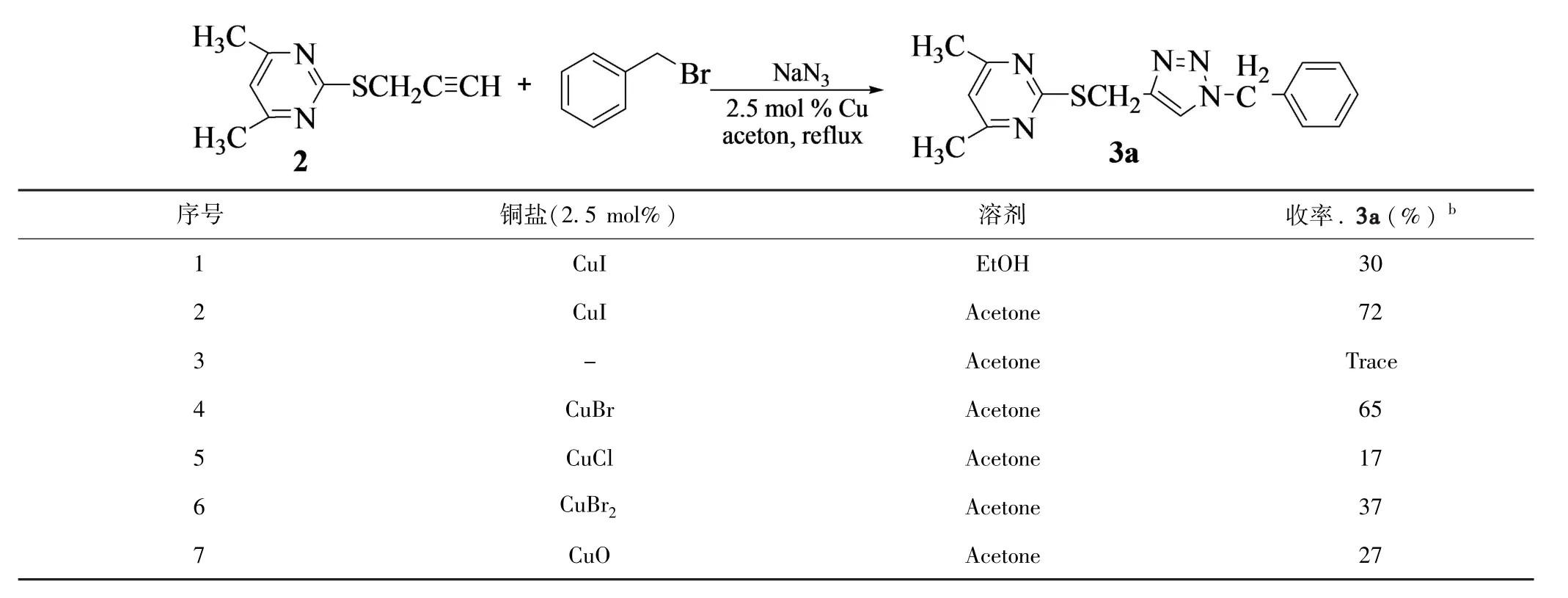
表1 金属铜和溶剂对反应的影响aTable 1 Effect of the copper source,solvent and amount of catalyst on the reaction.a
a2.5 mmol 2,2.5 mmol叠氮化钠,2.5 mmol苄溴,铜盐 (2.5 mol%),2 mL 丙酮,60oC,4h;b分离产率.
2.3 目标化合物3的合成
在最佳的反应条件下,考察了不同结构的底物在该反应中的适应性,研究了不同的取代苄溴与2-(2-丙炔)硫基-4,6-二甲基嘧啶(2)的Click反应,结果见表2所示.从表2中的结果可以看出,以2.5 mol%CuI催化取代苄溴与2-(2-丙炔)硫基-4,6-二甲基嘧啶(2)进行Click反应可以顺利的得到目标产物2-(1-取代苄基-1H-[1,2,3]三唑 -4-甲硫基)-4,6-二甲基嘧啶衍生物3(a~m),其分离收率为30~99%(表2,序号1~13).从表3中可以看出,取代苄溴的结构对目标化合物3的合成有较大的影响.当芳环上连有吸电子基团如NO2和卤素(X)时,反应容易进行且收率高,如用对氟苄溴来制备目标化合物时,反应的收率可达90%;但当氟位于苯环的邻位时,收率则降低为80%,这可能是由于处于邻位的氟的空间位阻效应大于其吸电子的诱导效应所致;当苯环上连有推电子基团如甲基(CH3)时,收率相对较低,如用3-甲基苄溴来制取目标化合物时,其收率为30%.
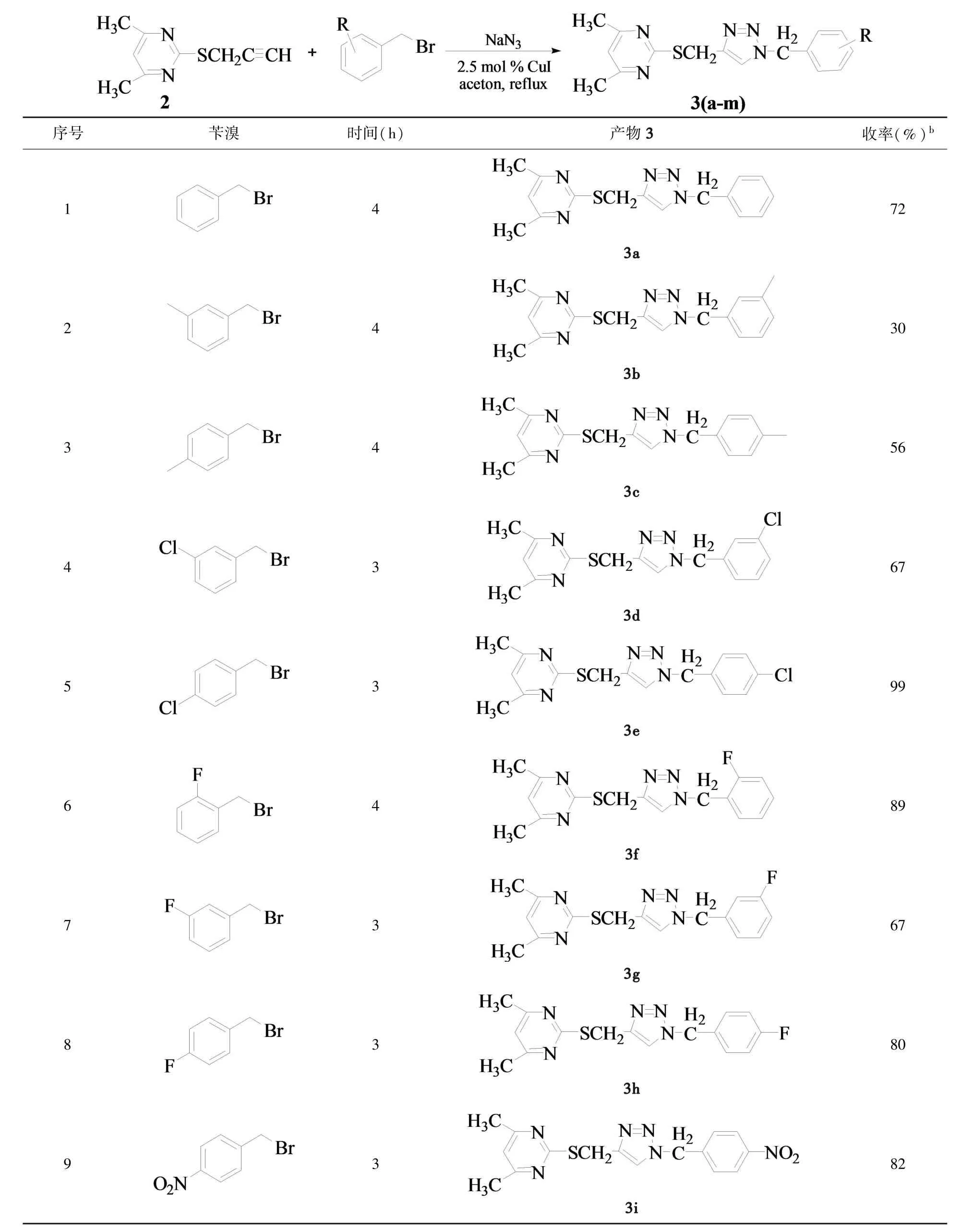
表2 目标化合物3(a~m)的合成aTable 2 Synthesis of compounds 3(a~m).a
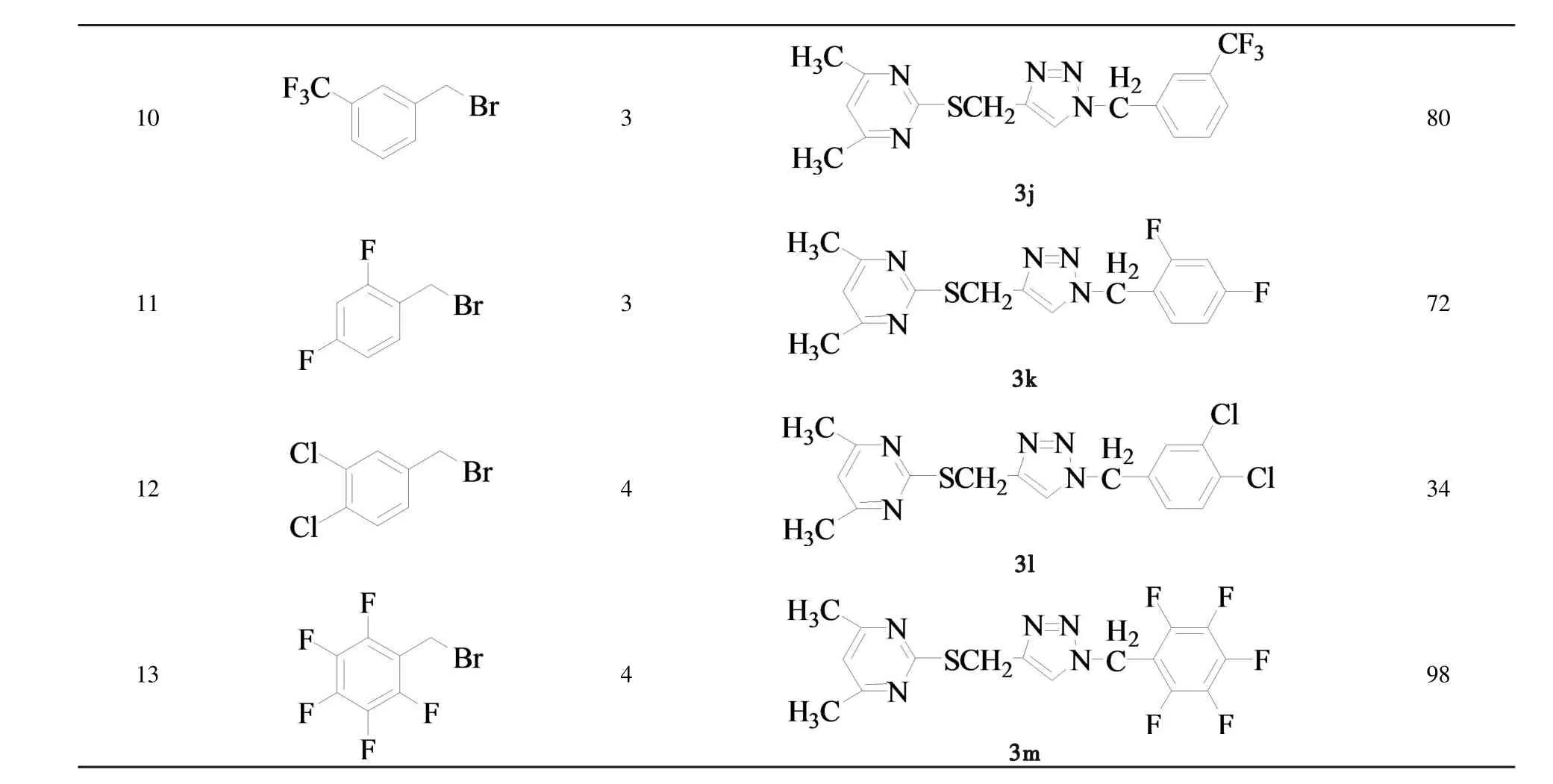
a2.5mmol 2,2.5mmol苄溴,2mL丙酮.b分率产率.
2.4 目标化合物的抗肿瘤活性
表3列出了抗肿瘤活性测试的结果,在目标化合物浓度为 20 μM 时,化合物3(b,c,g,h)有一定的抗CDC25B增殖的活性,其抑制率为43.30-45.86%,其中化合物3g对 CDC25B增殖的抑制率达到了45.86%.从测试的结果中可以看出在芳环上的对位或间位引入推电子基(甲基)或拉电子基(氟)时,目标化合物分子均能表现出一定的抑制CDC25B增殖的作用.但是,所合成的目标物分子对CDC25B增殖活性的抑制作用总体均很低.这可能与我们所选择的肿瘤细胞模型有限及所合成的化合物数量偏少有关.不过,通过用带不同取代基的芳基对1,2,3-三氮唑化合物的1位进行进一步的结构修饰有可能改善目标物分子对CDC25B增殖的抑制作用.
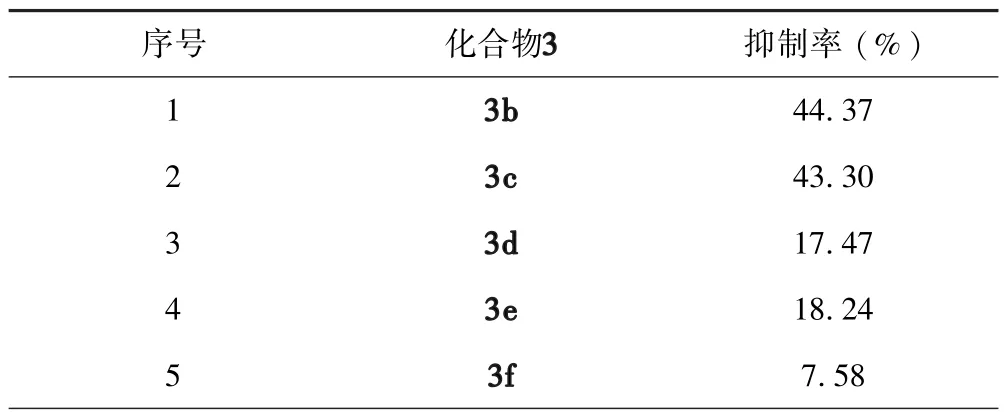
表3 化合物3(b-m)对CDC25B的抑制活性aTable 3 The inhibition rates for CDC25B of the compounds 3(b-m)in vitro.a
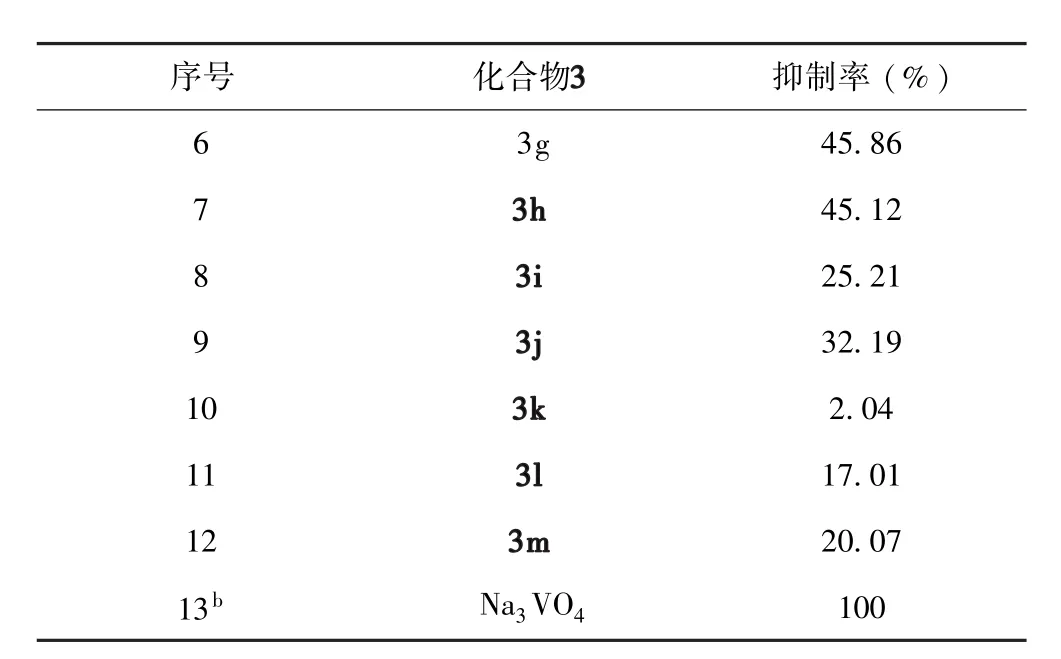
a化合物浓度:20 μg/mL;b标准药物.
3 结论
本文以2-巯基-4,6-二甲基嘧啶和3-溴丙炔为原料,经取代反应制备了中间体2-(2-丙炔)硫基-4,6-二甲基嘧啶(2).然后以丙酮作溶剂,碘化亚铜为催化剂,化合物2、取代苄溴和叠氮化钠经Click反应合成了13个新的2-(1-取代苄基-1H-[1,2,3]三唑 -4- 甲硫基)-4,6- 二甲基嘧啶衍生物3(a~m).体外生物活性测试表明,该类化合物对所选模型的抑制活性较差.由于测试的模型有限及所合成的化合物数量偏少,尚需在今后的研究中进一步的扩展模型及合成更多不同结构的目标化合物进行抗肿瘤活性研究,深入探讨其结构与生物活性之间的关系.
