益生菌联合肠内营养制剂对炎症性肠病的疗效观察
2018-09-10王若晨
王若晨, 韩 婷, 李 伟
(同济大学附属第十人民医院临床营养科,上海 200072)
炎症性肠病(inflammatory bowel disease, IBD)是一组病因未明的慢性复发性肠道炎症性疾病,主要包括溃疡性结肠炎(ulcerative colitis, UC)与克罗恩病(Crohn’s disease, CD)。营养不良是其常见的临床表现,可导致IBD迁延不愈甚至恶化。随着病情的加重,患者的营养不良程度会进一步加剧。因此,在IBD的治疗中,营养支持越来越受到重视[1]。近年来,肠道微生态的研究不断深入,关于益生菌治疗IBD效果的研究也逐渐增多。大量研究[2-8]表明,肠道内菌群失调、有益的细菌缺乏等与IBD的发病有很大的关联。补充益生菌有调节肠道微生物群,增强肠道微生物屏障的功能。虽然益生菌作为营养补充剂在IBD患者中已经大量使用,但益生菌对IBD治疗有效的证据仍不充分[9]。本研究总结了120例IBD患者的临床资料,探讨益生菌联合肠内营养制剂在IBD治疗中的效果,此报告如下。
1 资料与方法
1.1 一般资料
收集2016年1月—2017年3月于同济大学附属第十人民医院接受治疗的IBD患者,剔除住院<3d、处于孕期或者哺乳期、有严重心、肝、肺疾病、营养风险筛查2002(NRS-2002)评分<3分[10]、已经进行营养支持的患者。将符合本研究条件的120例IBD患者随机分为观察组60例和对照组60例。观察组60例,其中UC 28例,CD 32例;对照组60例,其中UC 29例,CD 31例。观察组为应用益生菌联合肠内营养制剂的IBD患者,对照组为单独应用肠内营养制剂的IBD患者。
1.2 营养状况评定
使用患者整体营养状况评估表(PG-SGA)进行营养状况评定[11],根据患者体质量丢失、疾病状态、代谢应激、体格检查等状况评定患者入院时营养状态。根据评分,将IBD患者的营养状况分为: 重度营养不良(≥9分)、中度营养不良(4~8分)、营养正常(0~3分)[11-12]。
1.2 方法
1.2.1 营养支持方法 患者营养治疗常规选择短肽型肠内营养制剂。观察组为肠内营养制剂联合益生菌(口服酪酸梭菌活菌片),对照组仅使用肠内营养制剂。两组患者每日热量摄入为104.6~125.52kJ/kg,均使用部分肠内营养(enteral nutrition, EN)维持缓解,EN提供的热量占患者每日总热量的60%(提供能量3138~4184kJ),其余40%由营养师配餐执行(给予易消化半流餐,提供能量2092~2928.8kJ)。为保证肠内营养完全摄入,两组患者均采取管饲给予肠内营养制剂。观察组除肠内营养制剂外,每天口服酪酸梭菌活菌片,每次20mg,3次/d。
1.2.2 观察指标 分别观察干预10d后,IBD患者对照组和观察组干预前后的临床指标变化,包括体质量、体质量指数(body mass index, BMI)、C反应蛋白(C-reactive protein, CRP)、红细胞沉降率(erythrocyte sedimentation rate, ESR)、血小板计数(platelet count, PLT)、总蛋白(total protein, TP)、血红蛋白(hemoglobin, Hb)、白蛋白(albumin, Alb)、前白蛋白(prealbumin, PA)、尿素氮(blood urea nitrogen, BUN)、葡萄糖(glucose, Glu)、电解质等,同时观察干预前后患者的腹泻情况。
1.3 统计学处理
2 结 果
2.1 一般情况
观察组60例,男性36例,女性24例,平均年龄(36.8±13.9)岁;对照组60例,男性35例,女性25例,平均年龄(36.2±14.1)岁。两组患者性别、病种、年龄、病史、用药、疾病活动度CDAI评分等差异均无统计学意义,具有可比性。根据PG-SGA评分,评定两组患者入院时的营养状况: 观察组重度营养不良者8例,中度营养不良者29例,营养正常者23例;对照组重度营养不良者8例,中度营养不良者25例,营养正常者27例;两组在干预前的营养状况差异无统计学意义。
2.2 营养疗效
本研究中120例IBD患者进行干预后,观察组淋巴细胞数(lymphocytes, LY)、PLT、TP、Hb、PA、K+明显高于对照组(P<0.05)。观察组干预后与干预前相比,体质量、BMI、白细胞数(leukocyte count, WBC)、中性粒细胞数(neutrophil count, NEUT)、LY、PLT、TP、Hb、Alb、BUN、Glu、K+均有显著增高(P<0.05)。对照组中,干预后与干预前相比,体质量、BMI、PLT均有增高(P<0.05),见表1。
本研究中观察组中的28例UC患者,干预后红细胞数(red blood cells, RBC)、TP、Hb、Alb、PA、K+明显高于对照组(P<0.05)。观察组进行干预后,体质量、BMI、RBC、TP、Hb、Alb、PA、BUN、K+比干预前均有增高(P<0.05)。对照组干预后体质量、BMI比干预前均有增高(P<0.05);Alb、PA、K+均有增高但差异无统计学意义(P>0.05),见表2。
表1IBD患者干预前后营养指标比较


项目对照组(n=60)观察组(n=60)干预前干预后干预前干预后体质量/kg54.49±9.6356.05±9.7#55.33±10.4656.92±10.02#BMI/(kg·m-2)19.25±2.8219.8±2.79#19.55±2.8320.08±2.61#WBC(×109)/(L-1)7.19±2.86.01±2.26.37±2.555.95±1.91#RBC(×1012)/(L-1)4.23±0.634.14±0.564.15±0.664.30±0.51NEUT(×109)/(L-1)4.78±2.343.94±1.764.2±2.263.44±1.63#LY(×109)/(L-1)1.75±0.641.59±0.711.53±0.731.91±0.69*#PLT(×109)/(L-1)326±137.63269.84±79.55#289.29±96.81299±109.9*#TP/(g·L-1)69.7±7.8168.27±6.469±7.5271.81±7.12*#Hb/(g·L-1)116.45±20115.9±18.81113.57±22.03122.4±18.5*#Alb/(g·L-1)38.73±6.340.14±4.4239.52±6.1241.89±5.68#PA/(mg·L-1)218.39±77.2252.1±59.53220.21±69.61300±55.9*#BUN/(mmol·L-1)4.38±1.174.56±1.194.52±1.754.86±1.17#Glu/(mmol·L-1)4.42±0.814.57±0.534.78±0.84.92±1.13#K+/(mmol·L-1)3.97±0.413.95±0.343.82±0.44.19±0.37*#Cl-/(mmol·L-1)101.79±3.34102.68±2.68102.14±5.8103.27±3.4
与观察组相比,*P<0.05;干预前相比,#P<0.05
表2UC患者干预前后营养指标比较

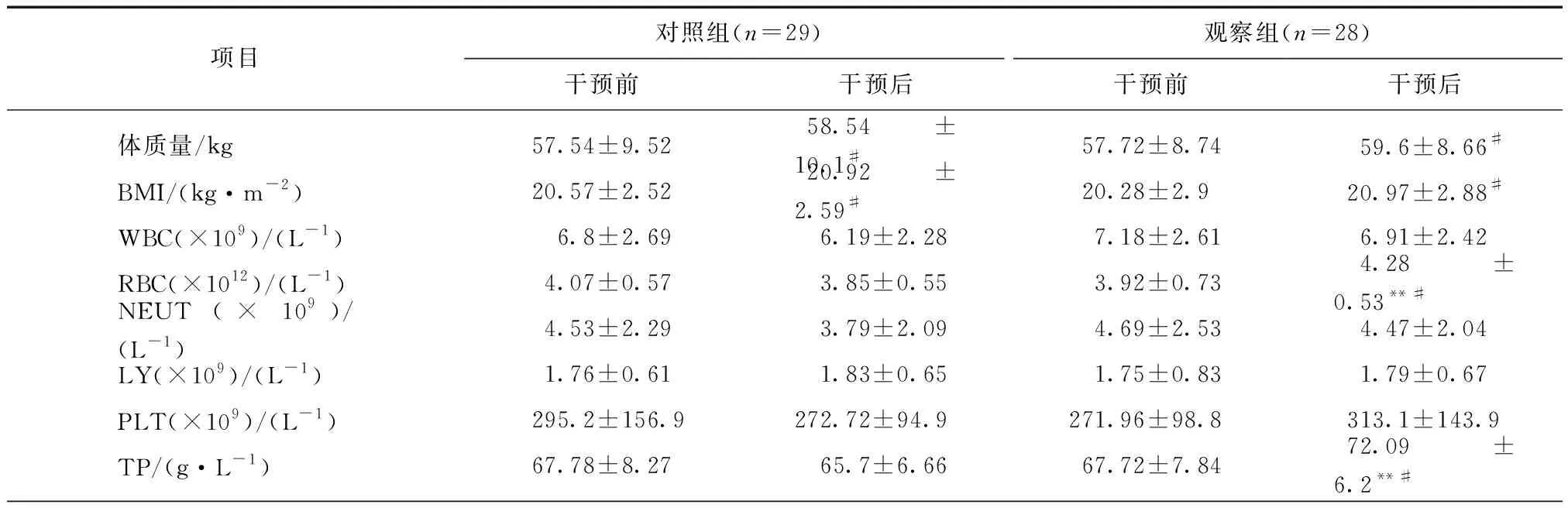
项目对照组(n=29)观察组(n=28)干预前干预后干预前干预后体质量/kg57.54±9.5258.54±10.1#57.72±8.7459.6±8.66#BMI/(kg·m-2)20.57±2.5220.92±2.59#20.28±2.920.97±2.88#WBC(×109)/(L-1)6.8±2.696.19±2.287.18±2.616.91±2.42RBC(×1012)/(L-1)4.07±0.573.85±0.553.92±0.734.28±0.53**#NEUT(×109)/(L-1)4.53±2.293.79±2.094.69±2.534.47±2.04LY(×109)/(L-1)1.76±0.611.83±0.651.75±0.831.79±0.67PLT(×109)/(L-1)295.2±156.9272.72±94.9271.96±98.8313.1±143.9TP/(g·L-1)67.78±8.2765.7±6.6667.72±7.8472.09±6.2**#

(续表2)
与观察组相比,*P<0.05,**P<0.01;与干预前相比,#P<0.05
本研究中观察组中的32例CD患者,干预后PA、K+高于对照组(P<0.05)。观察组干预后体质量、BMI、LY、Alb、PA、K+均比干预前有显著增高(P<0.05)。对照组中,干预前后相比,干预后体质量、BMI、WBC、NEUT、PLT、Alb、PA、BUN、Cl-均有增高(P<0.05),见表3。
表3CD患者干预前后营养指标比较


项目对照组(n=31)观察组(n=32)干预前干预后干预前干预后体质量/kg52.13±9.1854.13±9.08#53.04±11.5854.35±10.72#BMI/(kg·m-2)18.23±2.6318.94±2.65#18.85±2.6319.22±2.02#WBC(×109)/(L-1)7.5±2.855.14±1.56#5.59±2.275.79±1.6RBC(×1012)/(L-1)4.36±0.654.42±0.434.36±0.514.32±0.5NEUT(×109)/(L-1)4.98±2.363.18±1.16#3.73±1.93.43±1.3LY(×109)/(L-1)1.74±0.671.39±0.71.33±0.581.96±0.72#PLT(×109)/(L-1)346.13±117267.08±63.17#305.96±93.73288.1±76.5TP/(g·L-1)71.13±7.2571.61±7.8270.28±7.170.64±5.22Hb/(g·L-1)116.77±17.5120.13±16.6115.12±19.49118.5±16.72Alb/(g·L-1)39.13±6.7241.65±6.15#40.96±5.241.92±3.89#PA/(mg·L-1)214.33±84.2255.08±46.1#225.93±51.36307±57.6*#BUN/(mmol·L-1)4.09±1.24.89±1.23#5.18±1.84.89±0.92Glu/(mmol·L-1)4.4±0.684.88±14.59±0.664.62±0.47K+/(mmol·L-1)4.06±0.414.03±0.243.95±0.284.2±0.33*#Cl-/(mmol·L-1)101.2±3.15102.7±2.62#101.52±7.37103.7±3.13
与观察组相比,*P<0.05;与干预前相比,#P<0.05
2.3 免疫及炎性疗效
本研究中120例IBD患者进行干预后,观察组IgA高于对照组,IgG低于对照组(P<0.05)。观察组中,干预前后相比,干预后IgA有增高(P<0.05);干预后CRP、ESR、IgG均有下降(P<0.05)。对照组中,干预前后相比,干预后IgA显著升高,CRP、ESR、IgG均有下降(P<0.05)。对照组和观察组干预前后相比,腹泻发生率有明显降低(P<0.05);观察组干预后腹泻发生率低于对照组干预后但差异没有统计学意义(P>0.05),见表4。
本研究中57例UC患者进行干预后,观察组IgA高于对照组,IgG低于对照组(P<0.05)。观察组中,干预后IgA有显著增高,CRP、ESR、IgG显著下降(P<0.05)。对照组中,干预后与干预前相比,IgA显著升高,CRP、IgG有下降(P<0.05)。对照组和观察组干预后的腹泻发生率均有明显降低(P<0.05);观察组干预后腹泻发生率低于对照组干预后,但差异无统计学意义(P>0.05),见表5。
本研究中63例CD患者进行干预后,观察组IgG显著低于对照组(P<0.05)。观察组中,干预前后相比,干预后IgA有显著增高(P<0.05),CRP、ESR、IgG降低(P<0.05)。对照组中,干预后IgA显著高于干预前(P<0.05),CRP、ESR均有下降(P<0.05)。对照组和观察组干预前后相比,干预后腹泻发生率有明显降低(P<0.05);观察组干预后腹泻发生率与对照组干预后相比较有下降趋势,但差异无统计学意义(P>0.05),见表6。

表4 IBD患者免疫及炎性观察指标比较Tab.4 Comparison of immune and inflammatory indexes in IBD patients
与观察组相比,*P<0.05;与干预前相比,#P<0.05;ESR为第1小时末数据
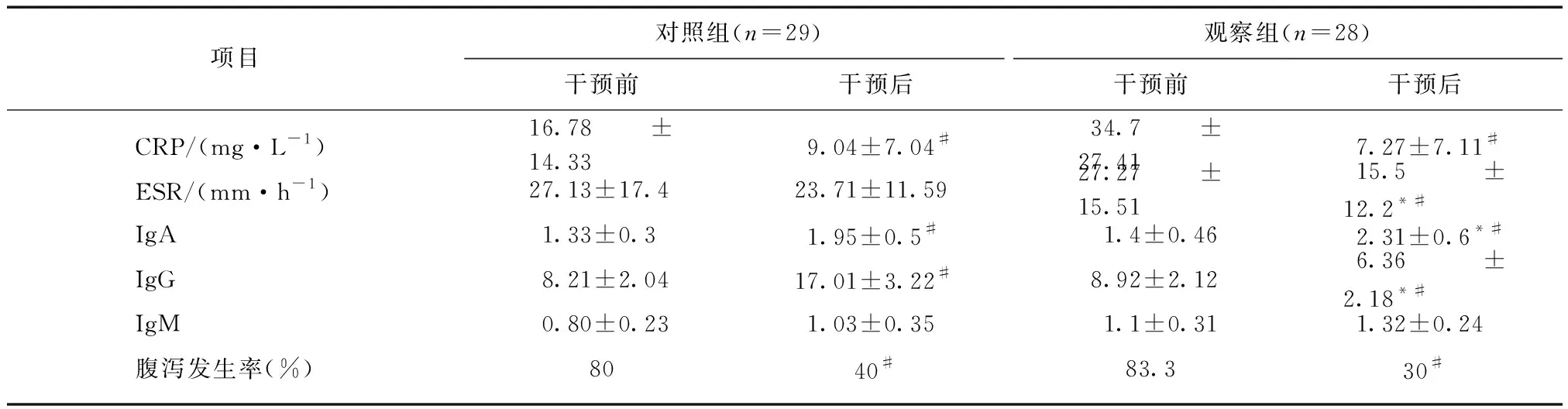
表5 UC患者免疫及炎性观察指标比较Tab.5 Comparison of immune and inflammatory indexes in UC patients
与观察组相比,*P<0.05;与干预前相比,#P<0.05;ESR为第1小时末数据
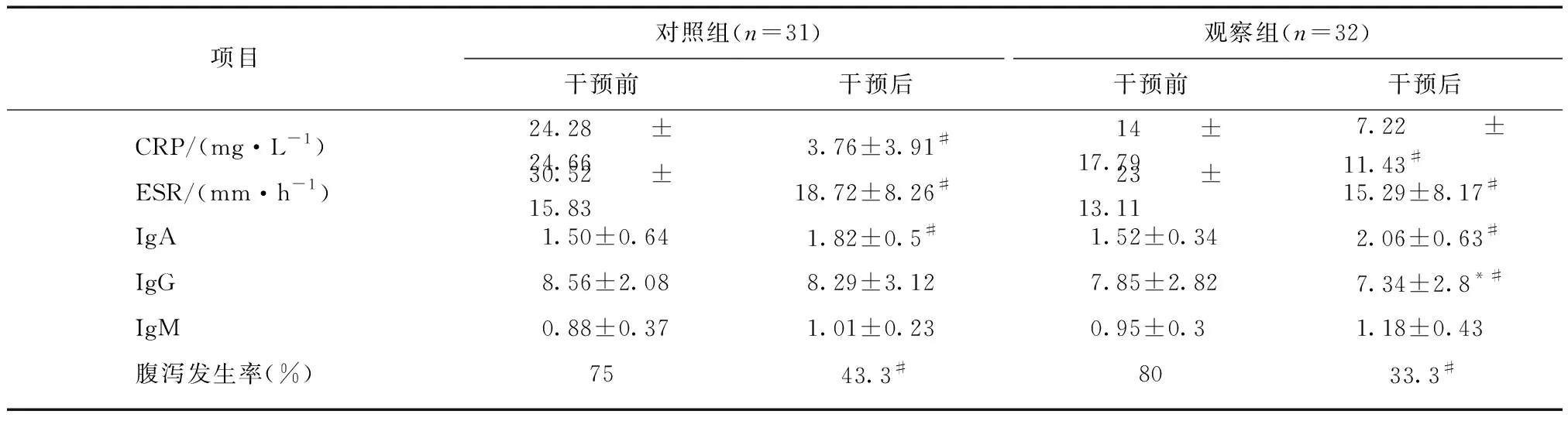
表6 CD患者免疫及炎性观察指标比较Tab.6 Comparison of immune and inflammatory indexes in CD patients
与观察组相比,*P<0.05;与干预前相比,#P<0.05;ESR为第1小时末数据
3 讨 论
近年来,我国IBD患病率逐渐上升,IBD已经成为消化系统常见病。UC和CD作为IBD的两大类,在治疗方面有共性也有特异性。本研究在讨论益生菌结合肠内营养对于IBD患者治疗效果的基础上,又分别探讨了其对UC和CD患者的影响。
IBD患者由于营养摄入减少、丢失增加、吸收能力下降、能量消耗增加和治疗药物等因素的影响[13],常会出现营养不良的症状,这是IBD最常见的全身症状之一[14]。营养支持能够提供人体所需的营养物质,使患者的营养不良状态有所缓解,这有利于肠道功能康复,在一定程度上减轻机械性及化学性刺激,调节炎性反应,改善负氮平衡,促进病变肠道黏膜愈合,从而有助于病情的改善[1]。在选择营养途径方面,遵循“只要肠道有功能,就应该使用肠道,即使部分肠道有功能,也应该使用这部分肠道”的原则[15],首选EN制剂[16]。研究[17]显示,EN制剂能够通过改善肠道内菌群环境和减少蛋白质、脂肪等致病抗原的含量,以达到降低肠道黏膜抗原暴露程度的目的,并且其营养作用有利于修复肠黏膜,防止丢失蛋白质。营养制剂除对IBD患者提供补充支持作用外,还可通过影响黏膜细胞因子减轻肠道炎症,有利于维护肠道菌群平衡、肠黏膜屏障功能,避免肠黏膜萎缩。有研究[18]报道,根据不同患者的耐受程度选择短肽型或整蛋白型EN制剂,使用这两种类型的营养制剂,疗效无明显差异。在本研究中使用的EN制剂为短肽型百普力。干预后与干预前相比,对照组IBD患者其体质量、BMI、PLT、IgA等指标均有改善,CRP、ESR、IgG指标下降,提示患者营养状态有好转,炎性反应降低,病情程度有所缓解,表明EN支持有效,与文献报道一致。
炎症性肠病[19]是由多因素相互作用所致,包括环境、感染、遗传、免疫等因素,而免疫紊乱为最主要的原因,各种细胞因子参与了IBD免疫反应和炎症过程,这已经达成了广泛的共识。越来越多的研究[20]显示,IBD的患病机制与肠道微生物菌群失衡密切相关。有研究[21]认为UC和结肠黏膜的屏障障碍及机体对肠道共生菌群的过度免疫反应相关。失调的肠内菌群可产生持续的抗原刺激,并导致慢性肠道损伤和异常的免疫反应[22]。在IBD治疗中添加益生菌可能通过以下方式发挥作用: 促进肠道菌群平衡、改善肠道屏障功能、调节肠道黏膜免疫功能、调节营养物质代谢[9]。同时,肠内营养相关性腹泻是肠内营养常见的并发症,益生菌能作为肠内营养相关性腹泻的保护因素[23]。本研究表明IBD患者应用益生菌联合肠内营养能有效改善患者营养状况。与孙丽娟等[8]研究常规肠内营养制剂与添加益生菌的低脂高蛋白肠内营养制剂的结果基本一致,TB、PLT、LY在两组间差异有统计学意义(P<0.05);但本次研究除了TB、PLT、LY外,TP、PA、K+在两组间差异也具有统计学意义(P<0.01),这表明单独添加益生菌可能比肠内营养制剂中混合添加一定量的益生菌更为有效。有研究[20]报道益生菌可能对活动期和缓解期的UC有益,对CD的治疗效果尚存争议[9]。本研究中应用益生菌联合肠内营养后,观察组的UC患者其ESR、RBC、TP、Hb、Alb、PA、K+较对照组明显改善,而观察组的CD患者只有PA和K+优于对照组,表明益生菌对UC和CD均有一定的效果,且对UC的效果更为明显,与文献结果基本一致。在血清免疫球蛋白(IgG、IgA、IgM)的比较上,本研究显示IBD患者益生菌联合肠内营养在调节机体体液免疫、提高机体免疫力方面优于单独应用肠内营养。本研究结果提示,IBD患者益生菌联合应用肠内营养能明显增加IgA含量。在肠道中的免疫球蛋白,与肠相关的淋巴组织及肠黏膜表面的主要体液免疫成分是分泌型免疫球蛋白,有助于增加肠黏膜的免疫屏障。
益生菌联合肠内营养制剂应用于IBD患者可以改善其营养不良状态、减轻炎性反应、改善免疫功能、降低腹泻发生率,对IBD治疗有效,且对UC的疗效较CD更为明显。不同益生菌的作用机制不同,未来针对益生菌菌种选择、剂量、疗程等方面的研究还有待深入。
