高迁移率族蛋白A2和基质金属蛋白酶-11在乳腺癌组织中的表达与预后的关系
2018-09-10吴珺艺戴雪明徐军明
李 杨, 吴珺艺, 王 晔, 秦 钧, 戴雪明, 徐军明
(上海交通大学附属第一人民医院普外科,上海 200080)
乳腺癌是女性最常见的恶性肿瘤之一,其发病率和病死率分别居女性恶性肿瘤的第1位和第2位[1]。根据2015中国癌症统计数据,我国每年新发乳腺癌病例27.2万,每年约7.0万人死于乳腺癌,主要致死原因为转移[2]。高迁移率族蛋白A2(high mobility group AT-hook 2, HMGA2)表达于多种人类恶性肿瘤,其异常表达与肿瘤细胞上皮间质转化、侵袭转移、患者生存时间缩短和靶向药物治疗耐药性等过程关系密切[3]。基质金属蛋白酶-11(matrix metalloproteinase-1, MMP-11)可降解细胞外基质和基底膜,参与肿瘤浸润和转移,MMP-11在改进肿瘤治疗和监测肿瘤转移等方面受到越来越多的关注[4]。本研究检测173例乳腺癌患者术后组织样本中HMGA2和MMP-11的表达,分析两者与乳腺癌临床病理特征的关系和两者之间的相关性。
1 资料与方法
1.1 一般资料
收集2007年1月—2008年12月在上海交通大学附属第一人民医院普外科行手术切除的173例乳腺癌患者临床资料,其中排除术前接受新辅助化疗和放疗者、术中无法行腋窝淋巴结清扫者及双侧乳腺癌患者,治疗结束后对患者行定期随访(1年内每3个月、2~5年内每6个月、>5年每年进行随访),随访方式包括门诊复查、电话随访、登门随访和询问亲属等,随访截止至2017年12月31日,平均随访(78.9±7.75)个月,中位随访时间71个月。本研究获得上海交通大学附属第一人民医院伦理委员会批准,并与患者或家属签署知情同意书。
1.2 免疫组织化学染色
采用SP法,按照试剂盒说明书进行。兔抗人HMGA2和MMP-11多克隆抗体均购自美国Cell Signaling Technology公司;免疫组织化学试剂盒购自北京中杉金桥生物科技有限公司。具体过程如下: 将癌组织和癌旁正常组织石蜡连续切片,脱蜡、水化,经磷酸盐缓冲液(PBS)漂洗后在3%过氧化氢溶液孵育5~10min。应用抗原修复液修复后加入山羊血清工作液封闭,每个样本滴加50μL一抗工作液4℃过夜,PBS漂洗后加入二抗工作液37℃孵育30min,二氨基联苯胺显色,苏木精复染。使用乙醇梯度脱水法干燥,二甲苯透明,中性树胶封片,显微镜下观察HMGA2和MMP-11染色情况。
1.3 结果判定
HMGA2蛋白阳性表达于细胞核,而MMP-11蛋白阳性表达于细胞质内,根据切片中染色阳性细胞着色强度及阳性细胞占所观察肿瘤细胞数的百分比进行半定量计分。染色强度: 无显色为0分,淡黄色、棕黄色和棕褐色分别计1、2、3分。高倍镜下随机选取5个视野,按阳性细胞所占百分比计分: <5%计0分,6%~10%计1分,11%~50%计2分,51%~75%计3分,>75%计4分。根据两项得分乘积将结果分为: <1分为阴性,2~5分为弱阳性,6~9分为阳性,10~12分为强阳性,阴性和弱阳性均判为阴性,阳性和强阳性均判为阳性。HER-2表达判定方法: 免疫组化3+为HER-2阳性,0和1+为HER-2阴性,2+为HER-2不确定状态,需进一步行FISH方法检测HER-2基因扩增状态。
1.4 统计学处理
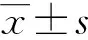
2 结 果
2.1 HMGA2和MMP-11在乳腺癌组织和癌旁组织中的表达水平
在乳腺癌组织中,HMGA2阳性表达率为74.6%(129/173),MMP-11阳性表达率为59.0%(102/173);在癌旁组织中,两者的阳性表达率分别为16.2%、9.8%,乳腺癌组织中HMGA2和MMP-11的表达显著高于癌旁组织(HMGA2:2=75.890,P<0.001;MMP-11:2=17.621,P<0.001)。
2.2 HMGA2和MMP-11表达相关性分析
在173例乳腺癌标本中,HMGA2和MMP-11蛋白同时阳性表达28例,同时阴性表达9例。经Spearman相关分析,HMGA2和MMP-11阳性表达呈正相关(r=0.772,P<0.01)。
2.3 HMGA2与MMP-11的表达与乳腺癌主要临床病理参数之间的关系
HMGA2阳性表达与年龄>40岁、绝经期后、组织学分级Ⅲ级相关(P<0.05)。HMAG2在伴有腋窝淋巴结转移、雌激素受体(estrogen receptor, ER)表达阴性、HER-2表达阳性和TNM分期(Ⅲ~Ⅳ期)中阳性表达率分别为88.4%、82.9%、84.5%、53.5%,明显高于腋窝无淋巴结转移、ER表达阳性、HER-2阴性和TNM分期(Ⅰ~Ⅱ期)组(34.1%、67.0%、59.1%、31.8%)。HMGA2阳性表达与肿瘤大小、孕激素受体(progesterone receptor, PR)表达和Ki-67表达无关(P>0.05)。腋窝淋巴结转移阳性组中MMP-11阳性表达率为67.5%,明显高于腋窝淋巴结阴性组(P=0.001)。在ER表达阴性组、HER-2表达阳性组和TNM分期Ⅲ~Ⅳ期组中,MMP-11阳性表达率分别为73.0%、64.1%、70.3%,明显高于ER表达阳性组(31.0%,P<0.001)、HER-2阴性组(44.4%,P=0.021)和TNM分期Ⅰ~Ⅱ期组(46.3%,P=0.001)。MMP-11表达与患者年龄、肿瘤大小、月经状态、组织学分级、PR表达和Ki-67表达均无关(P>0.05),见表1。
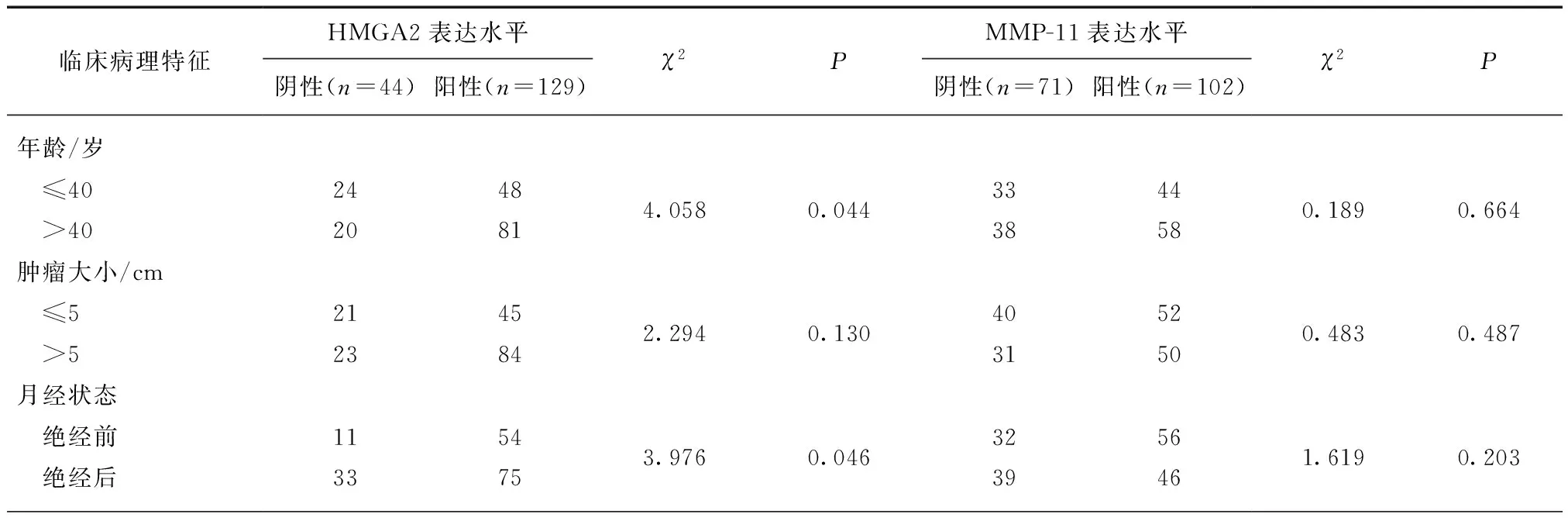
表1 HMGA2和MMP-11表达与乳腺癌临床病理资料之间的关系Tab. 1 Relationship between the expression of HMGA2 and MMP-11 and cilincopathological characteristics of breast cancer

(续表1)
2.4 HMGA2和MMP-11与乳腺癌预后的关系
乳腺癌患者中HMGA2和MMP-11同时表达阳性者,其无病生存时间(disease free survival, DFS)短于HMGA2和/或MMP-11表达阴性者(P<0.001),见图1。乳腺癌患者中HMGA2和MMP-11同时表达阳性者,其总生存时间(overall survival, OS)短于HMGA2和/或MMP-11表达阴性者(P=0.001),见图2。

图1 HMGA2、MMP-11表达与乳腺癌患者DFS的关系Fig.1 Relationship between the expression of HMGA2, MMP-11 and DFS in breast cancer patientsA组: HMGA2(+) MMP-11 (+);B组: HMGA2 (+) MMP-11 (-);C组: HMGA2 (-) MMP (+);D组: HMGA2 (-) MMP-11 (-)

图2 HMGA2、MMP-11表达与乳腺癌患者OS的关系Fig.2 Relationship between the expression of HMGA2, MMP-11 and OS in breast cancer patientsA组: HMGA2 (+) MMP-11 (+);B组: HMGA2 (+) MMP-11 (-);C组: HMGA2 (-) MMP (+);D组: HMGA2 (-) MMP-11 (-)
采用Cox回归分析对乳腺癌患者临床病理学特征及HMGA2、MMP-11表达情况与乳腺癌患者DFS和OS的关系进行统计学分析,结果表明组织学分级、腋窝淋巴结转移、HMGA2和MMP-11表达情况是决定患者DFS的独立预后因素,见表2。腋窝淋巴结转移、HER-2表达、TNM分期和HMGA2表达是决定患者OS的独立预后因素,而MMP-11的表达情况不是决定患者OS的独立预后因素(P=0.157),见表3。
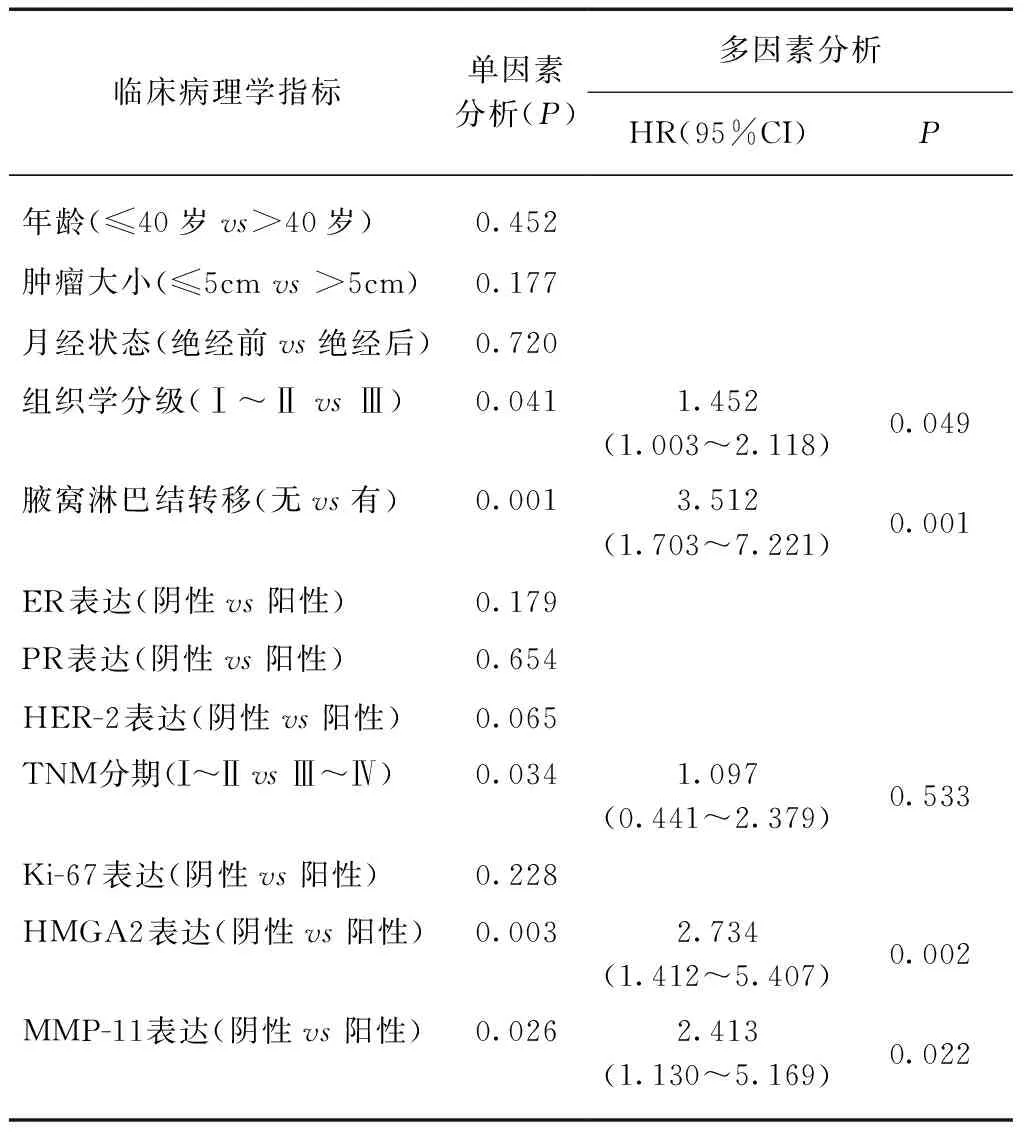
表2 乳腺癌患者临床病理学指标与DFS相关性的单因素和多因素预后分析Tab.2 Univariate and multivariate analysis of variables correlated with DFS in breast cancer patients
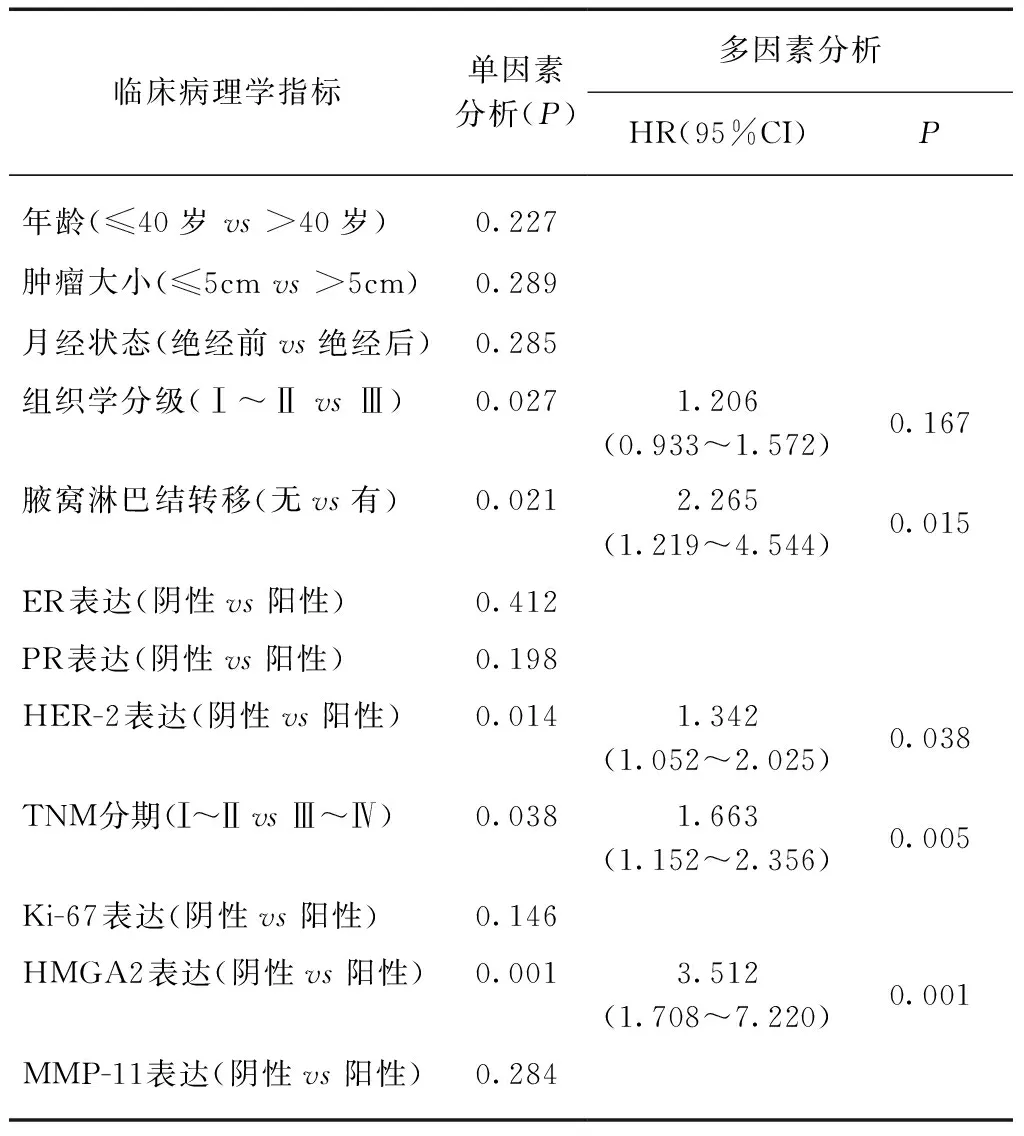
表3 乳腺癌患者临床病理学指标与OS相关性的单因素和多因素预后分析Tab.3 Univariate and multivariate analysis of variables correlated with OS in breast cancer patients
3 讨 论
HMGA2是高迁移率蛋白家族的一员,包括3个AT-钩状结构域,可与DNA小沟内的AT丰富区域结合,引起DNA结构弯曲、拉伸、成环或解链,从而调节目的基因的表达;研究[3]表明,HMGA2阳性表达与肿瘤新生血管生成、侵袭与转移密切相关。HMGA2在多种恶性肿瘤中表达上调,可作为多种恶性肿瘤预后指标之一,在肺癌、卵巢癌、口腔鳞状上皮癌、结肠癌和乳腺癌中,HMGA2表达上调常与肿瘤的高级别组织学分级相关,并与肿瘤早期复发和较低的总体生存率相关[5-6]。此外,HMGA2表达与结肠癌Duks分期和转移相关[7]。Motoyama等[8]研究表明,在胃癌中,HMGA2表达与胃癌浆膜侵犯具有相关性。
MMP-11的表达与退变、胚胎形成、伤口愈合等正常生理状况下的的组织重构密切相关。已证实MMP-11过表达于多种人类肿瘤中,包括口腔癌、纤维瘤、非小细胞肺癌、食管腺癌等,此外,MMP-11基因表达增加与肿瘤恶性程度密切相关,并预示患者预后较差[9]。MMP-11高水平表达与乳腺癌、非小细胞肺癌、结肠癌患者临床预后差相关[10]。Deng等[11]研究证实敲除胃癌细胞BGC823 MMP-11表达可抑制软琼脂试验中的细胞增殖和克隆形成能力,裸鼠的皮下肿瘤形成能力也有所减弱。Hsin等[12]分析了279例口腔鳞癌MMP-11表达,证实了MMP-11阳性表达与颈部淋巴结转移呈正相关。研究[13]发现,单核细胞表达MMP-11联合炎性蛋白前体可促进肿瘤细胞逃逸且具有侵袭性,从而促进其远处转移。Kwon等[14]发现在ER阴性乳腺癌细胞中,Gli1过表达可上调MMP-11进而促进乳腺癌细胞迁移、侵袭和转移。
本研究结果表明,在发生腋窝淋巴结转移的乳腺癌组中,HMGA2阳性表达率明显高于腋窝淋巴结转移阴性组;TNM分期Ⅰ期和Ⅱ期乳腺癌组织HMGA2阳性表达率低于Ⅲ~Ⅳ期HMGA2阳性表达率;HER-2阴性组HMGA2阳性表达率明显低于HER-2阳性组。MMP-11阳性表达与腋窝淋巴结转移阳性、ER阴性表达、HER2阳性表达显著相关,提示HMGA2和MMP-11蛋白表达可能对乳腺癌的侵袭转移起到重要作用,与乳腺癌预后密切相关,与前述文献报道一致。
HMGA2表达与MMP-11表达水平呈正相关,并且HMGA2和MMP-11表达阳性患者DFS和OS均短于HMGA2和/或MMP-11表达阴性者,表明HMGA2与MMP-11之间可能存在着内在的联系。在小鼠乳腺癌细胞中,TGF-β诱导Smad表达增强,继而引起HMGA2表达上调;HMGA2与Smad结合促进与上皮间质转化(epithelial-to-mesenchymal transition, EMT)相关的一系列基因转录增强(如Snail、Slug、Twist等),同时抑制E-cadherin表达,表明HMGA2是乳腺癌EMT的关键调节因子。研究[15]表明,由TGF-β诱导的Ras转化小鼠乳腺上皮细胞中,MMP-2、MMP-11和MMP-13转录活性提高。小鼠乳腺上皮细胞和人乳腺癌细胞MCF-7中下调single-minded 2可激活EMT并促进MMP-11的表达,而MCF-7细胞中Snail表达上调可引起MMP-11独立引起的肿瘤侵袭和转移;由此,本研究猜测HMGA2表达上调引起多个EMT转录因子增强表达,诱导乳腺癌细胞发生EMT改变,同时通过某种机制促进MMP-11过表达,这一系列综合作用促进乳腺癌细胞发生浸润转移。
综上所述,HMGA2和MMP-11可能参与乳腺癌的侵袭和转移过程,其表达阳性提示患者预后较差,HMGA2和MMP-11表达情况对判断乳腺癌患者的预后具有一定的参考价值,HMGA2与MMP-11之间内在的具体的分子调控机制仍需不断探索。
