Fibroscan与APRI对慢性乙型肝炎合并脂肪肝患者肝纤维化的诊断价值*
2018-09-10林姗姗萧焕明施梅姐刘乐鑫池晓玲
林姗姗 萧焕明 施梅姐 刘乐鑫 池晓玲△
1.广州中医药大学研究生院 (广东 广州,5104051)2.广东省中医院肝病科 3.广州中医药大学深圳医院
慢性乙型肝炎(CHB)是一种全球流行性感染性疾病,数据显示我国1~59岁人群HBsAg携带率为7.2%[1]。CHB常常同时合并有肝脏脂肪变性[2,3]。合并脂肪肝会影响CHB患者的预后和治疗结局[4]。如Petta等[5]研究报道肝脂肪变性(>10%)是促使CHB患者肝纤维化发展的一个独立因素。基于脂肪肝与CHB之间的相关作用错综复杂,因此准确评价CHB合并脂肪肝患者的肝纤维化程度在临床实践中至关重要。
既往研究[6~9]已证实Fibroscan诊断乙肝肝纤维化有较高的诊断价值,且优于APRI模型[10,11]。但较少研究报道Fibroscan及APRI诊断CHB合并脂肪肝肝纤维化的效能。我们就Fibroscan及APRI模型对CHB合并脂肪肝肝纤维化的诊断价值进行探讨,以期指导临床。
1 资料与方法
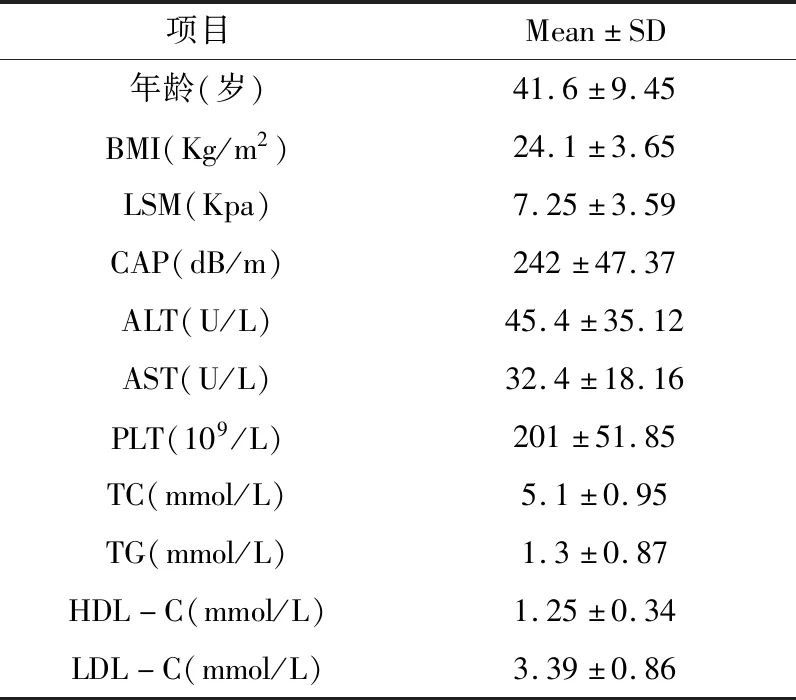
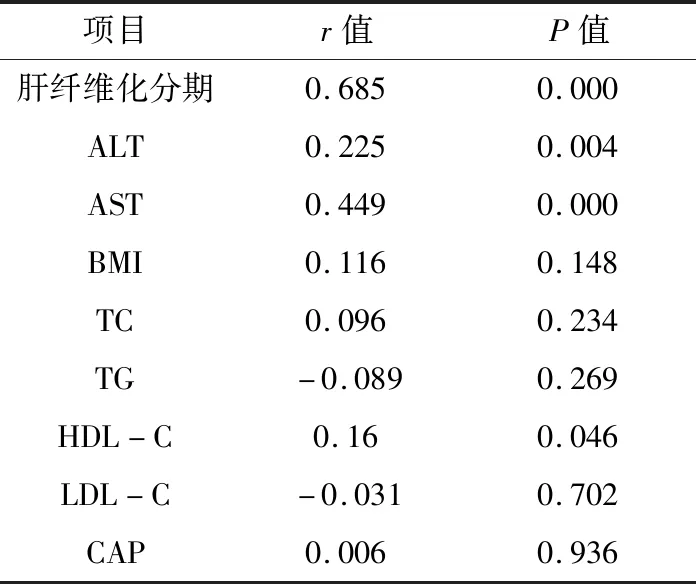
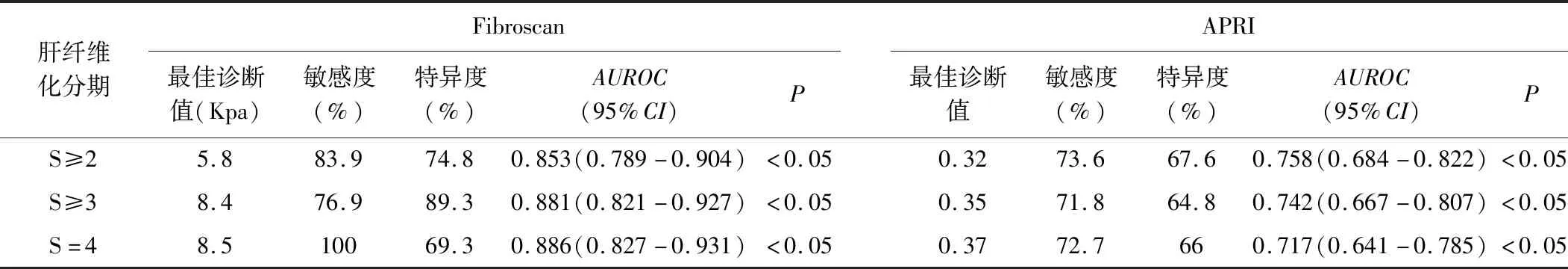
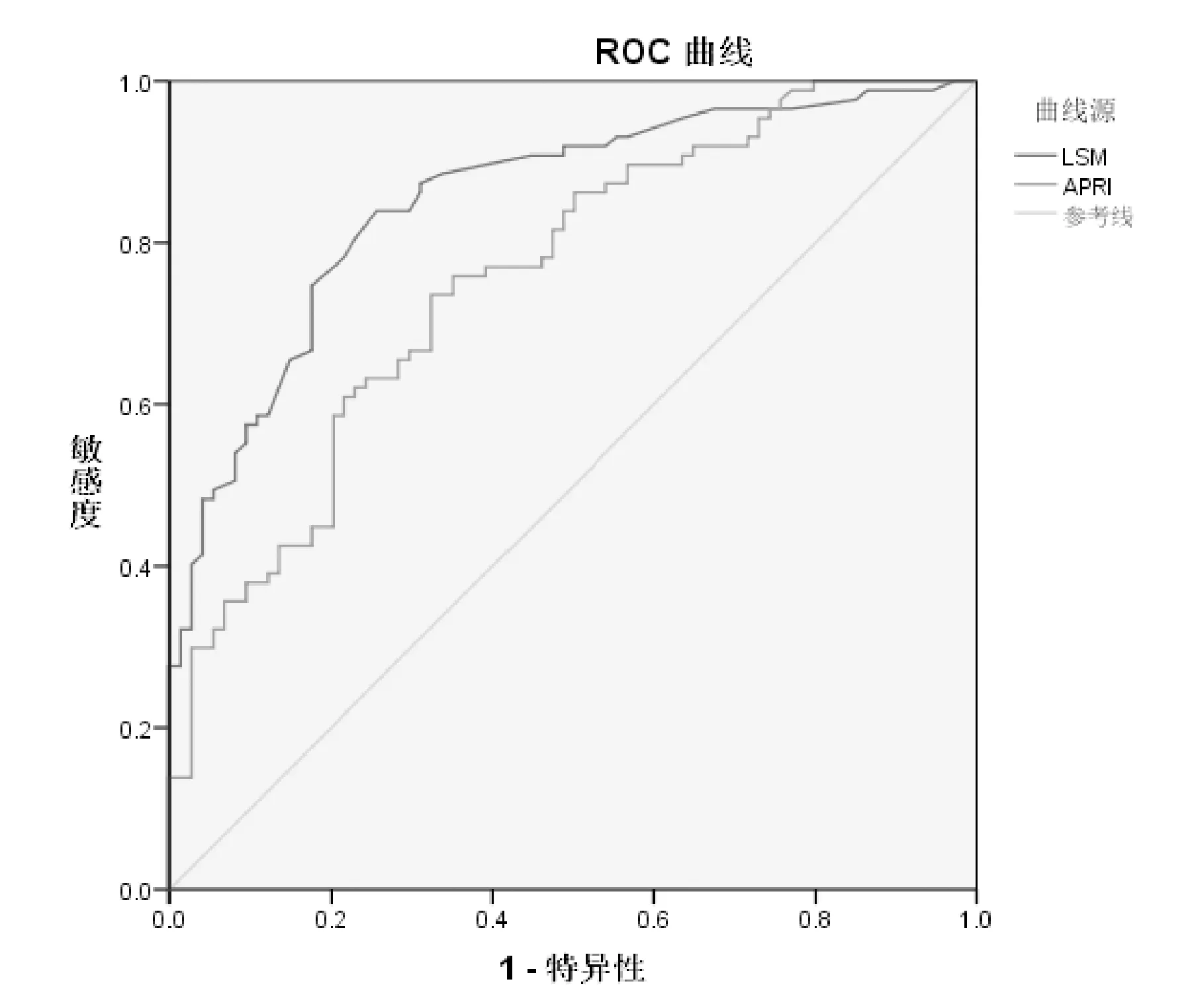
1.1 一般资料 选择2014年5月~2017年7月于广东省中医院肝病科行肝组织病理学检查确诊为CHB合并脂肪肝患者161例,其中男128例,女33例,平均年龄(41.6±9.45)岁。病理学诊断标准:肝纤维化分期参照2000年由中华医学会传染病与寄生虫病学分会、肝病学分会联合修订通过的《病毒性肝炎防治方案》中的慢性肝炎分级分期标准分为S0~S4[12],肝细胞脂肪变性分级参照Brunt等[13]建议的脂肪变分级标准分为F1~F3共3级。(5% 1.2 排除标准 合并感染其他病毒性肝炎;合并其他慢性重型肝炎、失代偿期肝硬化、肝癌等严重或终末期肝病者;伴有心、肾、肺、内分泌、血液、代谢、免疫及胃肠道原发病而且药物控制不稳定者或是精神病患者;妊娠或哺乳期妇女。 1.3 方法 1.3.1 肝脏病理学检查 在超声引导下以16G肝组织活检针行经皮肝穿刺活检术获取肝组织,为确保诊断准确性,标本长度必须≥1cm,其后标本送检病理科。 1.3.2 FibroScan检测 将探头置于患者右侧腋前线或腋中线的第7、8、9肋间隙中间,正对肝脏实质处,远离肝脏的边缘,确保探头与皮肤垂直,稍微加压,连续成功检测≥10次,成功率≥60%,取平均硬度值LSM作为最终测定结果,单位为kPa。无法取得LSM值者或者检测结果四分位数间距(IQR)大于中位数1/3者则视为检测失败。 1.4 统计学方法 采用SPSS 19.0软件对数据资料进行统计学分析。计数资料采用率与百分比表示,数据相关性分析采用Pearson和Spearman相关分析,正态分布的计量资料采用mean±SD表示,非正态分布的计量资料采用中位数表示,组间两两比较采用独立样本t检验;以肝活检结果为“金标准”,构建受试者工作(ROC)曲线,计算曲线下面积,以此评价Fibroscan、APRI对肝纤维分期的诊断价值,并进行多组ROC曲线下面积之间的比较。所有统计采用双侧检验,P<0.05表示差异有统计学意义。 2.1 患者基本特征 共纳入受试者161例,其中男128例,女33例,平均年龄(41.6±9.45)岁;肝细胞脂肪变病理学分级:轻度脂肪肝:132例(82%),中度脂肪肝:27例(16.8%),重度脂肪肝:2例(1.2%);纤维化病理学分期:S0:35例(21.7%),S1:39例(24.2%),S2:48例(29.8%),S3:28 例(17.4%);S4:11例(6.9%)。同时对161例患者年龄、BMI、ALT、AST、PLT、TC、TG、HDL-C、LDL-C、LSM、CAP的基线水平进行统计,详见表1。 表1 161例CHB合并脂肪肝患者年龄、BMI、LSM、CAP及部分生化学指标基线水平 2.2 LSM与其他指标的相关性分析 详见表2。 表2 患者LSM值与BMI、肝功能、血脂、肝纤维化分期、CAP的相关性分析 2.3 CHB合并脂肪肝患者不同肝纤维化分期LSM值与APRI值的比较 详见表3。 2.4 Fibroscan、APRI对于CHB合并脂肪肝患者肝纤维化的诊断价值 以肝组织病理学分期为标准,绘制两种诊断方法的ROC曲线,对比其诊断效能。Fibroscan在诊断S≥2(见图1)、S≥3(见图2)时,其诊断效能均优于APRI(Z=2.419,P=0.0156;Z=2.892,P=0.0038),差异均具有统计学意义(P<0.05);在诊断S=4(图3)时,二者诊断效能差异无统计学意义(P>0.05)。 表3 Fibroscan、APRI对CHB合并脂肪肝患者肝纤维化诊断效能 图1 Fibroscan与APRI诊断CHB合并脂肪肝患者S≥2的ROC曲线 图2 Fibroscan与APRI诊断CHB合并脂肪肝患者S≥3的ROC曲线 图3 Fibroscan与APRI诊断CHB早期肝硬化合并脂肪肝患者的ROC曲线 基于上文提及的合并脂肪肝对CHB患者所造成的一系列负面影响,能否准确评价CHB合并脂肪肝患者的肝纤维化程度,将影响治疗方案的制定和预后。肝组织病理学检查长期以来被视为评价肝纤维化程度的“金标准”,但不可避免地存在局限性,如有创操作、取样误差、阅片主观性等[14,15]。这些局限性在一定程度上促进了肝纤维化无创诊断方法的发展,如Fibroscan、血清学模型。Fibroscan凭借便捷、可重复性等优点成为其中的研究热点。 我们对161例CHB合并脂肪肝患者进行肝纤维化病理学分期,探讨Fibroscan对其肝纤维化程度的诊断价值,以期更好地指导临床评估病情。结果显示Fibroscan对CHB合并脂肪肝患者肝纤维化程度具有良好的诊断价值。以Fibroscan诊断显著肝纤维化、进展性肝纤维化、早期肝硬化的ROC曲线下面积(AUROC)分别为0.853、0.881、0.886。与既往Fibroscan诊断单纯CHB患者肝纤维化的诊断效能相近[8,9]。根据Fibroscan诊断不同纤维化分期的ROC曲线下面积可见,Fibroscan对进展性肝纤维化及早期肝硬化的诊断价值优于显著肝纤维化,这与既往国内外研究的结果相似[6~8,12,16]。相对于B超、CT或MR等可能受人为因素影响较大的影像学检查,Fibroscan在诊断肝纤维化方面显示出早期发现、可定量诊断的优势。但本研究中Fibroscan诊断早期肝硬化(S=4)的最佳诊断值仅为8.5kPa,明显低于既往类似研究的诊断值,考虑与本研究样本中S4的病例数过少相关,有待在现实数据充足的情况下,再进行深入的研究。 在探讨影响LSM值的相关性因素中,我们发现LSM值与肝纤维化病理分期呈强正相关性(r=0.685,P<0.05),这与既往[8,9,17]的研究结论相似。且研究显示LSM值与BMI、TC、TG、HDL-C、LDL-C、CAP均不存在相关性,提示Fibroscan定量诊断肝纤维化的干扰因素较少,且合并脂肪肝不会影响其评价肝纤维化的诊断效能,证实了Fibroscan可用于评价CHB合并脂肪肝患者的肝纤维化程度。同时,本研究还发现LSM值与AST、ALT存在相关性,此前孝奇[18]等研究亦提示ALT、AST水平对LSM值存在一定影响。但本研究中ALT与LSM值的相关性相对较弱,可能与样本选择差异有关。既往有研究报道,ALT对Fibroscan诊断CHB肝硬化的准确性影响不明显,在ALT低于2倍正常值的情况下,诊断S2以上肝纤维化的准确性亦无明显影响[19,20]。本文中多数病例(151/161)的ALT低于2倍正常值,与上述报道相符。 AST和PLT是CHB患者出现肝纤维化的重要影响因素[18,21~23],本研究亦提示LSM值与AST之间存在正相关性(r=0.449,P<0.05)。APRI是建立在AST和PLT基础上的一种无创诊断肝纤维化程度的血清学模型。在本研究中,APRI诊断CHB合并脂肪肝患者显著肝纤维化、进展性肝纤维化、早期肝硬化的AUROC分别为0.758、0.742、0.717,说明APRI对CHB合并患者的肝纤维化程度也有诊断价值,但其AUROC较Fibroscan小,说明其诊断价值不如Fibroscan。这可能与APRI涉及到的AST和PLT存在较大变异相关。 综上所述,Fibroscan对CHB合并脂肪肝患者的肝纤维化程度具有较高的诊断价值,适用性较好,对于临床动态监测肝纤维化程度和评估病情轻重程度具有重要指导意义,值得在临床上广泛推广。但Fibroscan在肝纤维化诊断方面的应用也存在一定局限性,例如FibroScan检测时,探头位置、操作者经验、肋间隙狭窄、腹水、进食等因素均有可能影响最终的LSM值[24、25],从而影响研究结果的准确性。同时,本研究选取的样本量不够多,且只限于一家医院,如需进一步更准确、客观地反映Fibroscan评估CHB合并脂肪肝患者肝纤维化程度的情况,下一步应开展多中心研究,增加样本量。此外,FIB-4等其它肝纤维化无创诊断血清学模型、Fibroscan联合血清学模型对CHB合并脂肪肝患者肝纤维化的诊断价值也是值得探索的研究点。2 结果


3 讨论
