化学氧化对污染水氰化物的去除试验研究
2018-09-10林宁
林宁


摘要:为了深入研究化学氧化对污染水中氰化物的去除率,文章通过自制含有氰化物的试验水样,分别对0,,CIO.与CL这3种氧化剂的去除效果进行了研究,同时简单分析了这3种氧化剂在去除氰化物时的原理,同时还对不同投加浓度对氰化物去除率的影响进行了分析。试验结果证明,在3种氧化剂中,Cl2对氰化物的去除率最高,显著高于O3和ClO2;在利用25.6 umol/L的Cl2对由纯水配置而成的试验水样中的氰化物进行处理时,反应时间在20 min时,其氰化物的去除率可以达到98.7%,因而在发生突发性氰化物污染时,可以选择Cl2进行应急处理。
关键词:氧化剂;氰化物;氧化反应
氰化物是一种剧毒物质,仅0.1g氰化物便可以致人死亡,而在水体中,若氰化物的质量浓度处在0.3 mg/L至0.5mg/L中间,那么便会导致水中的生物死亡。因此,关于污水中氰化物的处理,不仅关系着环境污染问题,同时也直接关系着人类的生命健康安全。对于集中式生活饮用水地表水源地Ⅱ类水环境(一级保护区)和Ⅲ类水环境(二级保护区)的氰化物浓度,在《地表水环境质量标淮》中具有明确规定,其最大浓度值为1.92μmol/L (0.05 mg/L)与7.69μmol/L (0.2 mg/L)。在本次经化学氧化对污染水氰化物的去除试验研究中,为了更好地说明试验结果,将城市饮用水地表水源发生的氰化物一般污染事故作为研究对象,并分别通过O3,ClO2与Cl2对模拟试验水样中的氰化物进行化学氧化处理,通过分析3种化学氧化的实际结果,来评价化学氧化技术在去除污水氰化物上的效果。
1 试验水样
本次试验采用的水样,是由氰化物的标准试剂,与纯水、城市水源进行配置,而模拟出来的污水,其中:由氰化物标准试剂与城市用水配置出的水样,其氰化物质量浓度为0.23 mg/L,标记为试验水样1;而由氰化物标准试剂与纯水配置成的水样,其氰化物质量浓度同样为0.23 mg/L,将其标记为试验水样2。上述两种试验水样的质量浓度,均超过了规定的标准值,需要进行处理。
本次试验选择的添加药品,均是纯试剂。其中,Cl2来自于液体氮;ClO2是由干燥空气稀释过的氯气,与固态亚氯酸钠进行反应而得来的;O3则是以纯氧为原料,通过臭氧发生器而得来,而臭氧的浓度利用KI吸收法进行检测与还原。
2 试验内容
在试验过程中,自制了小型的水厂系统作为试验装置,系统主要由预处理氧化设备、消毒处理设备以及混凝沉淀设备组成。具体试验内容为,在系统中的预处理氧化设备正常工作时,在一定时间,从该设备中取出水样,检测其氰化物的浓度。同时,利用具有计量功能的设备,对O3,ClO2与Cl2进行一次性的投加,需要注意的是,应采取气水混合的方式进行投加,且投加时应将投加点放在预处理氧化设备进水管处。
第一步:将O3,ClO2与Cl2分别投入到试验水样2中,对其半个小时内,氰化物的浓度进行检测,将检测结果进行对比,分析不同氧化剂对氰化物的去除效率。其中,O3,ClO2与Cl2的浓度分别为25.0μmol/L,9.6 μmol/L,25.6μmol/L。
第二步:基于第一步的试验结果,再利用不同浓度的O3,ClO2对试验水样1,2进行处理,并对20 min之后水样中的氰化物浓度进行检测,以研究不同浓度的处理效率。
3 试验结果分析
3.1 试验结果分析方法
本次试验过程中,对试验水样中的氰化物浓度进行检测时,采取的是顶空取样气相色谱法。其中,检测温度与柱箱温度分别为150℃,90℃;纸速为4 mm/min,高阻为106Ω,脉冲为100μs,高纯度氮的流动速度为60 mL/min,而最低检出浓度在0.5~0.8 μg/L。氰化物去除率的计算公式为:
其中,E代表氰化物去除率;A0代表处理之前水样中的氰化物浓度;A1代表处理之后水样中剩余的氰化物浓度。
3.2 试验结果讨论
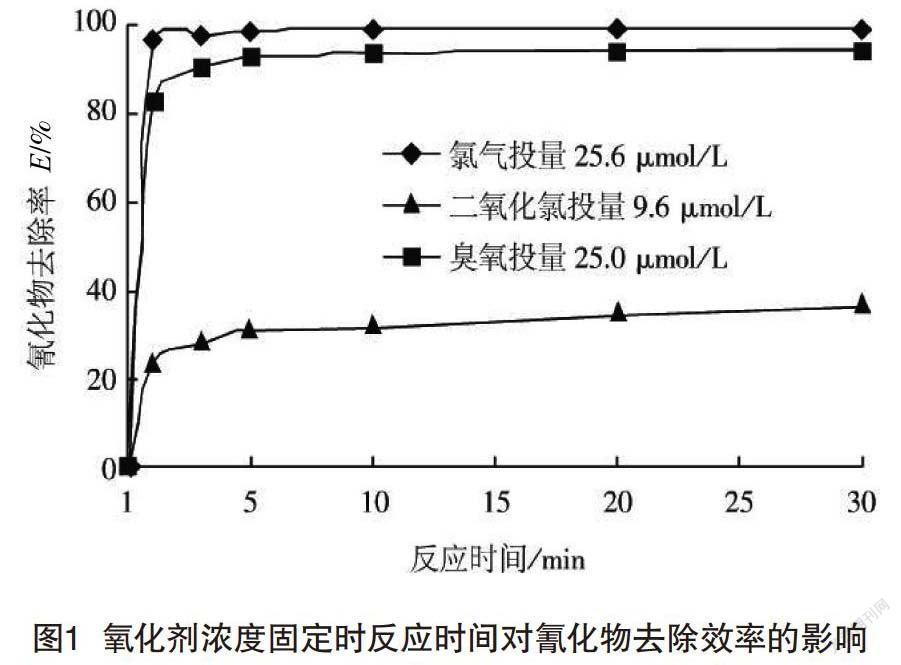
(1)试验第一步的结果分析,即固定浓度氧化剂对污水中氰化物的去除效果分析:当氧化剂的浓度固定时,反应时间为自变量,氰化物去除率为因变量,结果如图l所示。
由图1可知:第一,利用25.0μmol/L的O3对试验水样2进行处理的过程中,反应后的3 min,E值为90.3%;在10 min后,E值为93.8%,污水中剩余氰化物的质量浓度为0.014 mg/L;在此之后,反应时间增加,而E值保持不变。由此可知,O3在处理污水中氰化物时,主要分为两个作用阶段,具体作用情况见公式2和3。
(2)利用9.6μmol/L的ClO2对试验水样2进行处理的过程中,当反应时间进行到了30min之后,E值仍然仅有34.5%,故而ClO2这一氧化剂在处理污水中的氰化物时效率较低,不适用于对氰化物污染的水源进行处理。
(3)利用25.6μmol/L的Cl2,对试验水样2进行处理的过程中,反应时间为3 min时,E值为97.7%;在反应时间10 min时,E值达到了99.2%,此时水样中剩余氰化物的质量浓度仅为0.002 mg/L。由此可知,Cl2对污水中氰化物的去除效率比较快,可以在较短的时间内,将污水中的氰化物质量浓度降低,直至满足标准。同时,Cl2的氧化过程也是分阶段进行的,具体情况详见式(4)和式(5)。
站在氧化剂自身的物理化学性质的角度进行分析,结合图1,可以得知,当污染水的pH为中性时,Cl2和O3对氰化物的去除效率是相接近的,均比较高,这便证明二者的标准电极点位比较接近。而在本次试验中,试验结果却表现为O3对氰化物的去除效率,明显低于Cl2,导致这一现象的部分原因,可能是因为相对于Cl2而言,O3在水中的溶解度較低,并且稳定性也比较差,因而在短时间内,O3氧化氰化物的效率要低于Cl2。
分析第二步试验的结果,即不同浓度的氧化剂,对污水中氰化物去除率的影响,结果如图2所示。
由公式5可知,Cl2可以对氰化物进行完全氧化时的摩尔比是3:1,即n (Cl2):n(CN-)=3:1。当采用25.6μmol/L的Cl2分别对试验水样1和2进行处理时,在反应的20 min后,E值分别为98 .7%与99.3%,而摩尔比分别为3.1与3.0,试验水样中的氰化物大部分得到了氧化。
而利用臭氧对试验水样1进行处理时,当臭氧的浓度处在12.0-37.0μmol/L時,E值由47.3%不断升高,最终达到了86.2%。由此可知,氧化剂在这一浓度范围内,氰化物的氧化效率比较快;当臭氧的浓度处在37.0-50.5μmol/L时,E值的增加速度比较缓慢,但也在增加;而当臭氧得到浓度达到50.5μmol/L以上时,E值达到了91.7%。而利用臭氧对试验水样2进行处理时,当臭氧的浓度处在12.0-37.0μmol/L时,E值由75.5%不断升高,最终达到93.1%。由此可知,氧化剂在这一浓度范围内,氰化物的氧化效率比较快,且与养护剂浓度呈正比例关系;当臭氧的投加浓度高于25.0μmol/L时,E值的增长速度比较缓慢,而当臭氧浓度达到37.6μmol/L时,E值达到了94.5%;当臭氧浓度达到50.0μmol/L时,E值达到T96.3%。
在臭氧对试验水样中的氰化物进行氧化时,水样2的氰化物去除率要高于水样1。这是因为:(1)水样1是由城市用水配置而成的,其中含有很多还原性物质,会在一定程度上消耗水样中O3的含量,进而使得其氰化物氧化率较低,在还原性物质消耗没之后,氰化物的氧化率才会上升。(2)城市用水中,可能含有可以和游离氰出现反应的金属离子,其在反应后会出现金属氰络合物,进而对O3的氧化效率产生影响。
4 实验结果
结论1:Cl2是污水中氰化物去除率最高的氧化剂,可以用在氰化物水污染的应急处理当中;O2和Cl2的氰化物去除率比较接近,但由于臭氧的稳定性与溶解度均比较差,因而其氧化效率比Cl2低;ClO2的氧化效率相对较低,不适用于对氰化物污染进行处理。
结论2:在处理水样2时,Cl2氧化剂的效率明显高于ClO2,导致这一现象的原因可能是因为,ClO2气体没有进行相应的活化处理,导致其活性较低,在未氧化氰化物之前,便已经逸出水样。
结论3:在O3处在12.0-50.0μmol/L的投加浓度范围时,浓度直接影响着氰化物的去除率,特别是在处理试验水样1(由城市用水与氰化物试剂配制而成)时,这是因为城市源水中存在还原性物质,会与0,发生反应,进而影响氰化物的去除率。
结论4:金属氰络合物具有较高的稳定性,且现阶段关于处理氰化物的研究成果中,主要将游离氰作为研究对象,因而,未来有必要加大对金属氰络合物的研究力度。
5 结语
氰化物是一种危害极大的物质,一旦在水源中泄漏,会极大地威胁人类的生命健康安全以及环境。因此,关于污水中氰化物的处理,一直是污水处理中的重中之重。本研究通过试验的方式,对不同氧化剂以及不同投加浓度,对污水中氰化物的去除率进行了研究,通过自制试验水样,检测不同反应时间内,试验水样中剩余氰化物的质量浓度,得出了如下结论:Cl2是污水中氰化物去除率最高的氧化剂,可以用在氰化物水污染的应急处理当中;O3和Cl2的氰化物去除率比较接近,但由于臭氧的稳定性与溶解度均比较差,因而其氧化效率比Cl2低;ClO2的氧化效率相对较低,不适用于对氰化物污染进行处理,等。因此,在未来关于污水中氰化物的氧化处理中,应根据不同情况选择不同的氧化剂。例如,在突发的氰化物污染的应急处理中,应首要选择Cl2作为氧化剂。
