不同部位注射6-羟基多巴胺建立帕金森病大鼠模型比较分析
2018-09-08常学辉张良芝
黎 民, 常学辉, 张良芝, 雷 震, 罗 申
(1. 周口市中医院, 周口 466000; 2. 河南中医药大学, 郑州 450002;3. 河南省中医院中心实验室, 郑州450002)
帕金森病(Parkinson’s disease, PD)是中、老年人常见的运动障碍性疾病,是一种以中脑黑质-纹状体多巴胺能神经元变性缺失,伴胞质内Lewy小体形成为特征性改变的神经系统变性疾病,鉴于其确切发病机制仍不清楚[1,2],PD基础研究目前仍是国内外神经病学专家关注的重点。
6-羟基多巴胺(6-OHDA)建立的PD大鼠模型因造价低、方法简单、模型稳定等优点,已被广泛应用于PD的基础研究[3]。目前PD大鼠模型成功率差别较大,原因在于建立PD大鼠模型的影响因素较多,其难点在于注射位点及6-OHDA注射剂量的选择。在查阅大量文献的基础上,本实验选择应用最多的注射位点: 中脑黑质致密区、中脑腹侧被盖区及纹状体,进行分组实验,探索一种更为理想的PD大鼠模型建立方法。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠76只, 体质量180~220 g,购自山西医科大学实验动物中心[SCXK(晋)2015-0001]。饲料由江苏省协同医药生物工程有限责任公司生产[许可证号: (2014)01008], 垫料为玉米芯。实验在河南省中医院中心实验室[SYXK(豫)2011-0002]进行, 饲养于大鼠IVC, 明暗交替12 h∶12 h,温度20~26 ℃,相对湿度40%~70%。适应性喂养1周后, 无不良反应, 开始实验, 并按实验动物使用3R原则给予人道关怀。
1.2 主要实验药物与试剂
6-OHDA,维生素C(AR,99%), 购自上海源叶生物科技有限公司, 盐酸阿朴吗啡, 购自中国药品检定研究院, 络氨酸羟化酶(Tyrosine Hydroxylase, TH)抗体购自美国 Cell Signaling公司。
1.3 主要仪器设备
大鼠脑立体定位仪(美国Stoelting公司),电动颅骨钻(安徽正华生物仪器设备有限公司),大鼠IVC(冯氏实验动物设备有限公司),电子精密天平(德国赛多利斯公司)。
1.4 方法
1.4.1 实验分组及模型建立 将76只SD大鼠按随机数字表法分为4组, 其中中脑单点组22只、中脑双点组22只、纹状体单点双注组22只、对照组10只, 使用大鼠脑立体定位仪定位, 参照文献[4]方法,按照分组情况建立PD大鼠模型。(1) 中脑单点组: 中脑黑质致密部(SNC)单点坐标A/P(距前囟中心后):-5.0 mm、L/R(距前囟中心左右): -1.7 mm、O/V(距脑膜表面深度): -7.6 mm; 单点注入6-OHDA溶液(2 mg/mL) 12 mL。(2)中脑双点组: 中脑黑质致密部A/P: -5.0 mm、L/R: -1.7 mm、O/V: -7.6 mm; 中脑腹侧被盖区A/P: -4.6 mm、L/R: -0.9 mm、O/V:-7.3 mm; 每点注入6-OHDA溶液(2 mg/mL) 6 mL。(3) 纹状体单点双注组: 纹状体单点双注A/P: -1.0 mm、L/R: -2.7 mm、O/V: -5.2 mm和O/V: -6.0 mm; 单点注入6-OHDA溶液(2 mg/mL) 12 mL,分2次注射。(4) 对照组: 中脑黑质致密部(SNC)单点坐标A/P:-5.0 mm、L/R: -1.7 mm、O/V: -7.6 mm; 单点注入质量分数0.02%维生素C溶液12 mL。
分别在造模后1周、2周、4周、8周腹腔注射诱导剂APO 0.5 mg/kg, 诱发大鼠向健侧旋转, 注射后观察大鼠行为学变化并记录其30 min内旋转的圈数。若大鼠恒定向健侧旋转且旋转圈数≥7 r/min,则为造模成功; 若大鼠旋转圈数<7 r/min或者15 min内无旋转,则为造模失败。
1.4.2 取材与指标检测 各组大鼠常规饲养,注射后8周行为学检测完毕后,将所有大鼠腹主动脉取血后断头取脑,在冰盘上快速完整剥离脑组织,生理盐水清洗后放入体积分数10%多聚甲醛中4 ℃固定24 h。常规石蜡包埋,切片(厚5 μm)。按照试剂盒说明书进行HE染色和酪氨酸羟化酶(TH)免疫组织化学染色; 利用Leica显微照相系统和Biosens Digital Imaging System图像采集系统对TH免疫组织化学染色图像(细胞质棕褐色为阳性细胞)进行分析, 先用低倍镜选择阳性表达的区域, 再利用高倍镜(400×)在切片的同一区域, 随意选择5个视野, 收集5组数据, 其平均值则为平均积分光密度(Integrated optical density, IOD), 其值表示指标表达强度。
1.5 统计学分析
采用统计软件SPSS22.0进行统计分析,造模成功率用%表示,大鼠旋转圈数及TH免疫组化阳性细胞IOD值以表示,各组数据符合正态分布和方差齐性的采用单因素方差分析,如不符合正态分布和方差齐性则采用多个相关样本的非参数检验,P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠模型行为学检测
造模后3 d内中脑双点组大鼠死亡2只,纹状体单点双注组死亡1只,对照组死亡2只,最终中脑单点组22只,中脑双点组20只,纹状体单点双注组21只,对照组8只大鼠进入统计结果。典型PD大鼠模型在注射APO后数秒至数分钟内即可出现向健侧的旋转行为,以左后肢为支撑点,头尾相连,身体约成环形,原地旋转,时有嗅探、觅食及弓背等动作。
造模1周时经APO诱导,中脑单点组造模成功13只,中脑双点组成功9只,纹状体单点双注组成功7只,对照组大鼠无旋转行为(表1),各周及最终各组造模成功率详见表1,各组间造模成功率均有统计学意义(P<0.05)。
中脑单点组经APO诱导,1周时PD模型大鼠平均旋转圈数为(7.3±0.2) r/min,其后逐渐增加;中脑双点组和纹状体单点双注组平均旋转圈数亦有相似的变化趋势,相同时间点各组间平均旋转圈数差异无统计学意义(P>0.05),详见表2。
2.2 大鼠模型损毁侧TH免疫组织化学阳性细胞IOD值
中脑单点组、中脑双点组及纹状体单点双注组大鼠损毁侧TH阳性细胞IOD明显比对照组小(P<0.01); 中脑单点组大鼠损毁侧TH阳性细胞IOD比中脑双点组及纹状体单点双注组小(P<0.05); 中脑双点组大鼠损毁侧TH阳性细胞IOD比纹状体单点双注组小(P<0.05)(表3)。

表1 PD大鼠造模成功率 n(%)

表2 PD大鼠旋转行为变化 r/min
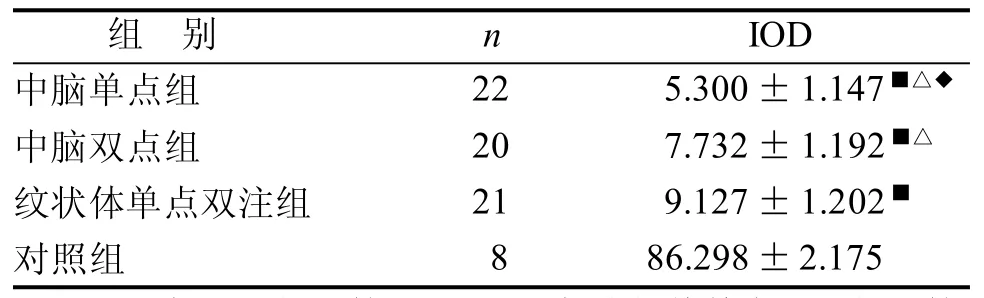
表3 PD大鼠损毁侧TH免疫组化阳性细胞IOD值
2.3 病理学观察
2.3.1 损毁侧HE染色 对照组大鼠神经元相对密集, 排列整齐, 胞浆丰富, 未见皱缩, 胞核居中(图1A);纹状体单点双注组和中脑双点组成功PD大鼠的神经元变性、坏死,细胞数明显减少,细胞空泡变性, 残留细胞皱缩, 排列散乱(图1B、图1C); 中脑单点组成功PD大鼠的神经元大量变性、坏死,细胞数量明显减少, 散在分布, 残留细胞皱缩(图1D)。
2.3.2 损毁侧TH免疫组织化学染色 对照组大鼠损毁侧TH阳性细胞数量较多,胞体较大突起较为明显(图2A); 纹状体单点双注组、中脑双点组及中脑单点组成功PD大鼠损毁侧TH阳性细胞数较对照组明显减少,散在分布,而中脑单点组TH阳性细胞数最少(图2B、C、D)。
3 讨论
Ungerstedt[5]于1968年首次报道了采用6-OHDA建立PD大鼠模型,认为动物旋转模型的某些特点与人类PD相似。6-OHDA是一种神经毒素,与DA在分子结构上相似,但不能够通过血脑屏障,需脑内局部定位注射才能损毁中枢神经系统细胞。注射到中脑黑质的6-OHDA与DA竞争性进入细胞,其化学性质不稳定,能在细胞内外自动氧化为6-羟多胺醌(6-OHDAO)和活性氧(ROS),单胺氧化酶(MAO)诱导其生成H2O2,Fe2+与H2O2进行反应,产生羟自由基,作用于细胞膜, 引发细胞脂质化、蛋白和DNA结构的变化[6,7]。另外, H2O2可对线粒体氧化呼吸链产生直接的抑制作用,引起细胞能量衰竭, 最终使黑质-纹状体通路DA能神经元的变性、缺失, 从而使DA受体处于超敏状态。APO是DA受体激动剂,在注射APO后,损毁侧受体数量增多,高敏感使健侧肢体产生PD症状,运动迟缓、肌强直,双侧运动不能平衡而向健侧旋转[8]。虽6-OHDA定位注射诱导的PD动物模型黑质内并没有典型的Lewy小体形成,但能够产生与人类PD相似的病理及生化表现, 包括黑质DA能神经元变性死亡、胶质细胞增生、黑质纹状体(TH)活性和DA含量降低等[9]。因此,此法成为制造PD动物模型的常用方法。
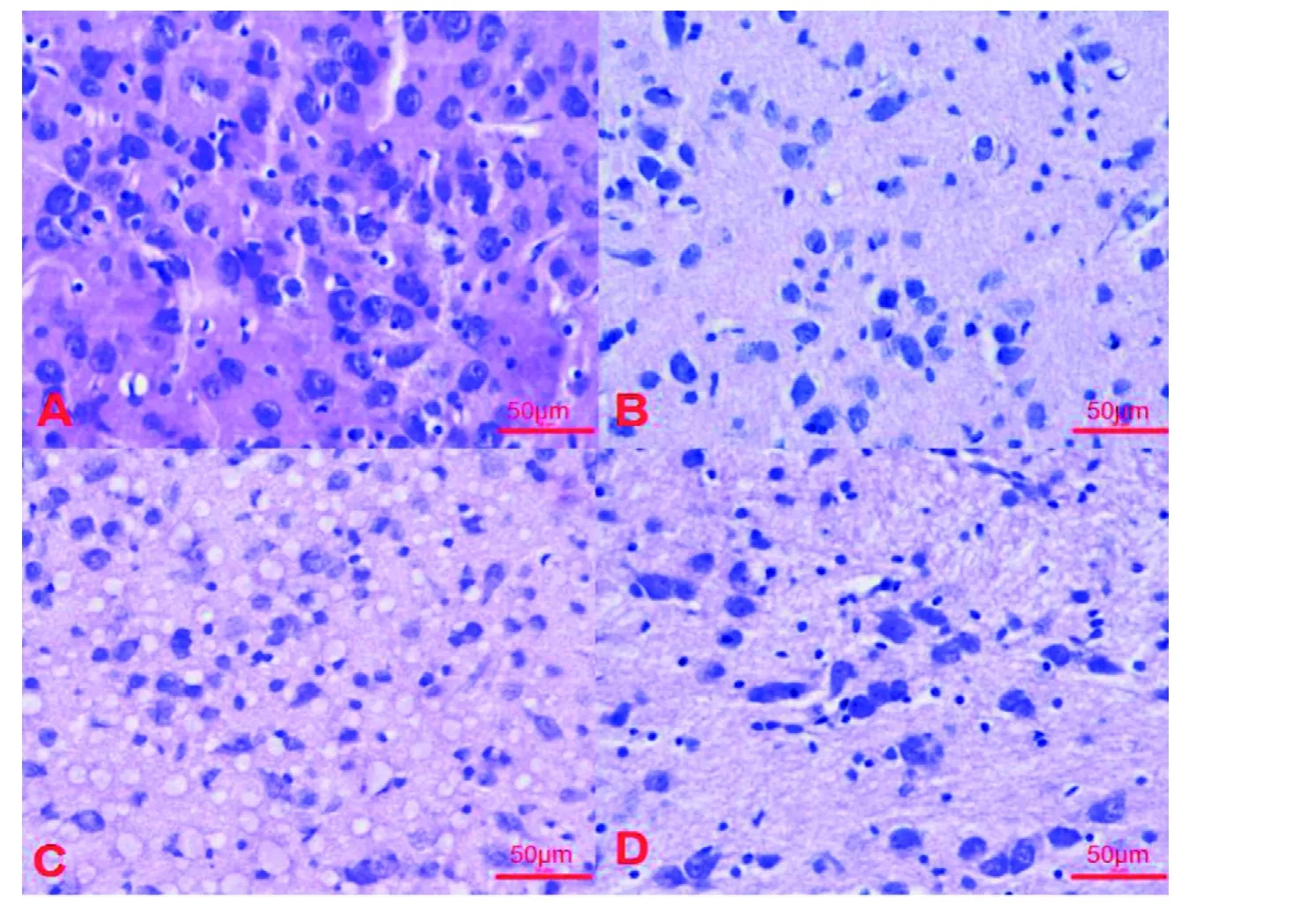
图1 大鼠脑组织HE染色观察

图2 大鼠脑组织TH免疫组织化学染色观察
目前,利用6-OHDA建立PD大鼠模型的方法中,主要的注射部位有中脑黑质致密区、中脑腹侧被盖区及纹状体等,中脑黑质致密区是DA能神经元最密集的部位;腹侧被盖区因解剖范围小,常发生变异,不便于定位,单独应用的模型成功率不高; 纹状体范围大,易于定位,通过DA能神经元末梢对6-OHDA的吸收,使其发生逆行性变性,从而破坏中脑黑质DA能神经元。
本文选择中脑单点、中脑双点和纹状体单点双注进行对比实验,结果显示中脑单点组造模成功率为72.7%,中脑双点组成功率比中脑单点组低(P<0.05),为60.0%, 可能与中脑双点组中每点的6-OHDA剂量比中脑单点组低有关; 而纹状体单点双注组造模成功率最低(P<0.05), 为47.6%,原因可能是纹状体范围过大, 与黑质致密区和腹侧被盖区相比, 相同剂量的6-OHDA损毁的DA能神经元数量有限。中脑单点组经APO诱导,1周时成功PD模型平均旋转圈数为(7.3±0.2) r/min; 2周、4周时均较前增加(P<0.05); 8周时较前差异无统计学意义(P>0.05)。中脑双点组和纹状体单点双注组平均旋转圈数亦有相似的变化趋势,表明6-OHDA建立的PD大鼠模型具有较强的稳定性。TH被普遍认为是对包含DA在内的儿茶酚胺类神经递质的合成有重要影响的第一限速酶, 细胞表达TH是判断神经元为多巴胺能神经元的的金标准[10]。本实验对各组成功PD大鼠损毁侧进行TH免疫组织化学染色, 发现中脑单点组、中脑双点组及纹状体单点双注组TH阳性细胞数明显少于对照组(P<0.01), 验证了6-OHDA建立PD大鼠模型的可靠性。造模3 d内中脑双点组死亡2只, 纹状体单点双注组和对照组各死亡1只,而中脑单点组未出现死亡。大鼠的死亡除了与定位钻孔对大鼠的损伤有关之外, 还与6-OHDA对损毁区细胞的破坏和操作过程中的人为因素有关。
综上所述,本实验中脑单点组24 μg 6-OHDA在中脑黑质致密区单点注射建立PD大鼠模型,操作过程相对简便, 成功率高, 模型稳定, 且动物死亡率低,是一种较为理想的PD大鼠模型建立方法。
