基于药效评价的主成分分析法对不同规格鹿茸差异性研究
2018-09-08曲雷鸣
曲雷鸣, 李 峰, 龚 伟, 刘 威
(1. 辽宁中医药大学附属医院, 沈阳 110032; 2. 辽宁中医药大学药学院, 大连116600)
鹿茸为传统名贵中药, 因具有“壮肾阳、益精血、强筋骨、调冲任、托疮毒”等功效[1], 广泛应用于中医临床与日常保健中。鹿茸由于其药材的来源,鹿角生长特点,以及加工方式、切制的部位等差异,导致鹿茸药材的规格纷繁复杂, 价格迥异等问题,且鹿茸药材的药效物质不明确, 目前尚无行之有效的方法对其进行质量控制。又因鹿茸具有强筋健骨的功效,常用于骨质疏松症的治疗。本研究尝试采用血清药理学方法,比较不同规格鹿茸商品药材对骨髓间质干细胞(BMSCs)增殖及诱导成骨分化的影响,并在测定BMSCs成骨诱导分化过程中相关指标的基础上本研究首次采用主成分分析(PCA),为鹿茸药材的综合质量评价提供新的方法, 也可对鹿茸药材规格进行科学、有效的划分。
1 材料与方法
1.1 实验动物
SPF级雌性SD大鼠72只, 体质量(250±20) g,由长生生物技术有限公司提供[SCXK(辽)2010-0001]。
1.2 实验细胞
大鼠BMSCs购于赛业(广州)生物科技有限公司,批号090405B01。
1.3 实验药品
鹿茸药材分别购于各药材市场,分别为梅花鹿二杠蜡片、梅花鹿二杠二茬蜡片、梅花鹿三岔蜡片、梅花鹿二杠白片、梅花鹿二杠血片、马鹿莲花蜡片、马鹿单门血片和马鹿三岔白片,经辽宁中医药大学药学院中药鉴定教研室李峰老师鉴定,均为鹿科动物梅花鹿 (Cervus Nippon Temminck或马鹿 (Cervus elaphus Linnaeus) 的雄鹿未骨化密生茸毛的幼角,给药前粉碎药材,过80目筛,加50℃蒸馏水,制成0.1 g/mL的混悬液,备用。
1.4 试剂
BMSCs完全培养基、BMSCs成骨分化诱导培养基、胎牛血清(FBS), 均购自赛业(广州)生物科技有限公司; PBS平衡盐溶液(干粉)购于中国Solarbio公司; 0.25%胰蛋白酶、噻唑蓝(MTT)、二甲基亚砜(DMSO)均购自德国Sigma公司; 大鼠碱性磷酸酶(ALP)试剂盒(批号201306)、大鼠骨形成蛋白2(BMP-2)试剂盒(批号201306)、大鼠骨钙素(BGP)试剂盒(批号201305) 均购自上海联硕生物科技有限公司。
1.5 仪器
Infinite M2000多功能酶标仪(奥地利Tecan公司); CK-40F200倒置显微镜(日本Olympus公司);MR1822型低温高速离心机(法国Beckman公司);DHG-9241A型电热恒温干燥箱(上海精宏实验设备有限公司); BH-2型生物显微镜(日本Olympus公司);MS1型迷你振荡器(广州仪科有限公司)。
1.6 溶液配制
1.6.1 BMSCs不完全培养液 配制前的30 min,室温溶解双抗(青霉素、链霉素)5 mL, 谷氨酰胺5 mL,将培养基添加物各个成分加入BMSCs完全培养基440 mL中,4℃冰箱保存备用。
1.6.2 含体积分数10% FBS BMSCs完全培养液 将FBS放置2~8 ℃过夜至完全溶解,与BMSCs不完全培养基按比例配制成含体积分数10% FBS的BMSCs完全培养基。
1.6.3 含0.5% FBS BMSCs培养液 将FBS与BMSCs不完全培养基按比例配制成含体积分数0.5% FBS的BMSCs培养基。
1.6.4 不同浓度鹿茸含药血清培养液 SPF级SD大鼠72只,随机分为9组,8种不同规格鹿茸组每组8只,每日给药剂量为4 mL/kg,灌胃鹿茸混悬液,对照组8只,灌胃等量蒸馏水。以上各组均每日给药2次, 连续给药5 d。末次灌胃1 h后, 10%水合氯醛麻醉(0.3 mL/100 g体质量), 行腹主动脉采血, 4 ℃冰箱静置3 h后, 离心30 min(3 000 r/min),收集血清,使用前用BMSCs不完全培养液,稀释成10%浓度的含药血清。
1.6.5 BMSCs成骨分化诱导培养基 分别将FBS 20 mL, 抗坏血酸 400 μL,β-甘油磷酸钠 400 μL,青链霉素2 mL和谷氨酰胺溶液2 mL,地塞米松溶液20 μL加入BMSCs不完全培养液中,制成含大鼠血清为10%BMSCs成骨分化诱导培养基。
1.7 细胞株培养
大鼠BMSCs接种于50 mL培养瓶中, 置于37 ℃,体积分数5% CO2,饱和湿度的恒温培养箱中培养,待细胞贴壁后, 每3 d换液1次, 继续培养, 待用。
1.8 鹿茸含药血清对BMSCs增殖的影响
1.8.1 检测方法 取生长状态良好的BMSCs,用0.25%的胰蛋白酶消化细胞,用BMSCs完全培养液制备成单细胞悬液,调整浓度为4×l04/ mL,接种于96孔培养板中,每孔体积200 μL。将培养板移入37 ℃,体积分数5% CO2,饱和湿度的恒温培养箱中培养。培养24 h后,吸弃培养板中培养液,换用0.5% FBS培养液培养,使细胞同步化,24 h后吸弃培养液,实验组分为11组,分别为:10% FBS组、10%正常大鼠血清组(空白组)、诱导液组(加入BMSCs成骨分化诱导培养基,作为阳性对照组)和8个不同品质鹿茸组。每组设8个复孔,每孔加入含不同血清的培养液 200 μL,设没有接种细胞的培养孔为调零孔,分别于药物干预24 h、48 h、72 h后,每孔加入5 mg/mL的MTT溶液各10 μL,37 ℃,体积分数5% CO2,饱和湿度的恒温培养箱中孵育4 h后,吸弃孵育液,每孔加入DMSO 100 μL,室温振荡15 min,混匀,待沉淀充分溶解后,在酶标仪上测定吸光度(A)值,测定波长为570 nm。
1.8.2 检测方法 取生长状态良好的BMSCs, 按照传代操作要求用0.25%的胰蛋白酶消化细胞,用含10% FBS的BMSCs完全培养液制备成单细胞悬液,调整浓度为2×104/mL,接种于24孔培养板中,每孔体积500 μL。将培养板移入37 ℃,体积分数5% CO2,饱和湿度的恒温培养箱中培养。于培养24 h后,吸弃培养板中培养液,换用0.5% FBS培养液培养,使细胞同步化,24 h后吸弃培养液,分别加入不同条件培养液500 μL,每组设4个复孔。置于37℃,体积分数5% CO2,饱和湿度的恒温培养箱中孵育,每3 d换液1次。分别于6 d、12 d、18 d后,取诱导后的培养板,吸弃培养液,用0.25%胰蛋白酶消化收集细胞,离心10 min(3 000 r/min),弃上清液,加PBS溶液500 μL,用移液枪反复吹打至液体内无细胞团块。再用PBS稀释细胞悬液,使细胞浓度达到1×106/mL左右,-20 ℃反复冻融3次, 使细胞破坏并释放出细胞内成分, 待细胞充分破碎, 制成悬液。将细胞悬液移入1.5 mL离心管中,离心20 min(3 000 r/min),仔细收集上清,-20 ℃冻存,备用。采用ELISA法对细胞内ALP、BMP-2、BGP蛋白酶体活性进行测定,实验步骤见试剂盒说明书。
1.9 统计学分析
实验数据采用SPSS17.0统计软件进行处理, 多样本均数比较采用单因素方差分析(One-Way ANOVA),实验结果以表示, P<0.05为差异有统计学意义。
2 结果
2.1 不同规格鹿茸含药血清对BMSCs细胞增殖的影响
由表1可知,不同规格鹿茸药材含药血清对体外培养BMSCs增殖均有促进作用,并且其促进作用与时间相关,含不同鹿茸血清培养液干预48 h后, 与空白组比较, 各组A值均显著升高(P<0.01)。梅花鹿二杠蜡片组、梅花鹿三岔蜡片组、马鹿莲花蜡片组A值均显著高于诱导液组(P<0.01),鹿茸腊片对BMSCs增殖影响最为显著。
2.2 鹿茸对BMSCs成骨分化的影响
与空白组比较,不同品质鹿茸药材含药血清组与诱导液组BMSCs经诱导培养后,ALP、BGP、BMP-2表达均有所增加(表2~4)。随培养时间延长ALP表达量呈先增多、后减少的趋势; BMP-2表达量表现为逐渐增加的趋势; BGP表达未现明显规律。
2.3 对不同规格鹿茸进行PCA
2.3.1 数据筛选 MTT法检测的A值表示细胞增殖情况,ALP、BGP、BMP-2是成骨细胞特异性的检测指标,本实验以48 h细胞增殖及12 d的ALP、BGP、BMP-2检测结果值影响因素进行PCA(表5,6)。
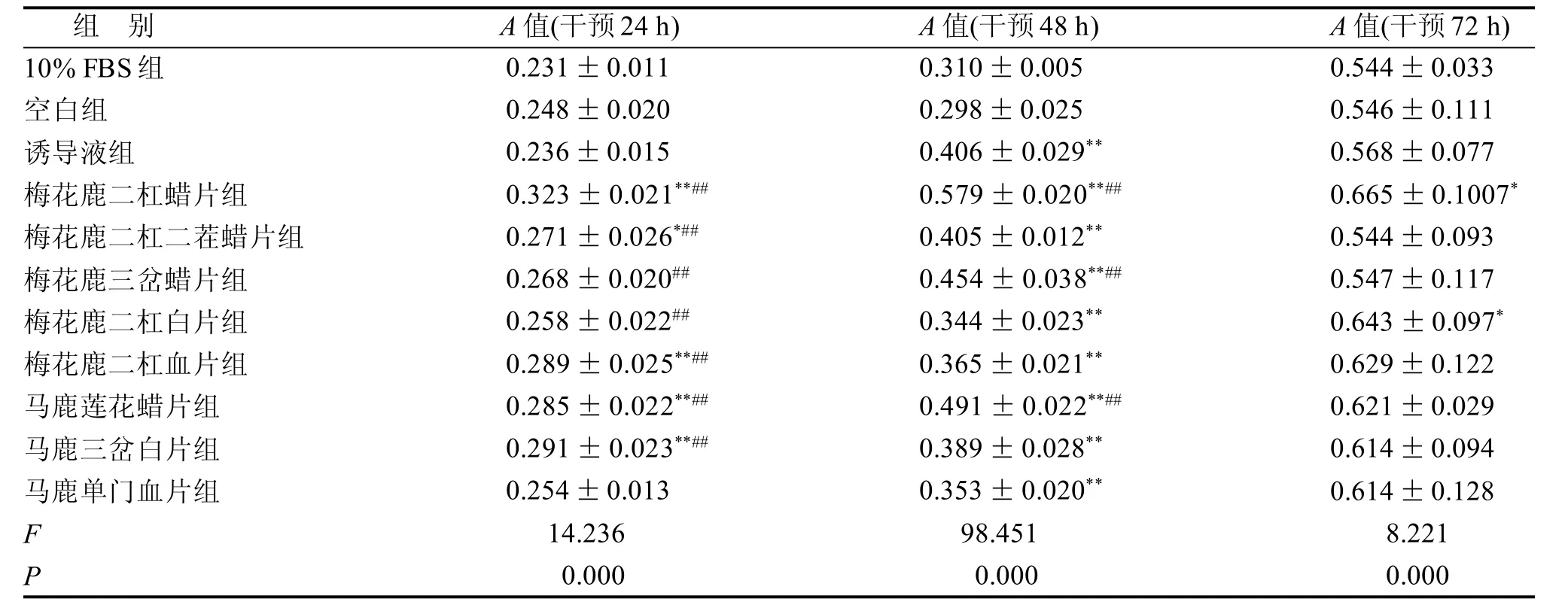
表1 鹿茸含药血清对BMSCs增殖的影响
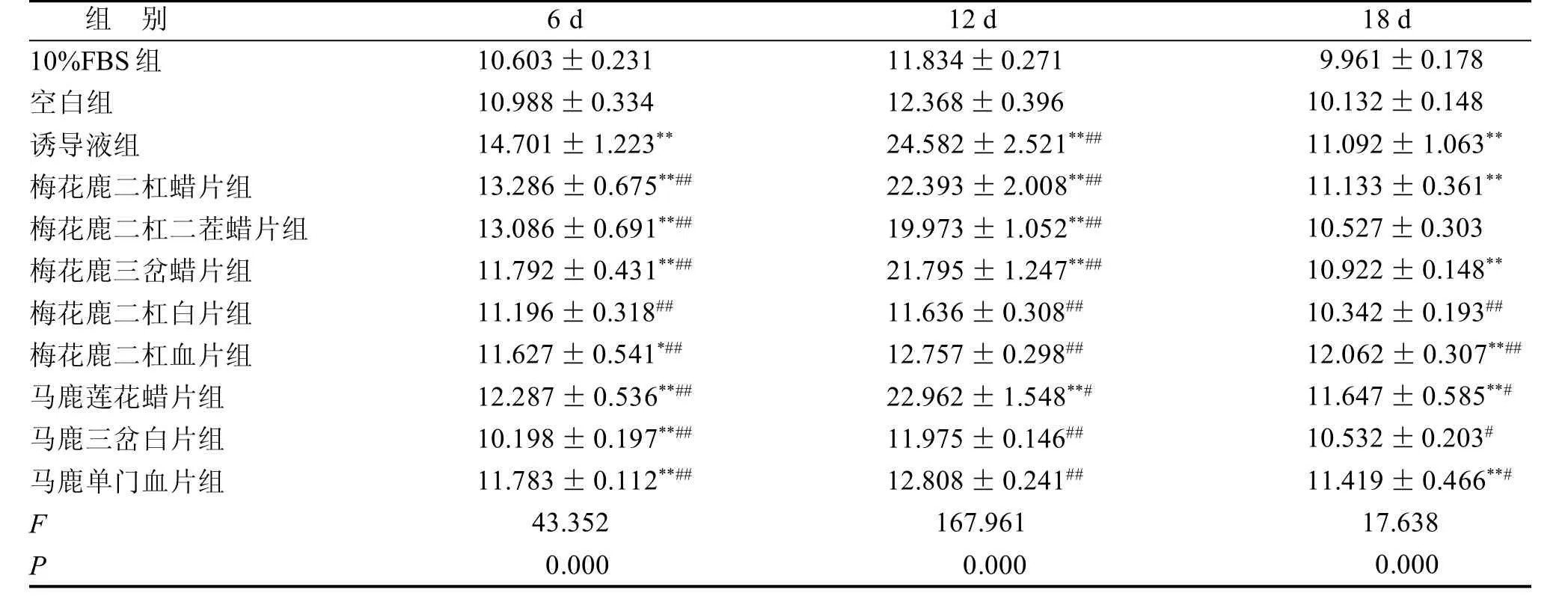
表2 鹿茸含药血清对BMSCs成骨分化过程中ALP活性的影响 U/L
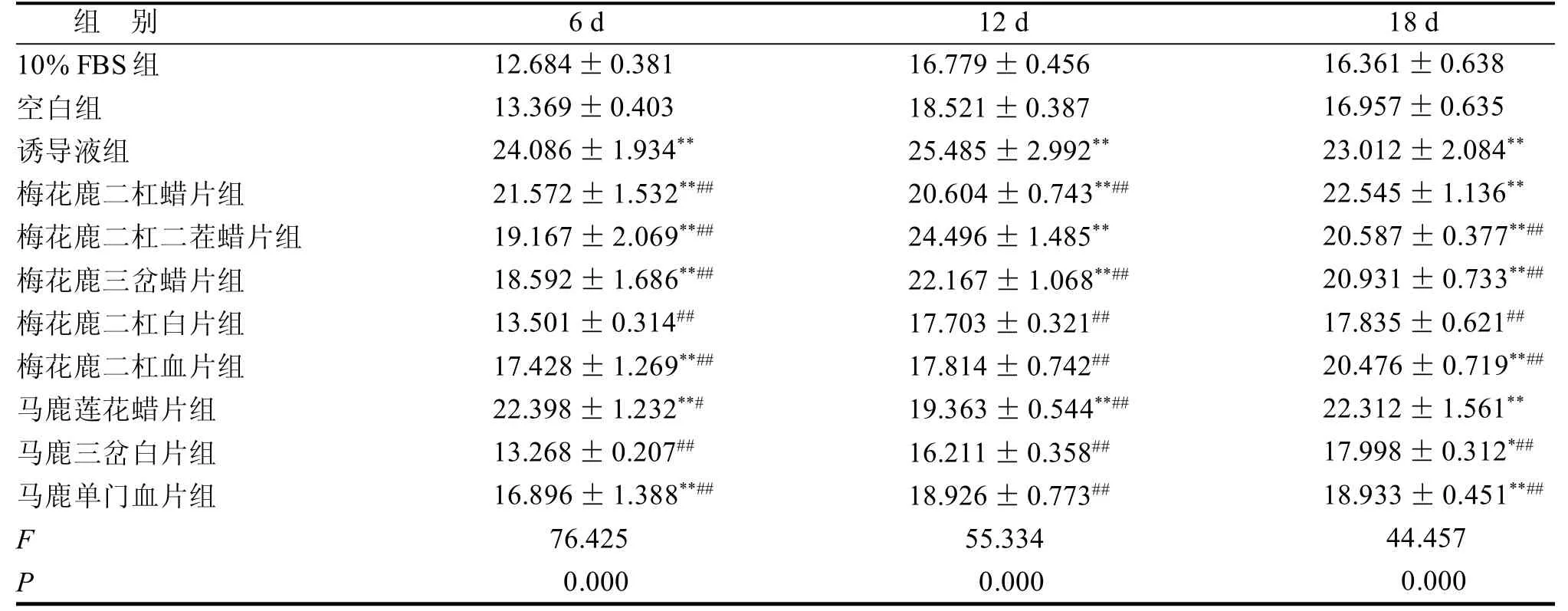
表3 鹿茸含药血清对BMSCs成骨分化过程中BGP活性的影响 μg/L
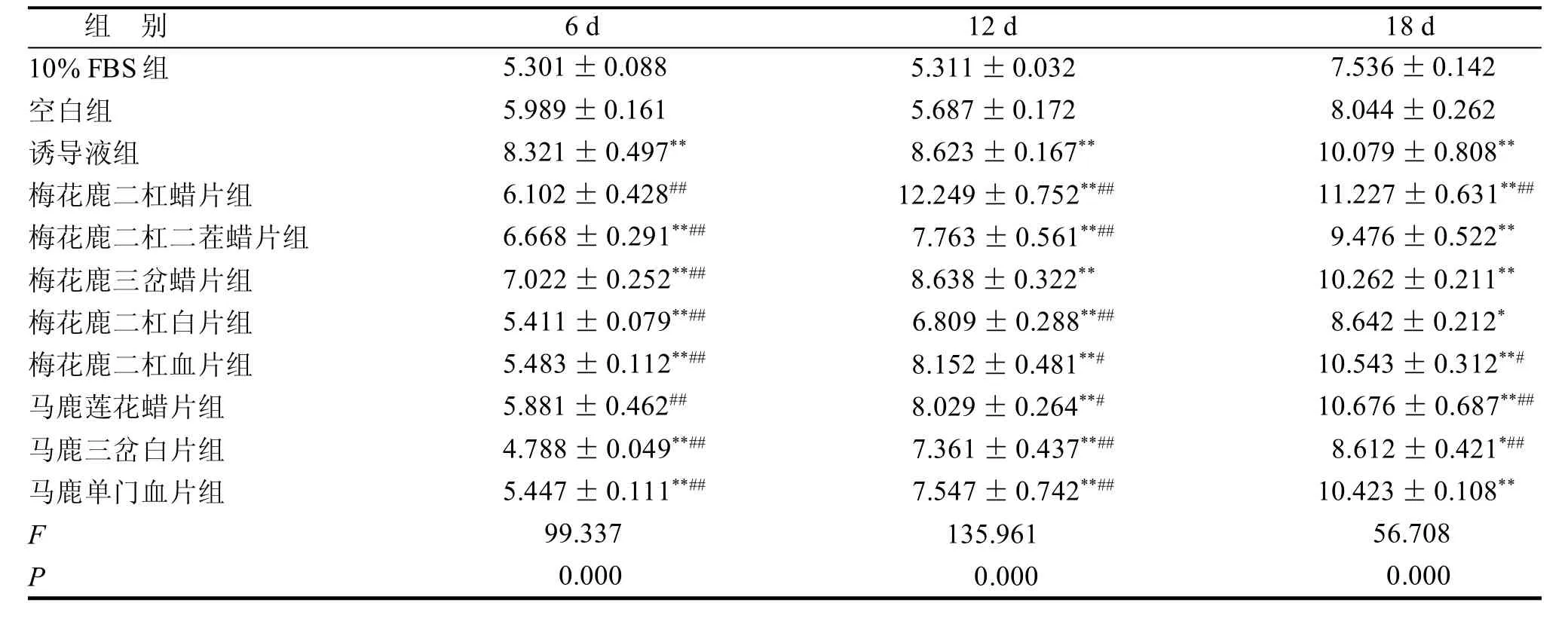
表4 鹿茸含药血清对BMSCs成骨分化过程中BMP-2活性的影响 μg/L
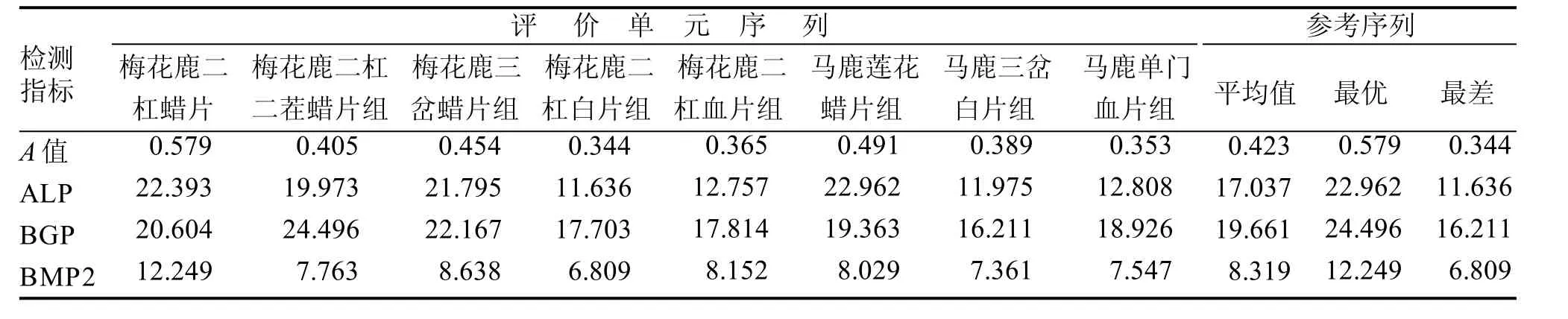
表5 BMSCS相关指标检测结果
2.3.2 数据的处理 化学指标数据采用Excel 2007,数据含量差异较大, 分析前先将原始数据进行标准化处理, 以消除由原始变量的量纲的不同和数据差异过大而对结果的影响, 使标准化后的数据具有可比性, 然后使用SPSS16.0软件进行主成分, MassLynxV4.1软件绘制主成分得分图。
2.3.3 PCA结果 通过MassLynxV4.1软件绘制A值和ALP值通过降维后不同规格鹿茸样本在二维空间的分布聚类情况,结果见图1,图中横坐标表示每个样本的第一主成分得分值。纵坐标表示每个样本的第二主成分得分值。

表6 BMSCS相关指标数据规范化结果
3 讨论
本实验以含10%大鼠鹿茸血清的培养液对BMSCs进行体外培养,MTT法检测BMSCs细胞增殖情况,结果表明鹿茸有促进BMSCs增殖的作用,不同品质鹿茸药材促进BMSCs增殖作用不同,培养48 h,作用最为显著,鹿茸蜡片作用优于成骨诱导液。
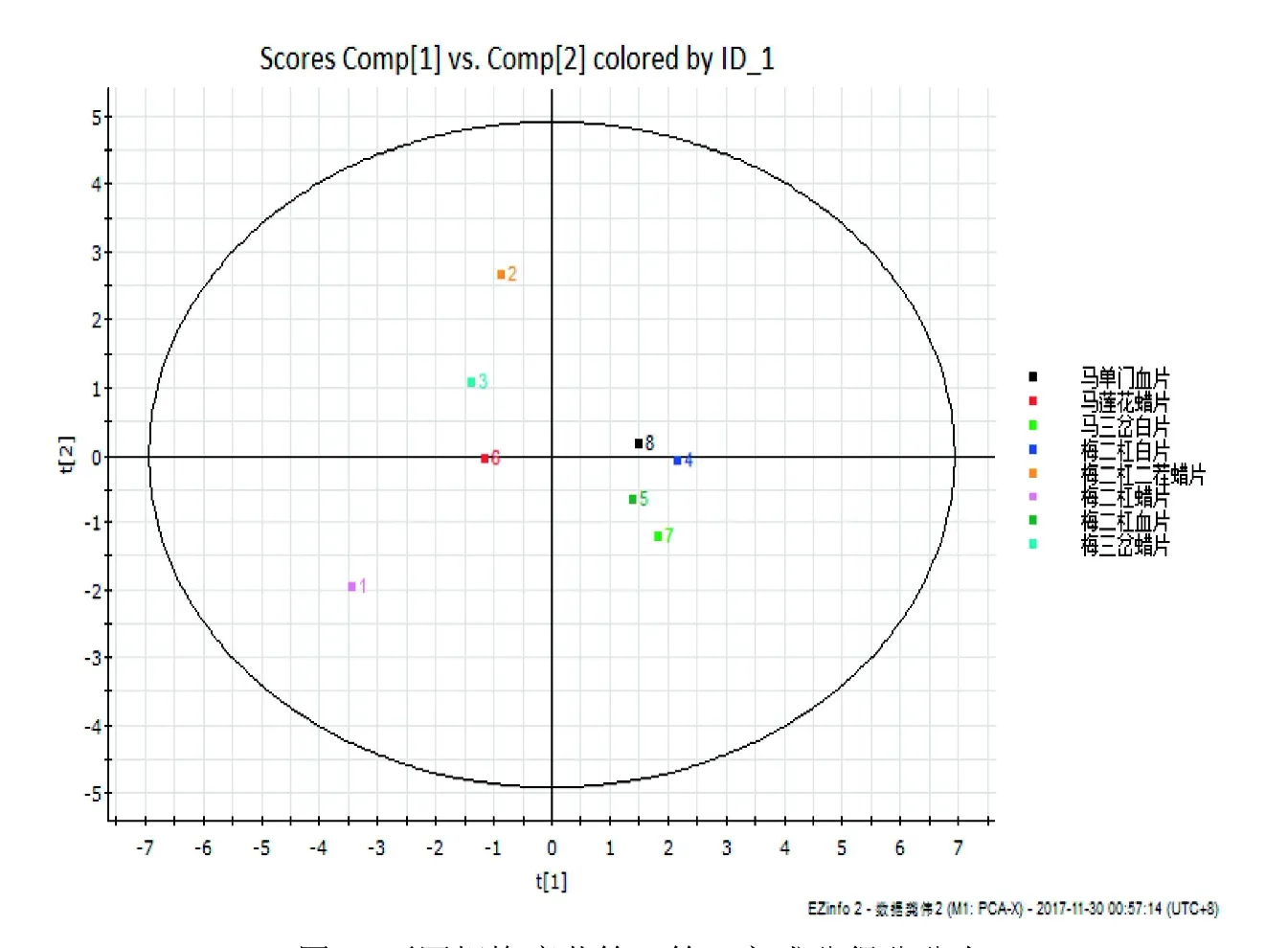
图1 不同规格鹿茸第一第二主成分得分分布
ALP活性的提高是BMSCs向成骨细胞分化的重要标志,常用细胞中该酶的活性高低来检测成骨细胞的存在和成骨细胞的分化成熟程度[2~4]。BGP反映成骨细胞活性的主要指标,在骨矿化峰期之后才出现积聚,是成骨细胞分化晚期的标志物[5-7]。BMP-2促进骨形成和诱导成骨细胞分化作用最为显著[8~10]。鹿茸含药血清可促进BMSCs成骨分化过程中ALP、BGP、BMP-2蛋白的分泌,且不同品质鹿茸中,蜡片促进BMSCs成骨分化的能力明显高于成骨诱导液,但鹿茸对ALP、BGP、BMP-2影响并不与其品质成简单的线性相关。鹿茸头茬腊片对ALP影响显著,梅花鹿茸二杠二茬蜡片与梅花鹿茸三岔蜡片对BGP影响显著,梅花鹿二杠腊片对BMP-2影响显著。
以不同规格鹿茸含药血清作用于BMSCs的相关指标为变量,使用SPSS16.0软件进行PCA,从主成分得分图可以看出,鹿茸蜡片和鹿茸白片、血片样本分散于第一第二空间中,即梅花鹿茸和马鹿茸蜡片部分分布存在交叉,这与其A值及ALP值相关,A值及ALP值越接近,其在主成分图上的重叠率越高。没有明显的分组现象。通过A值及ALP值作为分析变量在一定程度上表明了样本之间的亲缘关系。判别分析结果表明,鹿茸蜡片全判为1类,鹿茸骨片、血片全判为2类,判别符合率为100%,判别模型效果较好。
