可过滤液体饮料中微生物学检验滤膜法和平板计数法的等效性比较分析
2018-09-08周锦祯刘婷婷陈鉴宇郭伟鹏
周锦祯,刘婷婷,陈鉴宇,郭伟鹏
(华南应用微生物国家重点实验室;广东省菌种保藏与应用重点实验室;广东省微生物应用新技术公共实验室;广东省微生物分析检测中心;广东省微生物研究所,广东广州 510070)
滤膜法广泛应用于环境监测、食品及饮料工业、 化妆品、制药工业品质控制中微生物的分析。其方法是将一定量样品注入的微孔薄膜的滤中,经过抽滤,细菌被截留在滤膜上,将滤膜贴于指定培养基上,在适宜的温度环境下培养后,经计数和鉴定滤膜上生长的菌落,依据过滤样品体积计算样品中的菌落数。滤膜法优点较多,当产品含有抑菌成分物质时,采用滤膜法可以有效降低或去除抑菌成分,消除抑制作用,且可以保证标准要求的检出限,提高样品检测灵敏度[1~3]。滤膜法较平板计数法虽成本高,但其优点是不受体积限制,且操作简便,快速,浓缩效应使微生物检测的准确度提高,再现性好。主要适用于杂质较少且含菌量少的可过滤样品。药品、水等微生物方面的检验均较多使用滤膜法,但由于食品的样品特性和微生物限值导致使用滤膜法较少,食品微生物检测方法主要使用平板计数法进行微生物的定量检测。但随着食品微生物检验技术的发展进步,滤膜法逐渐应用于饮料原辅料,成品及半成品等微生物检验中,在饮料的质量控制中,滤膜法适用于非混悬饮料成品及半成品的微生物检验[4]。针对可过滤饮料这种食品用滤膜法检测微生物学指标,本实验用滤膜法与平板计数法测定可过滤饮料样品中的微生物学指标,包括:菌落总数测定、霉菌计数、酵母计数以及大肠菌群计数检验。参照采用ISO 17994-2014《水质-用两种定量方法对比微生物回收率的基本要求》对滤膜法和平板计数法的结果进行比较分析,以验证两者在可过滤液体饮料微生物学检验过程中的可替代性及等效性,为推动滤膜法在微生物分析检测中的应用提供科学参考数据。
1 材料与方法
1.1 实验菌株
枯草芽孢杆黑色变种Bacillus subtilis var. niger(ATCC 9372)、白色念珠菌canidia Albicans(ATCC 10231)、黑曲霉Aspergillus niger(ATCC 16404)、大肠杆菌Escherichia coli(ATCC 25922)标准菌株均来源于广东省微生物菌种保藏中心(国家专利菌种保藏平台)。
1.2 实验样品
市售某品牌饮料。
1.3 培养基及试剂
计数琼脂培养基(PCA)、结晶紫中性红胆盐琼脂培养基(VRBA)、马铃薯葡萄糖琼脂培养基(PDA)、孟加拉红琼脂培养基。
1.4 试验设备
恒温培养箱、恒温水浴锅、振荡器、微量移液器及枪头、500 mL无菌锥形瓶、直径90 mm无菌培养皿、不锈钢过滤系统、孔径0.45 μm无菌微孔滤膜。
1.5 实验方法
1.5.1 平板计数法
样品前处理:将新鲜培养的目标菌制备成一定浓度的菌液,分别加入到饮料样品中,使饮料样品含菌液浓度为<100 CFU/mL。
菌落总数[5]:按照《食品安全国家标准 食品微生物学检验 菌落总数测定》GB 4789.2-2016进行检验,检验结果以CFU/mL为单位报告。
霉菌和酵母计数[6]:按照《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》GB 4789.15-2016第一法进行检验,检验结果以CFU/mL为单位报告。
大肠菌群[7]:按照国家标准《食品安全国家标准 食品微生物学检验 大肠菌群计数》GB 4789.3-2016第二法(大肠菌群平板计数法)进行检验,检验结果以CFU/mL为单位报告。
1.5.2 滤膜法
样品前处理:将新鲜培养的目标菌制备成一定浓度的菌液,分别加入到饮料样品中,使饮料样品含菌液浓度为<100 CFU/mL,吸取1 mL含菌液饮料样品到99 mL无菌饮料样品中制备成100 mL待测样品过滤,使饮料样品含菌液浓度为<100 CFU/100 mL。
过滤前先对不锈钢过滤装置进行灼烧灭菌,然后用无菌平头镊子夹取一次性无菌滤膜放置在过滤头上,安装滤杯。在洁净工作台中进行样品的过滤操作,无菌条件下将100 mL待测样品或样品稀释匀液加入滤杯中。打开真空泵开关进行抽滤,当全部液体通过滤膜后,再加100 mL无菌生理盐水至滤杯,再次抽滤,当全部液体通过滤膜后,关闭抽滤开关,移去滤杯,用无菌平头镊子移取滤膜至相应的琼脂培养基上,平铺并避免滤膜与培养基之间夹留着气泡。将贴好滤膜的平板置于恒温培养箱中培养。菌落总数测定、大肠菌群计数的平板置于 36 ℃±1 ℃恒温培养 48 h±2 h;霉菌和酵母计数的平板置于28 ℃±1 ℃恒温培养5 d,观察滤膜上生长的菌落情况并计数,报告结果。
1.5.3 预实验
对滤膜法进行线性分析,线性要求:截距=0斜率=1(95%的置信区间)。方法:将新鲜培养的目标菌制备成一定浓度的菌液,分别加入到样品中,使样品含菌液浓度为500~100 CFU/100 mL以内,分别过滤含相当于 100 mL、10 mL、1 mL 样品的 100 mL 过滤体积样品,按照滤膜法进行试验,重复5次。根据所得的结果进行线性分析,以验证滤膜法本身的线性是否符合要求。
1.5.4 数据统计[8]
在本次试验中,按照ISO 17994-2014《水质-用两种定量方法对比微生物回收率的基本要求》对结果进行统计比较。
1.5.5 数据转换
两种方法比较的过程中,采用相对差(xi)作为统计用的数据,相对差的计算见公式(1):

式中:a-样品经实验方法(膜过滤方法)检测所得的一个结果;b-同一样品经参比方法(平板计数法)检测所得的一个结果。
1.5.6 样品量的确定
两种菌落计数法比较所需的样品量,在95%可信限上判断给出的平均相对差的总样品数(n),由公式(2)确定:

式中:n-实验的总样品数量;s-标准偏差;L-最小显著差。
在本试验中,L=10。
有时候需要在一个与协同试验不同的生态或地理环境下验证等效性比较的结果。当一个实验室只需要验证一个并被正式接受的方法时,可以充分利用以前的测试结果。实验室应能够获得协同试验报告,相应地,应该也有相对差异的平均值和标准差的估计值,这种情况,可用式(3)计算所需额外样品数量。然而,不论计算结果如何,样品数量都不应少于30。

式中:n-所需的样品数量;y-相对差异的标准差;以下两数中较大的一个,见公式(4、5)。

式中:2L-两种方法“没有差异”时与扩展不确定度为 0的最大允许偏差,以%表示;¯x-相对差异的算术平均数,以%表示。
1.5.7 统计量的计算
平均相对差(¯x)用公式(6)计算:

式中:n-样品数;xi-样品i计数结果(ai与bi)的相对差异。
扩展不确定度数据S(即样品结果的相对差)标准不确定度(标准差)用公式(7)计算:

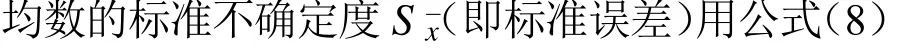
计算:

扩展不确定度(W)为均数的标准不确定度乘以扩展引子(k=2),用公式(9)计算:

均数的扩展不确定度的置信区间,用公式(10、11)计算:

1.5.8 等效性的判定
等效性一般认为是一种方法不会比另一种方法得出显著高或显著低的结果。在实际过程中,最大容许偏差在均数的扩展不确定度的置信区间覆盖范围内即可认为两种方法具有等效性。
在本试验中,为比较方法之间有无等效性,并没有比较方法之间结果的高低,即为比较结果之间的差异有无统计学意义,故采用双侧检验。当(xL<-2L和xU>0)或(xL<0和xU>+2L)时,视为数据不足,无法判断,此时应当增加检测样品数量;当(-2L≤xL≤0)和(0≤xU≤+2L)时,可认为两种方法无差异;当(xL>-2L和xU<0),或(xL>0 和xu<+2L)法在统计学上有差异,但此差异太小无实际(微生物学)意义,此种情况下,统计学和实际应用的结论有所不同,使用者可以根据自己情况自行选择,从实际应用的角度来看,可以认为两种方法是等效的;当(xL>0)或者(xU<0)时,可以认为两种方法有差异。
2 结果与讨论
2.1 滤膜法重现性结果

图1 菌落总数滤膜法线性关系图Fig.1 The filter membrane linear relationship of aerobic plate count results

图2 霉菌计数滤膜法线性关系图Fig.2 The filter membrane linear relationship of enumeration of moulds results
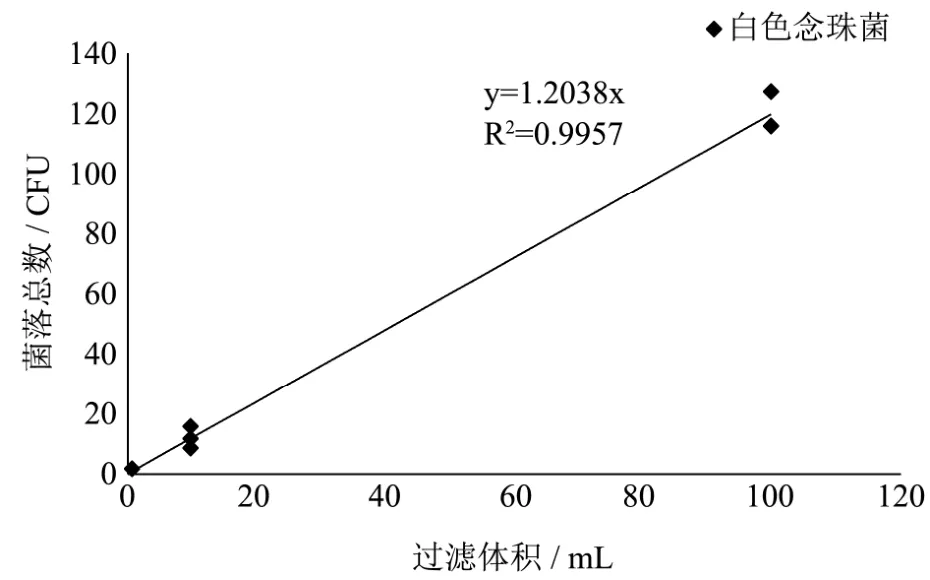
图3 酵母计数滤膜法线性关系图Fig.3 The filter membrane linear relationship of enumeration of yeastes results

图4 大肠菌群计数滤膜法线性关系图Fig.4 The filter membrane linear relationship of enumeration of coliforms results
根据表1结果所得线性关系图(图1~4)可知在菌落总数、霉菌计数、酵母计数以及大肠菌群计数检测中滤膜法对同一样品不同体积的样品结果具有较好的线性关系,可保证滤膜法的重现性。
2.2 滤膜法与平板计数法等效性评价结果
2.2.1 样品量的确定
采集30份样品进行样品量确定的预实验,每个样品同时进行滤膜法和平板计数两种方法检测,统计量计算见表2。
根据表2中所示标准差,计算出各个项目检查所需要的样品量。

表1 滤膜法线性关系实验结果Table 1 Linear relationship of filter method results
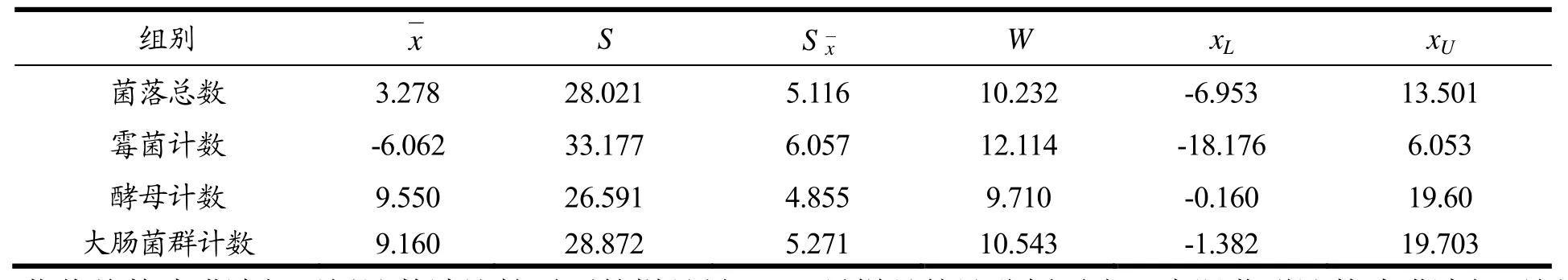
表2 预实验中等效性检验统计分析结果Table 2 Statistical analysis results of equivalence test in pre-test(n =30)
菌落总数滤膜法与平板计数法比较需要的样品量为31,预实验采集样品数量30个不能满足样品统计分析需求。霉菌计数滤膜法与平板计数法比较需要的样品量为44,预实验采集样品数量30个不能满足样品统计分析需求。酵母计数滤膜法与平板计数法比较需要的样品量为28,预实验采集样品数量30个能满足样品统计分析需求。大肠菌群计数滤膜法与平板计数法比较需要的样品量为33,预实验采集样品数量30个不能满足样品统计分析需求。
根据样品的确定量试验,酵母计数能满足样品统计量分析,菌落总数、霉菌计数以及大肠菌群计数的样品量均不能满足统计分析,为更好进行下一步分析,4个项目均按照同样的方法增加检测至100份样品。
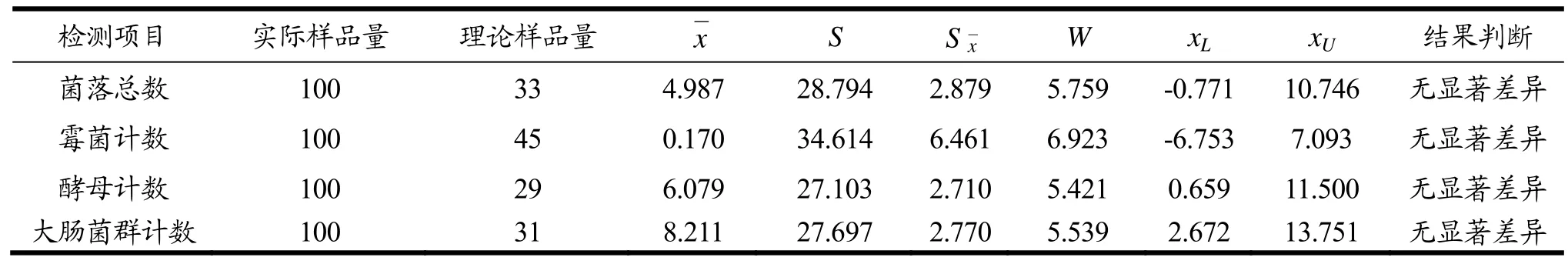
表3 等效性检验统计分析结果Table 3 Statistical analysis results of equivalence test(n=100)
根据表3中所示标准差,菌落总数、霉菌计数、酵母计数以及大肠菌群进行等效性的统计分析所需要的样品量为33、45、29、31,本实验对100份样品进行检测,满足条件要求。
根据表3中所示置信区间的下限值和上限值,可知:
菌落总数滤膜法与平板法xL=-0.771,xU=10.746,满足当(-2L≤xL≤0)和(0≤xU≤+2L)时,表明两种方法在统计学上无显著差异。
霉菌计数滤膜与平板法xL=-6.753,xU=7.093,满足当(-2L≤xL≤0)和(0≤xU≤+2L)时,表明两种方法在统计学上无显著差异。
酵母计数滤膜法与平板法xL=0.659,xU=11.500,满足当(-2L≤xL≤0)和(0≤xU≤+2L)时,表明两种方法在统计学上无显著差异。
大肠菌群计数滤膜法与平板法xL=2.672,xU=13.751,满足当(xL>-2L和xU<0)或(xL>0和xu<+2L)时,表明两种方法在统计学上有差异,但此差异太小无实际(微生物学)意义,在微生物学实际应用中认为结果无显著差异。
可见本实验所进行的4个检测项目:菌落总数、霉菌计数、酵母计数以及大肠菌群计数用滤膜法与平板计数法所得的数据分析后依据判断标准可知滤膜法与平板计数法两种检测方法的等效性验证结果无显著差异,可以认为两种检测方法在用于检测可过滤液体饮料中菌落总数、霉菌计数、酵母计数以及大肠菌群计数时具有等效性。
3 结论
3.1 通过以上试验证明滤膜法与平板计数法用于可过滤液体饮料检测菌落总数、霉菌计数、酵母计数以及大肠菌群计数结果比较分析均无显著差异,可作为评价可过滤液体饮料中微生物污染的方法。
3.2 此次试验是比较的两种不同方法的检测结果的计数形式为CFU/mL,以及CFU/100 mL,本次采用的ISO 17994-2014,《水质-用两种定量方法对比微生物回收率的基本要求》可以进行不同结果表示形式检测方法之间法比较,且具有样品量的具体要求和明确的等效性判断标准,对微生物检验方法之间的比较具有指导意义[9~11]。
3.3 滤膜法主要起到富集微生物、分离去除样品中对微生物生长产生干扰的因素的作用,可以有效提高检测结果的零敏度和可靠性。本实验选用孔径为0.45 μm的滤膜,因为这是被认作是微生物恢复和生长的标准滤膜,其应用最为广泛,兼顾了对微生物的高截流效率和对液体的快速过滤要求[12]。在操作过程中有更多的细节需要注意:采用不同直径的滤膜,冲洗量应先进行相应的调整。使用时,应保证滤膜在过滤前后的完整性。供试液经滤膜过滤,总过滤量不得超过1000 mL,避免大体积,过高流速的冲洗造成滤膜上的微生物受损伤,滤膜贴于平板上不得有空隙或气泡,否则影响微生物的生长。
