枯草芽孢杆菌和黑曲霉固态发酵制备核桃多肽 的工艺条件优化
2018-09-08刘潇郭丽娜马海乐王珂吴平洪晨赵兴张成
刘潇,郭丽娜,马海乐,王珂,吴平,洪晨,赵兴,张成
(1.江苏大学食品与生物工程学院,江苏镇江 212013)(2.中储粮镇江粮油有限公司,江苏镇江 212013)
核桃又名胡桃、羌桃,属胡桃科胡桃属植物,与扁桃、腰果、榛子并称为世界四大干果。我国有着丰 富的核桃资源,其产量更是超过世界核桃总产量的50%以上。核桃富含蛋白质、不饱和脂肪酸、矿物质以及多种活性物质[1]。核桃不仅可作为油脂的来源,同时还能作为优质蛋白质来源。核桃粕是核桃经去壳后,将核桃仁压榨取油后所得到的块状或粉状副产品,其中核桃蛋白质含量占核桃粕干重30%~70%[2]。核桃蛋白中18种氨基酸含量比例平衡,尤其是对人体有重要功能的谷氨酸、天门氨酸、精氨酸含量较高[3]。作为一种优质的蛋白资源,企业往往将核桃粕作为饲料原料或废弃物进行处理,将其制备成核桃粕多肽能极大提高对核桃蛋白的利用,有效增加核桃粕的附加值。核桃多肽是以核桃粕为原料,通过生化反应将大分子蛋白降解为小分子肽混合物,其具有一定生物活性。有研究表明核桃多肽对超氧阴离子自由基、羟基自由基以及 DPPH 自由基有一定清除作用[4~6]。目前以蛋白质为原料制备多肽的方法主要有酶水解法、微生物发酵法和化学水解法[7]。微生物发酵因微生物能利用原料中多种营养物质、原料无需进行蛋白提取等优点成为研究的热门。
固态发酵相比液态发酵具有原料处理简单、技术简单、投资少、能源消耗低、后期处理简单、发酵粗放不易杂染菌等优点[8]。目前,关于核桃粕的研究主要集中在液态发酵制备多肽、核桃多肽功能评价及应用、发酵制备核桃蛋白饮料等方面,所涉及的菌种多为黑曲霉,其他菌种尤其是细菌的研究还较少,因此本研究旨在通过对枯草芽孢杆菌和黑曲霉的生产性能比对研究,进一步丰富核桃粕固态发酵用菌种,进一步提高核桃多肽的产量,提供更高效的固态发酵制备核桃多肽的方法。本研究采取固态发酵的方法,采用单因素优化法筛选固态发酵工艺参数条件,以多肽最终得率作为评价指标进行枯草芽孢杆菌和和黑曲霉固态发酵制备核桃粕多肽的效果研究,为工业化生产以及核桃副产物资源有效利用提供参考。
1 材料与方法
1.1 材料与试剂
核桃粕(产于辽宁本溪桓仁东北野生山核),辽宁长白仙子生物科技有限公司;枯草芽孢杆菌10160,本实验室留存;黑曲霉GIM3.452,广东省微生物研究所微生物菌种保藏中心;还原型谷胱甘肽、马铃薯葡萄糖培养基、营养肉汤均为生物试剂;其他试剂均为分析纯,购置于国药集团。
1.2 实验仪器与设备
BS124S型电子天平,赛多利斯科学仪器有限公司;YM30Z型灭菌锅,上海三申医疗器械有限公司;JJ-CJ-2FD型双人单面超净台,苏州金净净化设备科技有限公司;PHS-25型数显式PH计,上海精密科学仪器有限公司;DL-5台式离心机,上海安亭科学仪器厂;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;HJ-4型多头磁力搅拌器,上海中大仪器科技有限公司。
1.3 试验方法
1.3.1 核桃粕成分测定
蛋白含量测定:凯氏定氮GB 5009.5-2016食品安全国家标准食品中蛋白质的测定;
脂肪测定:索氏提取GB 5009.6-2016食品安全国家标准食品中脂肪的测定;
灰分测定:GB 5009.4-2016食品安全国家标准食品中灰分的测定;
淀粉含量测定:GB 5009.9-2016食品安全国家标准食品中淀粉的测定;
水分测定:GB 5009.3-2016食品安全国家标准食品中水分的测定。
1.3.2 菌种活化及种子液制备
将所购黑曲霉按菌种说明接种到斜面培养基上活化,在28 ℃生化培养箱中培养至孢子成熟后,用无菌生理盐水将孢子洗下接种于PDA培养基上,28 ℃培养7 d,使用前,取孢子成熟的PDA培养皿,用少量无菌水将孢子洗下,用血球计数板计数后,调节孢子浓度至 108cfu/mL[9]。
实验室保存的枯草芽孢杆菌接种在固体基础培养基后,置于37 ℃生化培养箱中静置活化48 h,随后,用接种环挑取2环菌体接入100 mL已灭菌的液体种子培养基中培养,培养温度37 ℃,摇床转速180 r/min,培养24 h。取活化后的液体培养基1 mL接入100 mL液体培养基三角瓶内用进行扩大培养,培养温度37 ℃,摇床转速 180 r/min,培养 12 h,得到发酵种子液,用无菌生理盐水适当稀释并调节菌液浓度至 107cfu/mL。该发酵种子液应于当内一次用完。
1.3.3 固态发酵
核桃粕经粉碎后过40目筛,准备若干250 mL烧杯,每个烧杯装 40.00 g 核桃粕,121 ℃灭菌 20 min,灭菌后无菌操作添加无菌水。按接种量(5、10、15和20%)接入发酵种子液,玻璃棒搅拌混匀,用纱布封口,在实验设计条件下进行发酵。发酵完毕后,将样品取出,于55 ℃烘箱干燥48 h,粉碎过40目筛备用[10]。
发酵条件优化,参照文献[11]进行影响因素优化。首先以发酵时间(0、1、2、3、4、5、6、7、8和9 d)为单一研究参数,研究最佳发酵时间参数,在确定发酵时间后,依次研究原料粉碎粒径(不粉碎、20、40和60目)、发酵温度(28、31、34和37 ℃)、接种量(5、10、15和20%)、料液比(1:0.5、1:0.75、1:1、1:1.25)对发酵制备核桃多肽的影响,以多肽产量为指标,进行试验。
1.3.4 多肽含量的测定采用双缩脲法测定核桃多肽浓度[12,13]
标准曲线测定:将还原型谷胱甘肽用体积分数为5%的三氯乙酸以此配制成 0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mg/mL的四肽标准溶液,分别取6.0 mL标准溶液加入4.0 mL双缩脲试剂,混匀静置 10 min 后,4000 r/min 离心 10 min,取上清液在540 nm波长处测定吸光度,重复上述步骤以6 mL 5%三氯乙酸与4 mL双缩脲试剂反应后的溶液为空白进行调零。
样品多肽的测定:准确称取2 g发酵后干燥的样品(精确至0.0001 g),加40 mL蒸馏水,磁力搅拌30 min,取 8 mL 上清液于 4000 r/min 离心 10 min,取4 mL离心后上清液加入4 mL 10%的三氯乙酸溶液,混匀静置 10 min,继续以 4000 r/min 离心 10 min,将离心后上清液全部转移到25 mL容量瓶中,用5%的三氯乙酸定容,取6.0 mL样液加入4.0 mL双缩脲试剂,混匀静置 10 min,然后 4000 r/min 离心 10 min,取上清液在540 nm波长处测定OD值[14]。多肽含量按照以下公式计算:

式中:c为上清液中多肽的质量浓度,mg/mL;v溶解样品提取多肽所用蒸馏水体积,mL;m为原料发酵后称取测定样品质量,g。
1.3.5 分子量分布采用高效凝胶过滤色谱法测定多肽的分子量分布[15]
样品制备:样品经干燥后,粉碎,准确称取 2 g样品(精确至0.0001 g),加20 mL蒸馏水,磁力搅拌30 min,取 5 mL 上清液 4000 r/min 离心 10 min,取 1 mL过0.22 μm水系膜,留作分子量测定用。
色谱柱:TSK gel G2000(300 mm×7.8 mm)流动相的组成为:乙腈:水:三氟乙酸=45:5:0.1,洗脱流速:0.5 mL/min,检测波长:220 nm,柱温:30 ℃,进样量:10 μL。液相系统的程序控制和数据处理采用软件Breeze(Waters,MA,USA)。以保留时间(t)为横坐标,分子量的对数值(lg Mr)为纵坐标,并采用以下已知分子量的标准品作标准曲线:牛血清白蛋白(67000 u)、细胞色素 C(12500 u)、杆菌肽(1450 u)、L-色氨酸(204 u)。标准曲线回归方程:Y=-0.283X+7.981(R2=0.998,X为保留时间,Y为分子量的对数值 lg Mr)对各样品的色谱峰进行区域划分、积分,每块区域的相对峰面积大小即为各分子量大小范围的相对含量。
1.4 实验设计
1.4.1 发酵条件优化
参照文献[11]进行影响因素优化。
首先以发酵时间(0、1、2、3、4、5、6、7、8和9 d)为单一研究参数,研究最佳发酵时间参数,在确定发酵时间后,依次研究原料粉碎粒径(不粉碎、20、40 和60目)、发酵温度(28、31、34和37 ℃)、接种量(5、10、15和20%)、料液比(1:0.5、1:0.75、1:1、1:1.25)对发酵制备核桃多肽的影响,以多肽产量为指标,进行试验。
1.5 统计分析
提取或样品测试均是三次平行,所有数据表示为“平均值±标准误差”,采用SPSS 22.0进行数据处理,并做t检验分析,显著性差异(p<0.05);数据采用Excel 2013进行作图。
2 结果与分析
2.1 核桃粕组成
经实验测得该核桃粕蛋白质含量较高,是作为制备多肽的理想原料,丰富的蛋白质为微生物降解肽链提供了理想的反应基质。

表1 核桃粕主要成分及含量(%)Table 1 Major content of walnut meal (%)
2.2 双缩脲法测定多肽标准曲线
谷胱甘肽四肽标准曲线如图1所示,此标准曲线的回归方程为:y=0.0807x+0.0267,相关系数R²=0.9966。
2.3 发酵时间参数筛选
完整发酵周期内,枯草芽孢杆菌与黑曲霉发酵多肽含量变化如下图2所示,枯草芽孢杆菌、黑曲霉均能够降解核桃蛋白并产生核桃多肽,其中枯草芽孢杆菌是细菌的典型代表,黑曲霉为真菌典型代表,细菌生长代谢速率较真菌快。其中枯草芽孢杆菌多肽产量随着时间呈现先上升后下降的趋势,并在第3 d达到最大值,其多肽产量为196.51 mg/g(多肽质量/干基发酵核桃粕质量);黑曲霉多肽产量也随着时间呈现先上升后下降的趋势,且在第4 d达到最大值,其多肽产量为 136.48 mg/g (多肽质量/干基发酵核桃粕质量)。因此确定枯草芽孢杆菌最佳发酵时间为3 d;黑曲霉发酵最佳时间4 d,以此作为后续发酵的时间参数。
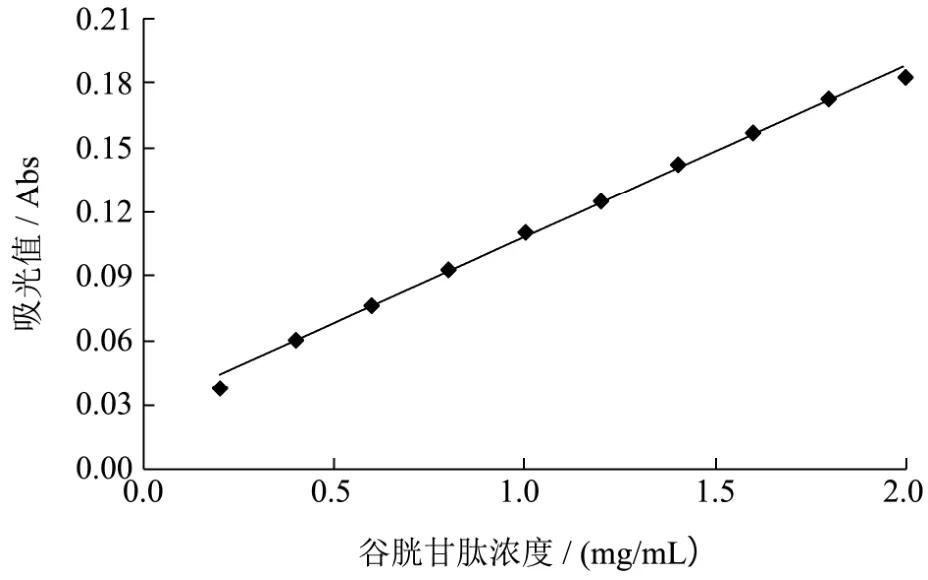
图1 Gly-Gly-Tyr-Arg四肽浓度标准曲线Fig.1 Standardcurve of Gly-Gly-Tyr-Arg concentration

图2 不同菌种发酵多肽曲线Fig.2 The peptides yield curve of Bacillus subtilis and Aspergillus niger
2.4 枯草芽孢杆菌发酵条件优化
枯草芽孢杆菌发酵核桃粕发酵时间 3 d,逐步对发酵过程中的原料粒径、发酵温度、接种量、料液比进行优化,逐步确定最佳发酵条件。
2.4.1 原料粒径对枯草芽孢杆菌发酵制备核桃多肽的影响
固态发酵条件为:发酵时间3 d,发酵温度37 ℃,料水比 1:1,原料粒径对枯草芽孢杆菌发酵制备核桃多肽的影响结果见下图3。40目物料多肽产量显著高于未粉碎物料(p<0.05)。从不粉碎、20、40和60目四个水平进行考察,随着原料粒径的减小,核桃多肽产量逐渐上升,并在 40目时达到最大值,当粒径为60目时,核桃多肽产量逐渐下降。核桃粕粒径对微生物利用核桃蛋白有较大的影响,较小的颗粒有较大的反应表面积,因此枯草芽孢杆菌能较好地利用核桃粕颗粒表面的核桃蛋白;但是当颗粒粒径过小,核桃粕空隙减少,氧气含量减少,微生物发酵效果减弱,从而导致核桃多肽产量的下降。不仅如此,60目较 40目能耗更高,综合多肽产量和能耗两方面原因,40目粉碎对枯草芽孢杆菌的固态发酵制备多肽更为有利,因此选择40目原料粒径进行后续实验。
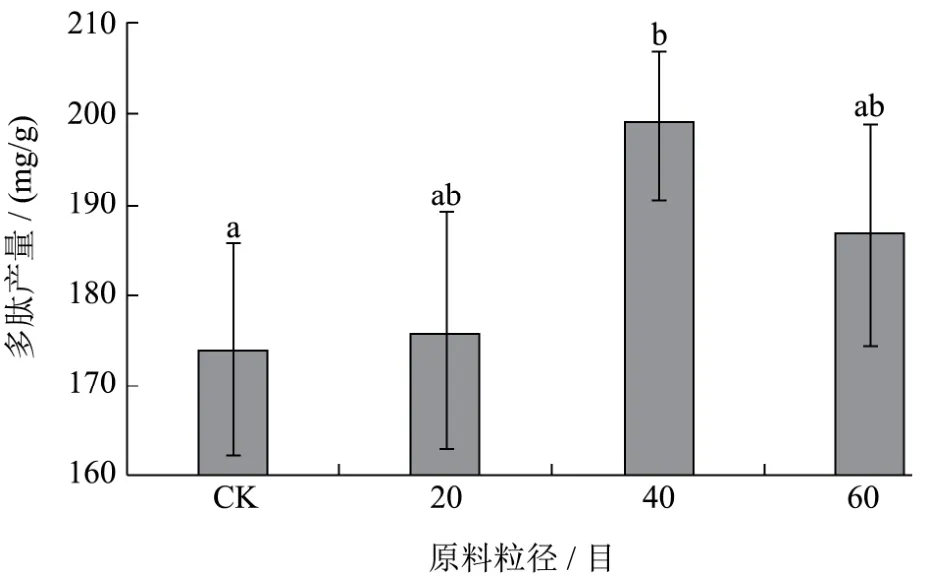
图3 原料粒径对枯草芽孢杆菌发酵制备核桃多肽的影响Fig.3 The effect of partical size on the yield of peptides
2.4.2 发酵温度对枯草芽孢杆菌发酵多肽的影响
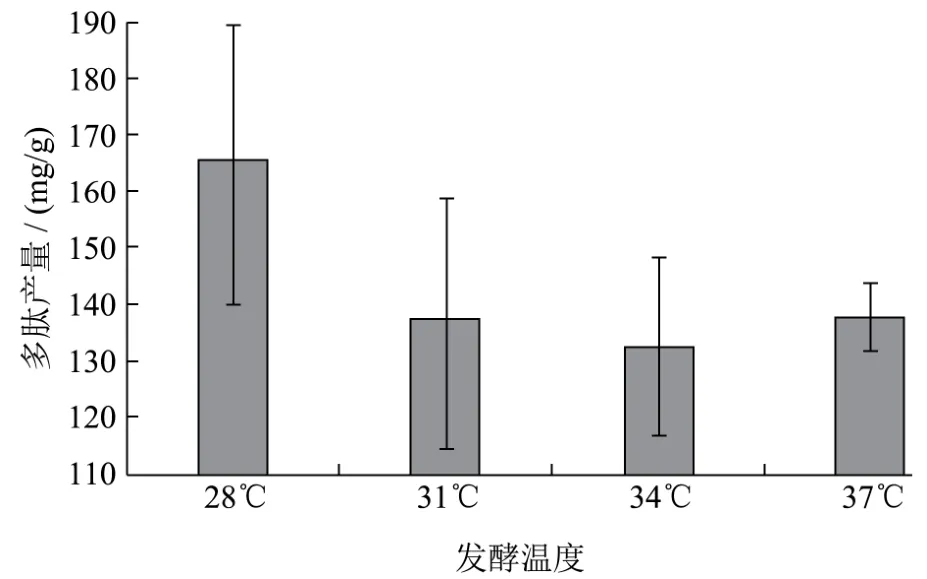
图4 温度对枯草芽孢杆菌发酵制备核桃多肽的影响Fig.4 The effect of fermentation temperature on the yield of walnut peptides
固态发酵条件为:发酵时间3 d,原料粒径40目,接种量为5%,料水比1:1。发酵温度对多肽含量的影响结果如下图4所示,各处理组多肽含量差异不显著(p>0.05),在28~37 ℃范围内,随着温度的升高,发酵后多肽产量受培养基中水分含量影响较大,温度越高,固体发酵培养基中水分丢失越快,越不利于枯草芽孢杆菌固态发酵。当发酵温度为28 ℃时,固态发酵制备的多肽产量最高,可达165.11 mg/g,为节约资源,选择28 ℃作为枯草芽孢杆菌发酵温度参数。
2.4.3 接种量对枯草芽孢杆菌发酵制备核桃多肽的影响
枯草芽孢杆菌种子液为107cfu/mL,不同接种量对枯草芽孢杆菌发酵制备核桃多肽的影响结果如下图5所示,接种量为5%时,固态发酵制备多肽的产量最高,可以达到154.36 mg/g,因此选取5%接种量进行后续实验。随着接种量的增加,发酵后的多肽产量略有下降,各组之间差异不显著(p>0.05),从节约资源角度,选择5%作为后续实验接种量。
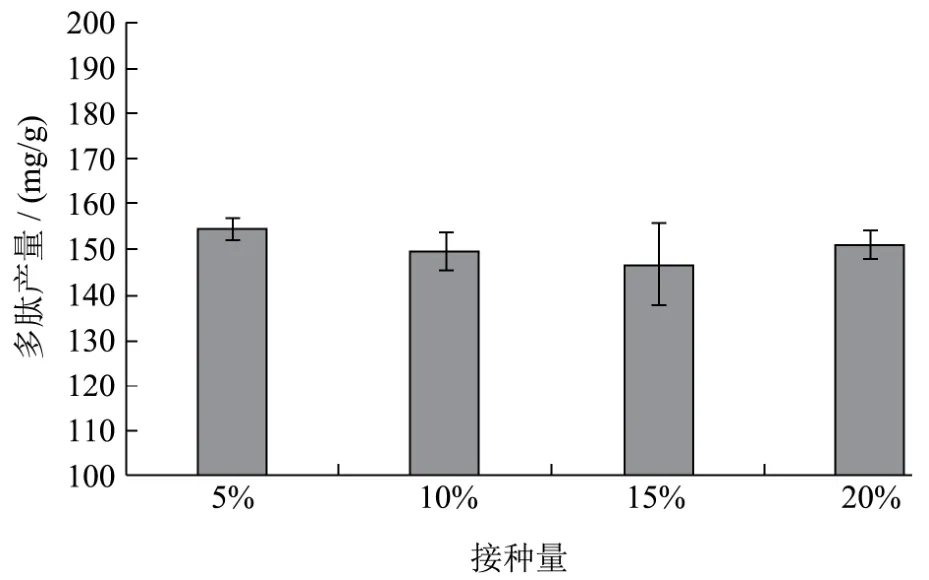
图5 接种量对枯草芽孢杆菌制备核桃多肽产量的影响Fig.5 The effect of inoculation quantity on the yield of walnut peptides
2.4.4 料液比对枯草芽孢杆菌发酵多肽的影响

图6 料液比对枯草芽孢杆菌发酵制备核桃多肽的影响Fig.6 The effect of liquid/material on the yield of walnut peptides
固态发酵条件为:发酵时间3 d,原料粒径40目,菌种接种量为5%,发酵温度28 ℃。不同料液比对多肽产量的影响结果如下图6所示,在1:0.5到1:1.25的范围内,随着料液比的增加,多肽产量逐渐增大,当料液比为 1:1.25(核桃粕与添加蒸馏水的比值)时多肽产量达到最大,在此条件下发酵后多肽产量显著提高(p<0.05),最大产量为 243.97 mg/g。由于水分的增加,微生物能更好地利用固态培养基中的水分和营养物质,从而具有更好的发酵产多肽效果。而水分较低时,不利于固态发酵基质中微生物的生长,可能降低菌体代谢速率,从而影响多肽产量。
2.5 黑曲霉固态发酵条件优化
黑曲霉发酵核桃粕发酵时间 4 d,逐步对发酵过程中的原料粒径、发酵温度、接种量、料液比进行优化,逐步确定最佳发酵条件。
2.5.1 原料粒径对黑曲霉固态发酵多肽产量的影响
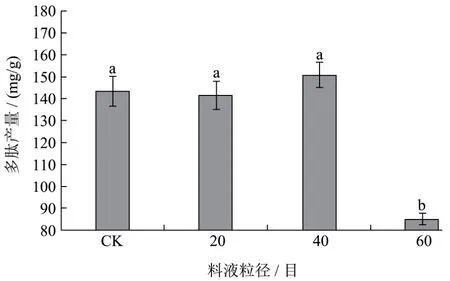
图7 原料粒径对黑曲霉发酵制备核桃多肽产量的影响Fig.7 The effect of partical size on the walnut yield of peptides
固态发酵条件:发酵温度37 ℃,发酵时间4 d,料液比 1:1。原料粒径对黑曲霉发酵多肽产量的影响结果如下图7所示。原粒径、20目、40目多肽产量差异不显著,但都比60目多肽产量显著高(p<0.05)。随着粒径的减小多肽产量小幅先上升后下降,并在40目达到最大,为 150.92 mg/g。与此同时不粉碎、20目发酵的多肽含量差不多,这是由于黑曲霉的穿透性好,能够进入颗粒内部充分地利用核桃粕。当原料粒径小于40目,固体培养基中的水分完全被培养基颗粒表面的微孔等吸收,同时原料粒径过小使得原料空隙减少,而造成氧气减少,使得黑曲霉生长减缓,菌体繁殖代谢受到影响,从而减少多肽产量。因此选择40目为后续实验粒径参数。
2.5.2 发酵温度黑曲霉发酵多肽产量的影响
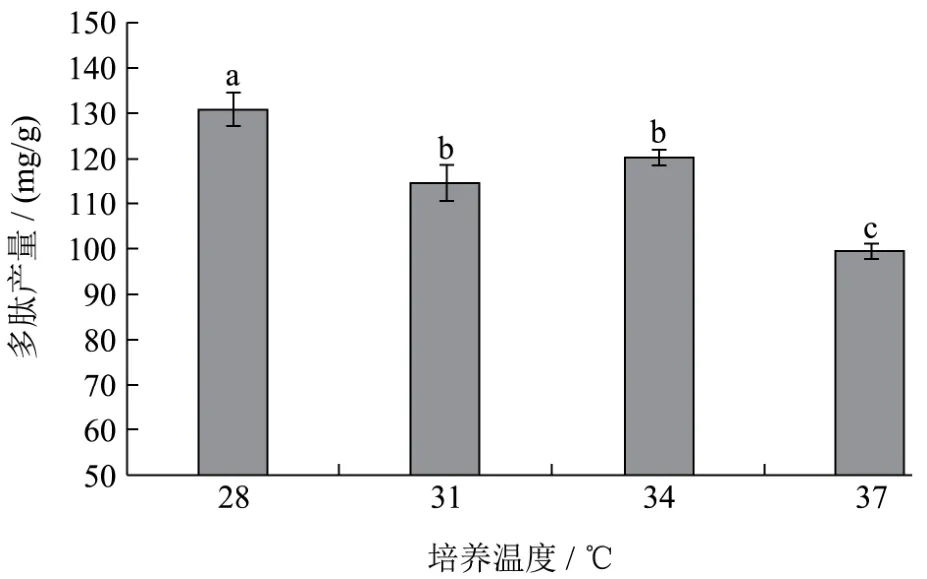
图8 温度对黑曲霉发酵制备核桃多肽的影响Fig.8 The effect of fermentation temperature on the walnut yield of peptides
固态发酵条件:发酵时间4 d,料液比1:1,原料粒径40目,接种量10%。发酵温度对黑曲霉发酵多肽产量的影响结果如下图8所示,该黑曲霉最适生长温度为28 ℃,随着温度的增加,会使黑曲霉代谢速率下降,从而造成发酵后多肽产量降低。在28 ℃时,黑曲霉发酵多肽产量显著高于其他组(p<0.05),最大为120.35 mg/g,因此选择28 ℃为后续发酵温度。
2.5.3 接种量对黑曲霉发酵多肽的影响

图9 接种量对黑曲霉发酵多肽的影响Fig.9 The effect of inoculation quantity on the yield of walnut peptides
固态发酵条件:发酵时间4 d,料液比1:1,原料粒径40目。接种量对黑曲霉发酵多肽产量的影响结果如下图9所示,随着接种量的增加,固态发酵多肽产量逐渐增加,并且当接种量达到15%时,多肽产量显著高于其他组(p<0.05),可达到 132.92 mg/g,随着接种量的继续增加,多肽产量不再增加。合适的接种量可以缩短微生物的延滞期,到发酵后期微生物利用多肽、氨基酸比例增加导致培养基中多肽含量减少,因此选用15%作为最适接种量。接种量小,接入菌体量减少,发酵时微生物生长缓慢,延滞期较长,蛋白分解速率降低导致多肽产量不高;而接种量过高,微生物综述在短时间内可以达到峰值,黑曲霉生长盘复交错,导致核桃粕结块,外部氧气无法进入核桃粕中,黑曲霉代谢下降,多肽产量下降。
2.5.4 料液比对黑曲霉发酵多肽的影响

图10 料液比对黑曲霉发酵制备核桃多肽的影响Fig.10 The effect of liquid/material on the yield of walnut peptides
固态发酵条件:发酵时间4 d,发酵温度28 ℃,原料粒径40目,接种量20%,考察料液比对黑曲霉发酵多肽产量的影响。实验结果如下图10所示,随着蒸馏水添加量的增加,多肽产量呈现上升趋势,并在料液比为1:1.25时显著高于其他组(p<0.05),为158.61 mg/g。培养基中水分含量过低,黑曲霉代谢速率低,不利于其产酶,随着水分的增加,微生物可利用的水增加,代谢更加活跃,因此多肽产量随之提高。
2.6 最佳发酵条件下的发酵产物分子量分布

图11 发酵前核桃粕中水溶性蛋白及多肽HPGPC图谱Fig.11 HPGPC chromatograph of walnut peptides before fermentation
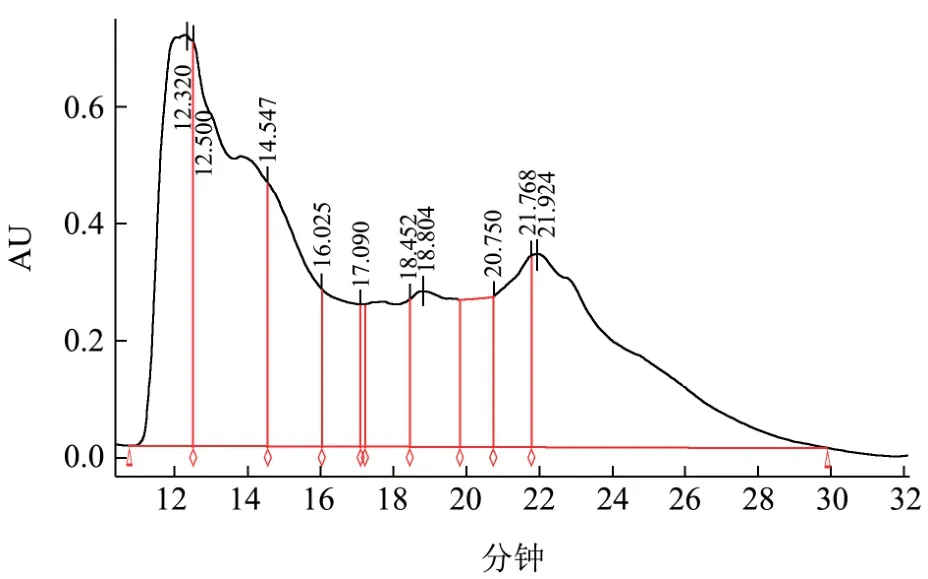
图12 枯草芽孢杆菌发酵后核桃粕中水溶性蛋白及多肽HPGPC图谱Fig.12 HPGPC chromatograph of walnut peptides after fermentation

图13 黑曲霉发酵后核桃粕中水溶性蛋白及多肽HPGPC图谱Fig.13 HPGPC chromatograph of walnut peptides after fermentation
枯草芽孢杆菌最佳发酵条件:发酵时间 3 d、原料粒径40目、发酵温度28 ℃、接种量5%、料液比1:1.25;黑曲霉最佳发酵条件:发酵时间4 d、原料粒径40目、发酵温度28 ℃、接种量15%、料液比1:1.25。核桃粕发酵前后HPGPC图谱如下图11~13所示,结合表 2~4可以看出,发酵前(经灭菌后),核桃粕中大分子蛋白不可溶,仅极少量小分子(分子量小于150 u)物质(包括游离氨基酸)是水溶性的,几乎无大分子溶出。
黑曲霉最佳条件发酵过后,其分子量分布与原料发酵前相似,大部分物质都为1000 u以下,且预处理处理条件相同,其 AU值较低因此可以断定黑曲霉GIM3.452固态发酵核桃粕制备多肽效果不佳。枯草芽孢杆菌10160发酵后其分子量分布如下表3所示,其组分中分子量≥150 u的分子多达78.47%,不仅如此其纵坐标AU值也较高,大部分均为可溶,在枯草芽孢杆菌生长的过程中,其分泌的胞外蛋白酶使得大分子蛋白降解成为小片段,同时亲水性增加,这样更有利于枯草芽孢杆菌利用微环境中的水分将多肽和氨基酸吸收以供菌体代谢之用,因此枯草芽孢杆菌更适合于核桃多肽的发酵。

表2 发酵前核桃粕中水溶性蛋白及多肽分子量分布Table 2 Distribution of molecular weight of walnut peptides before fermentation

表3 枯草芽孢杆菌发酵后核桃粕中水溶性蛋白及多肽分子量分布Table 3 Distribution of molecular weight of walnut peptides before fermentation

表4 黑曲霉发酵后核桃粕中水溶性蛋白及多肽分子量分布Table 4 Distribution of molecular weight of walnut peptides before fermentation
3 结论
本实验以单因素实验为基础进行逐级优化,以多肽产量为指标,对枯草芽孢杆菌和黑曲霉进行了发酵时间、原料粒径、发酵温度、菌种接种量、料液比等五项固态发酵条件参数进行了优化,枯草芽孢杆菌固态发酵最佳发酵参数:发酵时间3 d,原料粒径40目,发酵温度28 ℃,菌种接种量5%,料液比1:1.25,在此条件下经发酵后核桃多肽含量为243.97 mg/g。黑曲霉固态发酵最佳发酵参数:发酵时间 4 d,原料粒径40目,发酵温度 28 ℃,菌种接种量 15%,料液比1:1.25,在此条件下经发酵核桃多肽含量为 158.61 mg/g。以最优条件进行两菌的固态发酵实验,经分子量分布测定,枯草芽孢杆菌发酵产物中可溶性蛋白、多肽及氨基酸含量显著高于黑曲霉,发酵后大于150 u组分大幅提高表明枯草芽孢杆菌更适合于固态发酵核桃粕进行生物多肽的制备。
