亚硒酸钠对黄曲霉毒素B1致雏鸡胸腺细胞死亡受体通路活化的缓解作用研究
2018-09-08吴邦元
梁 娜,彭 西,吴邦元,方 静*
(1.四川农业大学动物医学院,成都 611130;2.西华师范大学生命科学学院/西南野生动植物资源保护教育部重点实验室,四川南充 637000)
在已知黄曲霉毒素中,黄曲霉毒素B1(AFB1)的毒性和致癌性最强[1]。AFB1抑制动物生长[2],有极强的肝肾毒性和免疫毒性[3]。AFB1可降低家禽免疫器官脏器指数[4]、血清抗体滴度[5]、TNF-α 和 IFN-γ 等细胞因子水平[6],降低外周血和肠黏膜内皮成熟T淋巴细胞比例[7]并诱导免疫细胞凋亡[8]。作为谷胱甘肽过氧化物酶等生物酶的组成成分,硒参与调控机体的氧化还原状态[9]。适量硒可减少UVA辐射对细胞DNA的损伤[10]、缓解镉和汞引起的氧化损伤[11-12]、缓解T-2毒素对软骨和脾脏细胞的DNA损伤和凋亡[13-14]。日粮加硒可缓解AFB1所致的雏鸡免疫器官的形态学损伤和过度凋亡[15]、鸭的肝脏功能紊乱以及肝细胞过度凋亡现象[16]。
前期研究表明,AFB1主要通过死亡受体通路和线粒体通路诱导雏鸡胸腺细胞凋亡[8],日粮加硒缓解AFB1诱导的雏鸡胸腺细胞凋亡[17],但其缓解机理尚不清楚。本试验旨在探究亚硒酸钠对AFB1所致胸腺细胞死亡受体通路活化的缓解机制。
1 材料和方法
1.1 实验动物与日粮组成
将180只1日龄科宝肉鸡健雏(购于成都市温江区正大有限公司)随机分为4组:对照组(0 mg/kg AFB1)、+Se 组(0.4mg/kg Se)、AFB1组(0.6mg/kg AFB1)和AFB1+Se组(0.6 mg/kg AFB1+0.4 mg/kg Se)。雏鸡自由采食和饮水,试验期21 d。根据中国雏鸡饲养标准推荐配方(NY/T33-2004)配制玉米-豆粕型基础日粮。AFB1组日粮配制方法参见文献[8]。分别在对照日粮和AFB1日粮中逐级混入0.4 mg/kg硒(以Na2SeO3为硒源),制得+Se和AFB1+Se日粮。经高效液相色谱仪(HPLC,Milford,MA,USA)检测,AFB1和对照日粮中AFB1的含量分别为0.601 mg/kg和<0.001 mg/kg。于7、14和21 d时,每组随机抽取5只雏鸡剖杀,进行下列指标的检测。
1.2 雏鸡胸腺脏器指数
观察胸腺的外观变化,去除胸腺周围结缔组织,称净重并计算脏器指数:
脏器指数=脏器净重(g)/空腹体重(kg)
1.3 组织病理学观察
称重后,立即将胸腺置于4%多聚甲醛磷酸缓冲溶液中固定24 h以上,脱水包埋,石蜡切片。苏木素伊红(H.E.)染色后于Olympus显微镜下观察并记录组织病理变化。
1.4 胸腺T淋巴细胞亚群检测
取胸腺置于 4℃磷酸盐缓冲液(PBS,pH=7.2~7.6)中。经机械剪碎法制成匀浆状,过滤和离心后PBS洗两次,重悬为1×106个/mL的单细胞悬液。取100 μL细胞悬液,分别加入Southern Biotech公司生产的单抗CD3-SPRD(8200-13)、CD4-FITC(8210-02)和 CD8-RPE(8220-09)各一头份。4℃避光染色 15 min。PBS液洗涤后重悬细胞,用流式细胞仪(FACSCalibur,BD,美国)检测。分析 CD3+、CD3+CD4+和 CD3+CD8+T淋巴细胞百分率并计算CD4+/CD8+的比值。
1.5 胸腺细胞凋亡检测
1.5.1 Annexin V-FITC/PI双染色法检测胸腺细胞凋亡率
取上述单细胞悬液100 μL,加入凋亡试剂盒(51-66211E,BD Pharmingen,美国)中的 Annexin-V FITC和PI染液各5 μL,振荡混匀,25℃避光染色15 min;加入 400 μL 1×结合缓冲液,混匀后流式细胞仪检测并分析凋亡细胞百分率。
1.5.2 荧光定量PCR检测凋亡相关基因的变化
将胸腺冻存于液氮备用。用研钵将胸腺磨成粉末状,装入无RNA酶EP管中,-80℃保存备用。用TriPure(11667165001,罗氏,德国)提取总 RNA。检测总RNA浓度及A260/280值(控制在1.8~2.0之间)。用反转录试剂盒(04897030001,罗氏,德国)处理获得cDNA,-80℃保存备用。用SYBR Green荧光染料(2043,DBI,德国)进行荧光标记后,用 Bio-Rad荧光定量 PCR 仪(Bio-Rad,CFX96 touch,美国)进行检测。
PCR 反应采用 20 μL体系:10 μL荧光染料、0.5 μL 正向引物、0.5 μL 反向引物、1 μL cDNA 模版、8 μL DEPC-H2O。反应条件:95℃预变性 2 min,95℃变性10 s,50℃~60℃退火30 s,72℃延伸30 s,进行40个循环;经95℃ 1 min,55℃ 1 min,55℃~98℃(86个循环)获取融解曲线。基因编号由NCBI GenBank获得,引物经NCBI Blast比对设计并由上海生工生物工程有限公司合成(见表1)。
1.6 数据分析
采用SPSS 20.0统计软件进行数据统计,结果以平均数(M)±标准差(SD)表示。并用单因素方差分析法分析组间差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 脏器指数
AFB1组胸腺脏器指数14 d时极显著低于对照组和+Se组(P<0.01);21 d时显著或极显著低于对照组和+Se组(P<0.05或 P<0.01)。AFB1+Se组与其余各组间差异不显著(P>0.05)。见图1。

表1 荧光定量PCR引物序列Table1 Primer sequences,corresponding accession numbers and sizes of the amplification products
2.2 组织形态学
14和21 d时,对照组网状细胞形态清晰,胞核大、染色质淡染,其周围的空隙中未见或仅见有少量细胞核碎片;与对照组比较,AFB1组雏鸡胸腺皮质区内网状细胞形态较模糊,其周围的细胞核碎片明显增多;与对照组比较,+Se组和AFB1+Se组未见明显的病理形态学损伤(见图2)。
2.3 T淋巴细胞亚群
由图3可见,与对照组比较,14和21 d时,+Se组胸腺CD3+CD4+和CD3+CD8+细胞百分比显著或极显著降低(P<0.05或 P<0.01);AFB1组、AFB1+Se组胸腺 CD3+、CD3+CD4+和 CD3+CD8+细胞百分比显著或极显著降低(P<0.05或 P<0.01)。
与AFB1组相比,14 d时,AFB1+Se组胸腺CD3+CD4+和 CD3+CD8+细胞百分比显著升高(P<0.05),CD4+/CD8+比值亦显著升高(P<0.05)。
2.4 凋亡率
与对照组比较,AFB1组胸腺细胞凋亡率极显著升高(P<0.01);+Se组凋亡率在21 d时极显著降低(P<0.01);AFB1+Se组无显著变化(P<0.05)。AFB1+Se组的胸腺细胞凋亡率与AFB1组比较显著或极显著降低(P<0.01或P<0.05)。图4的流式象限图直观地显示,AFB1组的胸腺细胞凋亡率较对照组高,AFB1+Se组较AFB1组低。
2.5 凋亡相关基因的mRNA相对定量变化
与对照组比较,AFB1组雏鸡胸腺的Caspase-8、Caspase-3、Caspase-9、Fas、TNF-α、FasL、JNK、ASK1和IKIP的mRNA表达量显著或极显著升高(P<0.01或 P<0.05);Bid、Bcl-2 和 NF-kB1 的表达量显著或极显著降低(P<0.01或P<0.05);RIP的表达量在7和 14 d时显著升高(P<0.05)。

图1 雏鸡胸腺脏器指数变化Figure1 The relative weights of thymus in chickens
与对照组相比,+Se组雏鸡胸腺的Fas、TNF-α、Caspase-8、JNK和ASK1的mRNA表达量升高(P<0.01或P<0.05),同时NF-kB1的mRNA表达量降低(P<0.01 或 P<0.05),而 Bcl-2、caspase-3 和 caspase-9的mRNA表达量无明显变化(P>0.05)。与 AFB1组相比,AFB1+Se 组雏鸡胸腺的 TNF-α、caspase-8、caspase-3、caspase-9和JNK1的mRNA表达量降低(P<0.01或 P<0.05),Bcl-2和 Bid的 mRNA 表达量升高(P<0.01 或 P<0.05),而 Fas、NF-kB1和 IKK 的mRNA表达量无明显变化(P<0.05)。详见图5。
3 讨论
3.1 AFB1及添加亚硒酸钠后胸腺组织学变化
已有研究表明,AFB1可引起雏鸡[4]和鸭[18-19]胸腺脏器指数降低。本试验中,AFB1组的胸腺脏器指数降低,与前人的研究结果相似。AFB1组雏鸡胸腺中见多量核碎片,而+Se组和AFB1+Se组均无明显病变,表明日粮中适量加硒可改善AFB1导致的雏鸡胸腺脏器指数降低和组织形态学损伤。硒元素是含硒蛋白的重要成分,具有抗氧化、抗癌以及免疫调节作用[20]。基础日粮中添加0.4 mg/kg硒可改善AFB1所致的免疫缓解[17],其机理可能与其减轻了雏鸡胸腺的组织学损伤有关。

图2 雏鸡胸腺形态学结构Figure2 Pathological changes of thymus
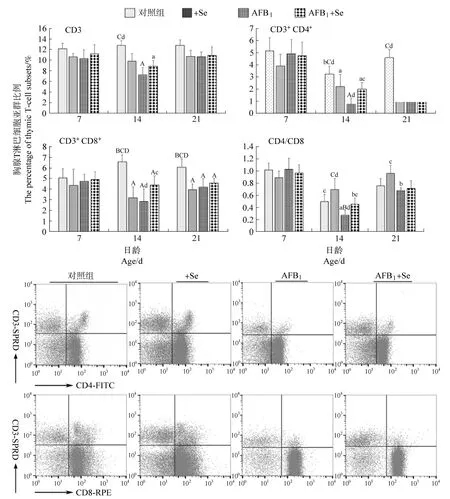
图3 雏鸡胸腺T淋巴细胞亚群变化Figure3 Changes of the percentage of thymic T-cell subsets in chickens

图4 雏鸡胸腺细胞凋亡率变化Figure4 Changes of the percentage of apoptotic thymocytes in chickens
3.2 AFB1及添加亚硒酸钠后胸腺T淋巴细胞亚群的变化
胸腺是成熟T淋巴细胞分化的主要场所,而分化中的胸腺细胞对有害刺激较敏感[21]。AFB1可降低雏鸡胸腺CD3+、CD3+CD4+和CD3+CD8+T淋巴细胞比例[17];与前人研究结果相似,本试验中0.6 mg/kg AFB1导致了胸腺T淋巴细胞亚群百分率降低,可能与胸腺细胞增殖受阻或淋巴细胞过度凋亡相关。与对照组比较,+Se组雏鸡胸腺CD3+CD4+和CD3+CD8+T淋巴细胞比例显著降低,但CD4+/CD8+比值呈升高趋势。有学者认为,CD3+CD4+比例的减少并不是由于CD4+T细胞的损耗,而是机体为了维持自稳态的一种代偿性生理学机制[22]。CD3+CD4+细胞以辅助性T细胞为主[23],CD4+/CD8+比值的升高表明CD3+CD4+T细胞相对增多,提示机体免疫反应的正向调节能力相对增强。结合组织学未见明显损伤的形态学观察结果,此变化可能反映了机体的代偿性调节[22]。
日粮中添加适量硒可缓解AFB1对雏鸡免疫系统[18]、肝脏[24]和肾脏[25]的损伤作用。日粮加硒可改善AFB1所致的雏鸡胸腺CD3+、CD3+CD4+和CD3+CD8+T淋巴细胞的比例下降[17]。本试验与已有研究结果一致,AFB1+Se组胸腺CD3+CD4+和CD3+CD8+T淋巴细胞的比例及CD4+/CD8+比值比AFB1升高。表明0.4 mg/kg亚硒酸钠可缓解AFB1诱导的胸腺细胞成熟分化受阻现象。
3.3 AFB1及添加亚硒酸钠后胸腺细胞凋亡率的变化
AFB1可诱导大鼠[26]、雏鸡[27]和猪[28]的胸腺细胞凋亡增加;而适量硒添加可降低AFB1导致的雏鸡胸腺、法氏囊[29]和肾脏[25]等器官的细胞过度凋亡现象。本试验中,与对照组相比,AFB1组胸腺细胞凋亡率升高,AFB1+Se组凋亡率变化不明显,表明0.6 mg/kg AFB1使胸腺细胞凋亡增加,而0.4 mg/kg硒可降低AFB1诱导的胸腺细胞过度凋亡。我们的前期研究表明,AFB1可能通过活化线粒体通路和死亡受体通路来介导雏鸡胸腺细胞过度凋亡[8],本试验对死亡受体通路中相关因子的检测显示,AFB1可增加 RIP、caspase-8、caspase-9、caspase-3、Fas、FasL、ASK1、IKIP和JNK的mRNA相对表达量,下调Bcl-2、NF-kB1和Bid的mRNA相对表达量。表明此凋亡增加过程中有死亡受体通道上的3条下游途径参与:①通过Fas-FasL-FADD-caspase8-caspase3途径直接诱导凋亡;②通过Fas-ASK1-JNK-Bcl-2途径,并在线粒体的介导下,启动下游调控因子caspase-9和caspase-3诱导细胞凋亡。③通过TNF-α-RIP1-IKIP-NF-kB1-caspase-3信号途径诱导凋亡。
本试验中,+Se组的胸腺细胞凋亡率与对照组相比无明显变化;qRT-PCR检测结果显示,Fas、TNF、Caspase-8、JNK 和 ASK1的 mRNA 表达量升高,NF-kB1的mRNA表达量降低,表明+Se组胸腺细胞的死亡受体通路被活化。关于适量硒诱导细胞凋亡现象多见于肿瘤[30]。本试验+Se组胸腺的死亡受体通路有活化但凋亡率变化不明显,其机理有待研究。
硒能够减轻有毒物质和药物引起的氧化应激反应[31],缓解T-2毒素和脂多糖诱导的细胞凋亡[13,32]。在硒缓解镉引起的细胞凋亡率增加时,其机理可能与ASK1的活性降低,继而降低JNK的磷酸化作用,减轻Bcl-2的磷酸化而阻断了线粒体通道的活化[33]。本试验结果显示,与AFB1组相比,AFB1+Se组胸腺细胞凋亡率显著降低,TNF-α、caspase-8、caspase-3、caspase-9和 JNK1的mRNA表达量降低,Bcl-2和tBid的mRNA表达量升高。该结果表明,在上述AFB1导致活化的3条死亡受体通路下游途径中,日粮中适量加硒可能阻断途径①和②:即通过降低caspase-8的表达降低caspase-3的活化程度,达到缓解雏鸡胸腺细胞凋亡的作用;通过缓解JNK信号通路以减轻对Bcl-2的磷酸化作用;通过缓解JNK信号通路以减轻对Bcl-2的磷酸化作用[34],从而降低caspase-8对tBid的磷酸化来减轻线粒体损伤[35],最终降低caspase-9和caspase-3的活性表达来降低雏鸡胸腺细胞的凋亡率。另有研究显示,在适量硒添加可以降低巨噬细胞IKK的活性,从而缓解脂多糖诱导的细胞凋亡作用[36],IKK具有缓解NF-kB1的作用。但是AFB1+Se组雏鸡胸腺细胞NF-kB1的表达量与AFB1组相比并未呈现升高,表明未通过阻断NF-kB1途径的活化来缓解胸腺细胞凋亡。
