滨海沙地5种人工林细根与表层土壤化学计量特征
2018-09-08胡欢甜邱岭军葛露露孟庆权何宗明王柯远
胡欢甜 ,邱岭军 ,葛露露 ,孟庆权 ,林 宇 ,何宗明 ,王柯远 ,董 强 *
(1.福建农林大学林学院,福州 350002;2.国家林业和草原局杉木工程技术研究中心,福州 350002;3.福建省长乐大鹤国有防护林场,福建长乐 350212)
碳(C)、氮(N)和磷(P)是生物组成的基本元素,是植物生长发育、物质循环和能量交换的有效途径,C、N、P含量及其比值关系能较好地指示生态系统的养分限制情况及养分循环效率[1-2]。生态化学计量学(eological stoichiometry)是研究土壤-植物相互作用与C、N、P化学元素循环以及生态系统的学科[3]。生物体的 C∶N∶P与生长率紧密相关[4],也是生态系统限制养分的判断依据之一[5]。细根是直径<2 mm的根系,吸收表面积巨大,是植物吸收水分和转运营养元素的主要器官,在森林生态系统养分循环和碳循环中起重要作用[6-7]。已有研究表明,全球细根N库占整个陆地生态系统的1/7[8-9]。土壤是陆生植物赖以生存的基质,细根从土壤中吸收养分,又通过分解、淋溶将养分释放,完成根系-土壤所构成的微型生态环境中营养物质的迁移和循环。
生态化学计量学概念自J.J.Elser等[10]明确提出以来,在国内外研究进展迅速。目前对化学计量学研究已经广泛渗透到草原[11-12]、雨林[13]和荒漠[14-15]等陆地生态系统,而对滨海沙地地区生态化学计量学研究较少。同时植物生态化学计量学的研究主要集中于叶片、叶片-凋落物C、N、P化学计量比等地上部分,对植物地下部分根系研究尚少。滨海沙地沙质高达18.5%,土壤环境恶劣,养分贫瘠且多聚集于表层(0~10 cm),而细根主要分布在表层土壤中,因此对滨海沙地主要人工林树种细根与表层土壤C∶N∶P化学计量比进行研究,能较为有效地表明滨海沙地人工林生态系统养分利用效率,探究植物如何调整根系化学计量特征以适应滨海沙地特殊的环境。
本研究取2003年春在湿地松采伐迹地上营造的肯氏相思(Acacia cunninghamii Steud.)、厚荚相思(Acacia crassicarpa Benth.),卷荚相思(Acacia cincinnata F.Muell.),尾巨桉(Eucalyptus urophylla×E.grandis.)和木麻黄(Casuarina equisetifolia)5 种不同树种的人工纯林的细根和表层土壤,测定其细根及表层土壤C、N和P含量,分析其生态化学计量特征,旨在揭示滨海沙地人工林养分限制因子,为滨海沙地造林营林提供科学依据。
1 材料和方法
1.1 研究区概况
试验地位于福建长乐大鹤国有防护林场(E119°40′13″,N25°57′59″),东临东海,典型的南亚热带海洋性季风气候,温和多雨。全年最高气温37℃,最低气温0℃,年均温度19.2℃,无霜期326 d;全年雨量充足,平均相对湿度77%,年降水量1 382~1 794 mm,主要集中在4—6月。每年6—9月为台风多发期,年平均4~6次;年均风速为4.2 m/s,总风向东北风。本研究所选试验林处于低山丘陵区,地势平坦,平均海拔10 m。林下土壤为滨海风沙积土,土层疏松、深厚但保水保肥力差。林下常见天然植被有茅莓(Rubus parvifolius Linn.)、马樱丹(Lantanacamara)、硕苞蔷薇(Rosabracteata)、天门冬(Asparagus cochinchinensis(Lour.)Merr.)等。各树种林分基本情况见表1(表中数据为平均值±标准误)。
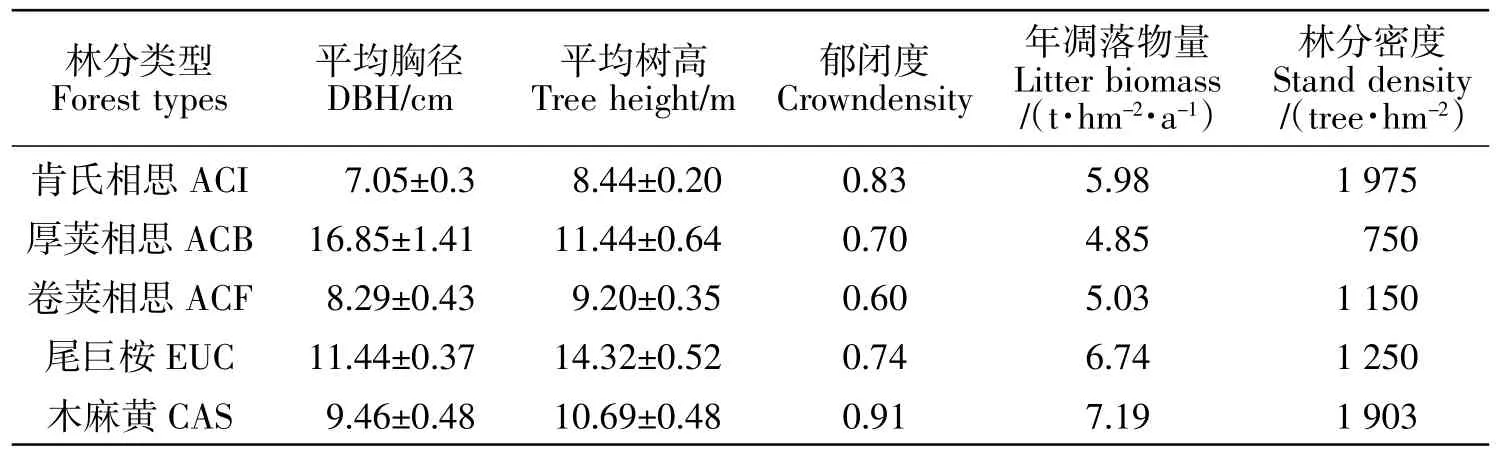
表1 试验林林分基本情况Table1 Basic starts of the institutional forest
1.2 样品采集与分析
在 11 a生的肯氏相思(3.1×104 m2)、厚荚相思(2.3×104 m2)、卷荚相思(1.8×104 m2)、木麻黄(4.1×104 m2)和尾巨桉(4.2×104 m2)5 个立地条件相似的典型植物群落分布区内,设置3个20 m×20 m的标准样地,在每个样地内随机选取1株标准木。
细根取样:利用挖掘法采集根部的样品(直径<2 mm),在离标准木地径下0.5 m处按不同东、南、西、北4个方向挖掘0~10 cm土层中的细根,去除土壤、凋落物等杂物,混合均匀后装于自封袋内带回室内。于室内用蒸馏水冲淋洗净表面的泥土。将植物细根样品置于烘箱内,70℃烘至恒重,研磨后过0.149 mm筛装袋保存,用于养分测定。
土壤取样:同一时间在标准木树干周围1 m处,去除地表凋落物,用直径为5 cm土钻沿对角线等距离分9个点采集0~10 cm土壤层样品,去除石子、细根等杂物,将土样混合均匀后装于自封袋内带回室内。于室内自然风干后,用自动球磨仪磨碎过100目筛装袋保存,用于养分测定。
养分测定:对细根和土壤中C元素、N元素和P元素进行测定。细根和土壤C、N含量采用碳氮元素分析仪(Elementar ELVario Max,德国)测定[16]。细根P采用硫酸-高氯酸消煮,钼锑抗比色法测定;土壤P采用氢氧化钠碱熔,钼锑抗比色法测定[17]。
1.3 数据处理
采用Microsoft Excel 2003和SPSS 17.0软件进行数据处理,使用单因素方差分析(One-way ANOVA)和多重比较LSD法对不同树种间细根、表层土壤C、N、P 含量及 C∶N、C∶P、N∶P 化学计量比进行分析。表中数据为平均值±标准误。
2 结果与分析
2.1 细根C、N、P化学计量特征
由表2可知,滨海沙地5种不同树种中,细根C含量在449.89~461.56 mg/g之间,平均值为454.15 mg/g;N含量为 10.64~16.69 mg/g,平均值为 14.36 mg/g,其中卷荚相思N含量最高,其次是厚荚相思、肯氏相思、木麻黄,尾巨桉细根N含量最低,为10.64 mg/g;P 含量 0.29~0.58 mg/g,平均值为 0.44 mg/g,其中卷荚相思P含量最高,其次是尾巨桉、厚荚相思、厚荚相思、木麻黄,肯氏相思细根P含量最低。方差分析表明,不同树种间细根C含量无显著差异;N、P含量达到极显著水平(P<0.01)。
C∶N 变化范围在 27.29~36.97之间,C∶P 变化范围在 775.43~1592.34之间,N∶P值的变化范围在20.22~53.96 之间;各树种间细根的 C∶N、C∶P 和 N∶P化学计量值均极显著差异(P<0.01)。
2.2 表层土壤C、N、P化学计量特征
由表2还可以看出,5种人工林表层土壤中,C含量在3.15~4.86 mg/g之间,平均值为3.70 mg/g;N含量为0.30~0.45 mg/g,平均值为0.36 mg/g,显著低于细根 N 含量(10.64~16.69 mg/g);土壤 P 含量 0.12~0.17 mg/g,平均值为0.15 mg/g,低于细根P含量(10.64~16.69 mg/g)。其中桉树C、N 含量最高,木麻黄则C、N含量最低,肯式相思P含量最高。方差分析表明,不同人工林间表层土壤C、N、P含量存在极显著差异(P<0.01)。
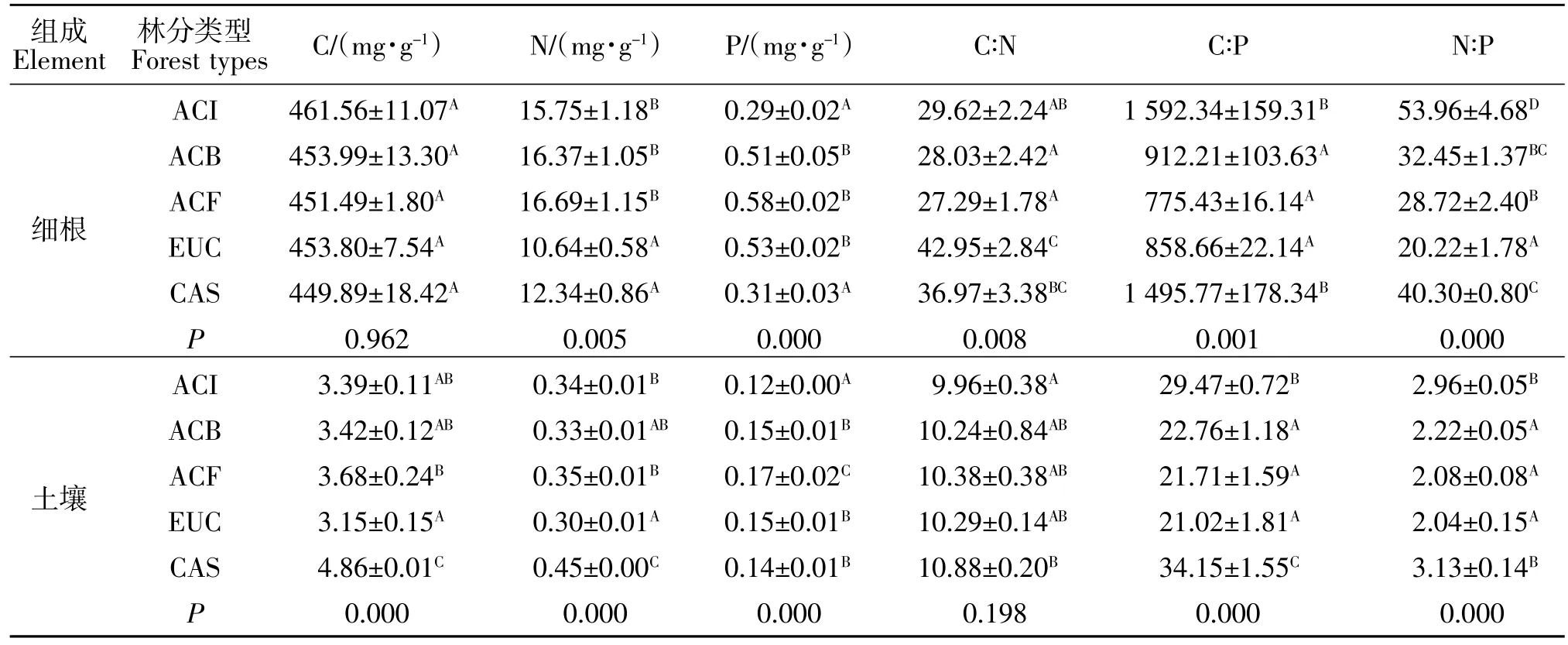
表2 不同树种细根和表层土壤C、N、P含量与C:N:P化学计量特征Table2 C,N,P contents and C:N:P stoichiometry in fine root and surface soil of different tree species
C∶N 变化范围在 9.96~10.88 之间,C∶P 变化范围在21.02~34.15之间,N∶P值的变化范围在2.04~3.13之间;各表层土壤的C∶N化学计量值无显著差异;C∶P 和 N∶P 化学计量值均极显著差异(P<0.01)。
2.3 表层细根和土壤化学计量特征的关系
对细根C、N、P含量与土壤C、N、P含量进行相关性分析,结果显示,细根P含量与土壤N含量显著负相关(P<0.05),与土壤p含量呈极显著正相关关系(P<0.01)(表 3)。对细根与土壤 C、N、P化学计量比进行相关性分析,结果显示,细根C∶P与N∶P存在极显著正相关关系(P<0.01),与土壤 C∶P 和 N∶P均呈极显著正相关(P<0.01),细根N:P分别与土壤C∶P、N∶P 存在显著正相关关系(P<0.01)和极显著正相关关系(P<0.05),土壤 C∶P 与 N∶P 存在极显著正相关关系(P<0.01)(表 4)。
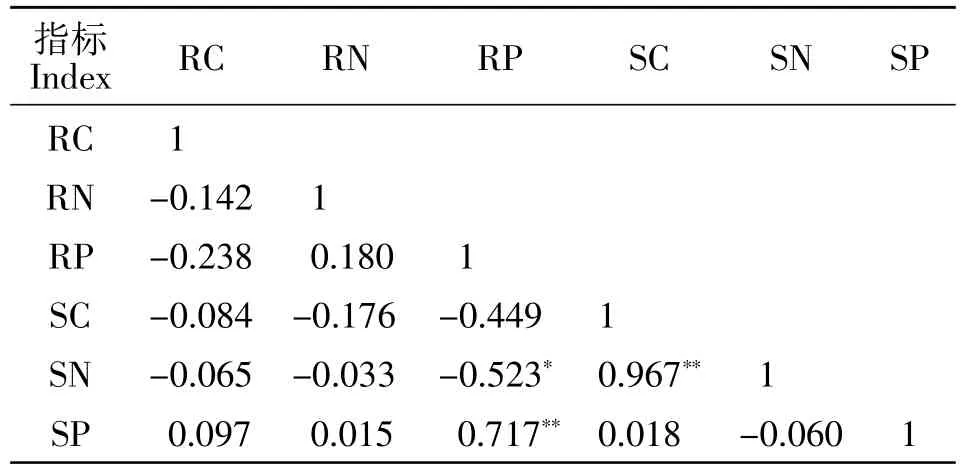
表3 不同树种细根和表层土壤C、N、P相关性分析Table3 Correlation analysis of C,N and P in fine root and surface soil of different tree species
由图1可知,细根N含量与C∶P间呈极显著负相关关系(R2=0.933,P<0.01),N与N∶P间无显著相关关系(R2=0.137,P>0.05);P 含量与 C∶P、N∶P 均呈极显著负相关关系(R2=0.932、R2=0.683,P<0.01)。土壤 N含量与 C∶P 间无显著相关关系(R2=0.287,P>0.05),N与N∶P 呈极显著正相关关系(R2=0.519,P<0.01);P 含量与 C∶P 呈显著负相关关系(R2=0.392,P<0.05),与N∶P 呈极显著负相关关系(R2=0.532,P<0.01)。
3 讨论
3.1 细根与表层土壤C、N、P含量特征
对滨海沙地5种不同树种研究结果显示,滨海沙地5个树种细根C含量平均值为454.15 mg/g,低于全球植物根系C含量(535.58 mg/g),但是显著高于川西亚高山红桦(313.02 mg/g)、岷江冷杉(366.16 mg/g)和粗枝云杉(385.33 mg/g)3 种优势树种[18],略高于塔里木盆地荒漠植物(443.62 mg/g)[19],显著低于辽东山区落叶松人工林(731.82mg/g)[20]。C元素在植物体内主要起骨架作用,不直接参与生产活动,通常含量高且具有稳定性[21],但不同地区细根C含量差异比较大,这可能是由于不同的气候带、土壤条件和物种性状导致的。N、P平均含量分别为14.36和0.39 mg/g,N含量高于全球植物根系N含量(11.1 mg/g),而P含量却低于全球植物根系P含量(0.77 mg/g)。根系营养元素主要来源是土壤,对5种人工林表层土壤研究表明,C含量平均值为3.70 mg/g,N含量平均值为0.36 mg/g,P含量为0.15 mg/g,3种元素含量均低于全国平均水平[22]。相关性分析表明细根与土壤P含量呈极显著正相关关系,这同马鑫雨等[23]对阅海湿地植物研究结果一致,表明植物养分元素依赖于土壤养分。滨海沙地土壤P元素含量较低,植物为适应贫瘠土壤环境需要降低自身的元素含量,得以维持元素高效利用率和优势地位[24-25]。而本研究团队对滨海沙地植物叶片研究结果表明叶片P含量低于中国753种陆地植物平均值[26-27],这进一步证明滨海沙地土壤P元素缺乏。

表4 不同树种细根和表层土壤C、N、P化学计量比相关性分析Table4 Correlation analysis of C,N and P stoichiometry in surface soil and fine root of different tree species
3.2 细根与表层土壤C、N、P化学计量特征
植物对N、P元素的利用效率可以通过C∶N、C∶P反映,而其受N、P元素的限制情况则通过N∶P值反映。P有效性越高则C∶P越低,受N限制时通常N∶P越小,反之则受P限制[28]。本研究中,滨海沙地人工林为固氮树种,较低的N含量也能满足植物自身生长。研究结果显示,根系C∶P值肯氏相思>木麻黄>厚荚相思>尾巨桉>卷荚相思,平均值为1126.88,略低于全球平均水平;N∶P值卷荚相思>木麻黄>厚荚相思>肯式相思>尾巨桉,平均值为35.14,远远大于全球平均水平(24)[29],表明滨海沙地植物P元素利用率较高,5个树种生长均不同程度受P元素限制。

图1 细根和土壤N、P与C:N、C:P、N:P的关系Figure1 Relationship between N and P in fine roots and soil and C:N,C:P,N:P
土壤碳氮磷化学计量比是土壤养分状况的重要指标。滨海沙地土壤C∶N变化范围在9.96~10.88之间,平均值10.35,与我国森林土壤C∶N平均水平[3](10.1~12.1)一致。C∶P是判定P有效性的指标之一,该研究区 C∶P 平均值 25.82,N∶P 平均值 2.49,C∶N∶P(24.67∶2.4∶1)低于全球土壤的平均水平(C∶N∶P=186∶13∶1)[30]。这可能是由于该地区凋落物分解速率较低,土壤养分可利用性较低。相关性分析显示,土壤C∶P与N∶P存在极显著正相关关系,表明P是滨海沙地植物生长发育的主要的限制因素。
3.3 细根与表层土壤C、N、P化学计量相关性分析
植物对土壤环境的适应性体现在其体内养分含量上,同时土壤养分状况也反映出植物的营养状况。土壤是植物生命活动的重要场所,且与细根直接接触。植物体内C、N、P等营养元素的主要来源是土壤,因此植物各器官中养分含量高低均与土壤养分紧密相关。土壤养分含量对植物生态化学计量特征有重要影响。对细根与土壤C、N、P化学计量进行相关性分析,结果表明细根N含量与C∶P间呈极显著负相关关系;P含量与C∶P、N∶P均呈极显著负相关关系,与高等陆生植物养分计量的普遍规律相符合[31]。对研究区细根与土壤化学计量进行相关性分析,表明细根C∶P与土壤C∶P和N∶P均呈极显著正相关;细根N∶P与土壤C∶P显著正相关、与土壤N∶P极显著正相关,这进一步验证了植物养分元素依赖于土壤养分。
4 结论
滨海沙地人工林细根C、N、P含量低于全国和全球平均水平,且 N、P 含量与 C∶N、C∶P 呈显著负相关,土壤C∶N∶P也低于全球土壤的平均水平。通过对细根、土壤养分元素比较分析,P元素是制约滨海沙地人工林正常生长和种群发育主要因子。因此,在滨海沙地人工林经营管理中可适量增施P肥,以提高人工林生产力。
本研究分析结果是基于单次采样试验,其结果为短期效应,而N和P含量在植物体内季节变异较大,因此需进一步研究其季节动态以便更真实的掌握滨海沙地人工林养分利用策略,以期为滨海沙地生态系统养分限制判定提供科学依据。
