β-甘露聚糖酶产生菌的筛选及魔芋低聚糖制备工艺的研究
2018-09-07郭金玲张丹阳樊雪莲吕育财田毅红龚大春
郭金玲,张丹阳,樊雪莲,吕育财,田毅红,龚大春
(1.三峡大学 湖北省生物酵素工程技术研究中心,湖北 宜昌 443002;2.三峡大学 生物催化宜昌市重点实验室,湖北 宜昌 443002;3.三峡大学 生物与制药学院,湖北 宜昌 443002)
魔芋葡甘聚糖(konjac glucomannan,KGM)是多年生经济作物魔芋(Amorophophallus konjac)的主要活性成分,由D-甘露糖和D-葡萄糖通过β-1,4-D-糖苷键按1.6∶1的物质的量比例连接而成,在甘露糖和葡萄糖残基的C3位置存在分支[1]。KGM为水溶性膳食纤维,有辅助医疗和保健作用,是一种优良的食品添加剂[2]。然而,由于其分子量大(可达105~106)[3],具有遇水后高膨胀、高黏度的特性,过量摄入将引起抗营养作用,从而使其应用受到限制。KGM水解产物魔芋低聚糖不仅水溶性高,还具有改善肠道内菌群结构、增强机体免疫力、抑制病原菌生长、降低血清总胆固醇及甘油三酯水平和减少有毒代谢产物产生等重要生理功能,成为新一代功能性食品[4]。因此,对KGM的水解改性研究成为国内外的研究热点。
β-甘露聚糖酶是一类可以水解β-1,4-D-甘露糖苷键的内切型水解酶,能够将KGM水解为由2~10个单糖分子连接而成的魔芋低聚糖,细菌、酵母菌、霉菌和放线菌均有产β-甘露聚糖酶的能力[4-5]。目前,细菌中的芽孢杆菌属(Bacillus)和霉菌中的曲霉属(Aspergillus)成为已报道的β-甘露聚糖酶的主要来源,研究主要集中在新的产酶微生物的发现、新酶的结构表征、酶的表达与改造等方面[6-11]。虽然β-甘露聚糖酶来源广泛、数量众多,但由于KGM溶于水后分子链伸展,黏度非常大,在β-甘露聚糖酶催化其水解的过程中,KGM浓度仍然比较低,导致了酶解产物后处理成本高、生产效率低[12]。因此,进一步开发能够在高底物浓度下快速水解KGM制备魔芋低聚糖的β-甘露聚糖酶具有重要意义。
本研究以魔芋粉为唯一碳源,从土壤中定向筛选可高效降解KGM为魔芋低聚糖的微生物,并对产酶微生物进行鉴定,研究其水解KGM的工艺条件,为实现魔芋低聚糖的高效制备奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
土壤样品:采自湖北省宜昌市长阳县魔芋种植地土壤。
1.1.2 试剂
魔芋胶(KGM含量≥95%):湖北一致魔芋生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(纯度>98%):上海源聚生物科技有限公司;薄层硅胶板G型(50 mm×100 mm):青岛海浪硅胶干燥剂有限公司;甘露糖(纯度98%):上海源叶生物科技有限公司;其他试剂均为市售分析纯。
1.1.3 培养基
初筛培养基:魔芋粉3.0 g/L,蛋白胨6.0 g/L,酵母膏1.0 g/L,NaCl 0.5 g/L,MgCl20.2 g/L,KH2PO41.0 g/L,琼脂18.0 g/L,pH 7.0,121 ℃灭菌20 min。
种子培养基:魔芋粉10.0 g/L,蛋白胨6.0 g/L,NaCl 1.0 g/L,MgSO40.5 g/L,KH2PO40.5 g/L,pH 7.0,121 ℃灭菌20 min。
发酵培养基:同种子培养基,121℃灭菌20 min。
1.2 仪器与设备
AR2140型电子天平:梅特勒-托利多仪器(上海)有限公司;镭磁PHS-3C型pH计:上海仪电科学仪器股份有限公司;SX-700蒸汽灭菌器:日本Tomy公司;SW-CT-1D型净化工作台:苏州净化设备有限公司;ZQLY-180型振荡培养箱:上海知楚仪器有限公司;MX-307落地高速冷冻离心机:日本Tomy公司;UV1800紫外可见分光光度计:日本岛津公司;DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司。
1.3 方法
1.3.1 产β-甘露聚糖酶微生物的筛选
(1)初筛:称取5.0 g土样加入45 mL无菌水中,摇床振荡20 min,使土壤中微生物充分混于水中,静置15 min。取1 mL上清液于无菌具塞试管中,加入9 mL无菌水,摇匀后依次梯度稀释至10-5。分别吸取10-3、10-4和10-5三个稀释度的菌悬液0.2 mL涂布于初筛培养基上,放入30℃恒温培养箱中倒置培养24 h,0.1%刚果红溶液染色10 min后观察水解圈大小,挑取水解圈与菌落直径之比较大的菌株纯化后置于4℃冰箱保存。
(2)复筛:将初筛得到的菌株接种于50 mL种子培养基中,30℃、200 r/min培养24 h后按1%(V/V)接种量接种至50 mL发酵培养基中,于相同条件下摇瓶培养48 h,发酵液经5 000 r/min离心10 min,上清液即为粗酶液。分别测定各菌株的β-甘露聚糖酶活力,筛选出β-甘露聚糖酶活力最高的出发菌株。
1.3.2 菌种G1的鉴定
(1)形态学及生理生化鉴定
参照文献[13-14]测定菌株G1的革兰氏染色、甲基红试验、柠檬酸盐利用、硝酸盐还原、尿素利用、明胶水解、淀粉水解、生长pH范围、耐受盐浓度和糖发酵试验等生理生化指标。
(2)分子生物学鉴定
分子生物学鉴定由上海生物工程有限公司完成,序列在美国国立生物技术信息中心(nationalcenterforbiotechnology information,NCBI)网站上进行Blast搜索,选取同源性较高菌株的16S rDNA序列进行比对,利用MEGA 7.0软件构建系统发育树。
1.3.3 魔芋低聚糖制备工艺条件的优化
魔芋低聚糖的制备工艺:用pH为4.5~8.0的磷酸氢二钠-柠檬酸缓冲液配制不同质量分数的KGM底物溶液,加入不同添加量(酶添加量用酶活力(U)与底物含量(g)来表示,U/g KGM)的β-甘露聚糖酶,于不同的恒温水浴锅中酶解。
制备工艺条件优化单因素试验:以还原糖转化率为评价指标,采用单因素轮换法考察酶解温度(40℃、45℃、50℃、55℃、60℃、65℃、70℃)、酶解pH值(4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)、酶添加量(2 U/g、5 U/g、10 U/g、20 U/g、30 U/g、40 U/g、50 U/g、60 U/g、70 U/g、80 U/g)、底物浓度(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)以及不同底物质量浓度(10 g/L、20 g/L、30 g/L)条件下酶解时间(1 h、2 h、3 h、4 h、5 h、6 h、7h、8 h、9 h和10 h)对魔芋低聚糖制备的影响,初始条件为pH 6.5,底物浓度10 g/L,酶添加量50 U/g,酶解时间2 h。
1.3.4 检测方法
(1)β-甘露聚糖酶活力的测定
甘露糖标准曲线的绘制:配制0.2 g/L甘露糖标准溶液,取6支10 mL刻度试管,分别加入甘露糖标准溶液0、0.5mL、1.0mL、1.5mL、2.0mL、2.5mL,蒸馏水2.5mL、2.0mL、1.5 mL、1.0mL、0.5mL、0,混匀后加入DNS2.5mL,于沸水浴中煮沸7min后迅速冷却,加入蒸馏水补足至10mL,以空白组调零,于波长540 nm条件下测定吸光度值,以甘露糖含量为横坐标,以吸光度值为纵坐标绘制标准曲线,标准曲线方程如下:
y=1.738x-0.141 8(R2=0.999 1)。
β-甘露聚糖酶活力的测定:参照文献[15],取A、B两支刻度试管,分别向其中加入2.4 mL、pH 5.5 KGM(5.0 g/L)溶液,于50℃水浴锅中预热5 min,在A管中加入0.1 mL经过适当稀释的粗酶液,B管不加酶液。50℃水浴条件下准确反应10min,立即分别向试管A和B中加入2.5mLDNS试剂,终止反应。再向B管中补加0.1 mL上述酶液,沸水中煮沸反应7 min,待冷却后向各管加入去离子水5 mL,摇匀,以B管为空白对照,于波长540nm处测量A管吸光度值(A540nm)。依据甘露糖标准曲线计算出溶液中生成的还原糖量(mg),再计算得到酶活。β-甘露聚糖酶酶活力定义:在上述条件下,每1 min产生1 μmol还原糖(以甘露糖为准)的酶量定义为1个甘露聚糖酶活力单位(U)。
(2)还原糖转化率的测定
样品还原糖转化率的测定:分别取适当稀释的酶解样品及空白(KGM底物溶液)于10 mL刻度试管中,按甘露糖标准曲线绘制的方法测定酶解样品液的吸光度值,每组实验做3次重复,由甘露糖标准曲线计算还原糖的量,并计算还原糖转化率,其计算公式如下:

(3)酶解产物的定性检测
采用薄层层析(thin layer chromatography,TLC)法根据各物质的比移值对酶解产物进行定性检测。将KGM(10 g/L)溶液及在最佳工艺条件下酶解1 h和2 h的KGM(10g/L)酶解液于沸水浴中煮沸5min,8000r/min离心10min后的上清液分别点样到G型硅胶板(50 mm×100 mm)上,标准品为甘露糖和甘露三糖。点样后置于正丁醇∶冰乙酸∶水的体积比为12∶6∶6的展层剂中展层,展层结束后,将硅胶板取出吹干,用喷雾器均匀淋喷苯胺-二苯胺-磷酸显色剂,于100℃烘箱显色15 min[16-17]。
2 结果与分析
2.1 产β-甘露聚糖酶微生物的筛选与鉴定
2.1.1 产β-甘露聚糖酶微生物的筛选

图1 菌株G1在初筛培养基平板上对魔芋葡甘聚糖的降解效果Fig.1 The degradation effect of strain G1 on konjac glucomannan on the primary screening medium plate
采用以魔芋粉为唯一碳源的培养基,经刚果红染色初筛和发酵复筛,从湖北省宜昌市魔芋地土壤中分离出一株水解圈与菌落直径之比较大(比值为2.3)、酶活性较高(70.1U/mL)的菌株,编号为G1,其在初筛培养基上对KGM的降解效果如图1所示。
2.1.2 菌株G1的鉴定
菌株G1的形态观察、生理生化试验结果见表1,系统发育树如图2所示。

表1 菌株G1的生理生化性质Table 1 Physiological and biochemical characterizations of strain G1

图2 基于16S rDNA序列分析的菌株G1的系统发育树Fig.2 Phylogenetic tree of strain G1 based on 16S rDNA sequence analysis
由表1可知,菌株G1呈革兰氏阳性,具有不能利用尿素,可水解淀粉和明胶,能耐受90 g/L盐浓度等性质。由图2可知,该菌株G1与枯草芽孢杆菌(Bacillus subtilis)聚于一支,同源性>99%,结合形态观察和生理生化试验结果,鉴定菌株G1为枯草芽孢杆菌(Bacillus subtilis)。
2.2 魔芋低聚糖制备工艺条件优化
2.2.1 酶解温度对魔芋低聚糖制备的影响
酶解温度对魔芋低聚糖制备的影响结果如图3所示。由图3可知,在温度为40~55℃之间时,还原糖转化率随温度的升高呈上升趋势;温度为55℃时,还原糖转化率达到最高值(51.2%);在55℃之后,还原糖的转化率随着温度的升高明显下降,分析原因可能是由于高温引起酶活力损失,导致酶解能力下降[17]。因此,确定55℃为最佳酶解温度。此结果与SRIVASTAVA P K等[5]报道的Bacillus属β-甘露聚糖酶的最适温度相符。

图3 酶解温度对还原糖转化率的影响Fig.3 Effect of enzymolysis temperature on the conversion ratio of reducing sugar
2.2.2 酶解pH值对魔芋低聚糖制备的影响
不同酶解pH值对魔芋低聚糖制备影响的结果见图4。
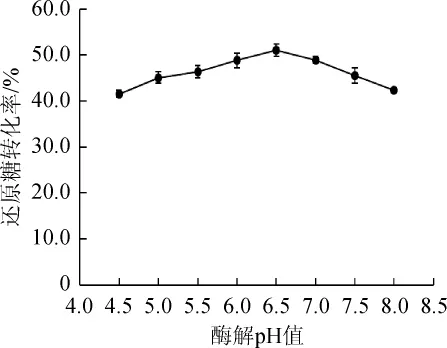
图4 酶解pH值对还原糖转化率的影响Fig.4 Effect of enzymolysis pH value on the conversion ratio of reducing sugar
由图4可知,当酶解pH值为4.5~6.5时,还原糖转化率随pH值的增大而增加;pH值为6.5时,还原糖转化率达到最高(51.3%);当pH值>6.5之后,还原糖转化率随pH值的增大而降低;当pH为8.0时,还原糖转化率仍然可达到42.4%。通常,随着酶解pH值偏离最适pH值酶解效率会明显下降[17-18]。本研究中的β-甘露聚糖酶在pH 4.5~8.0范围内均具有较好的转化效果,说明对pH具有较强的耐受性。最终确定KGM酶解的最适pH值为6.5,与何丹等[18]报道的酶法制备魔芋甘露寡糖的最适pH值一致。
2.2.3 酶添加量对魔芋低聚糖制备的影响
β-甘露聚糖酶添加量对魔芋低聚糖制备的影响结果见图5。由图5可知,酶添加量为2~50 U/g时,随着β-甘露聚糖酶添加量的增加,还原糖的转化率迅速增加,由9.0%增加至51.5%;当加酶量达到50 U/g以后,还原糖的转化率的增加缓慢,且与50 U/g的加酶量时还原糖的转化率差异不显著(P>0.05)。考虑到使用成本,选择50 U/g为最佳酶添加量。目前,已报道的工艺中酶添加量大多在50~250 U/g,本研究与其处于同一水平[12,15,17-18]。
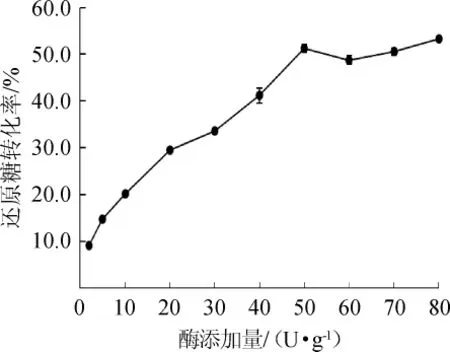
图5 酶添加量对还原糖转化率的影响Fig.5 Effect of enzyme addition on the conversion ratio of reducing sugar
2.2.4 底物质量浓度对魔芋低聚糖制备的影响
底物质量浓度对魔芋低聚糖制备的影响结果如图6所示。

图6 魔芋葡甘聚糖浓度对还原糖转化率的影响Fig.6 Effect of konjac glucomannan concentration on the conversion ratio of reducing sugar
由图6可知,在GM质量浓度为5~10 g/L时,还原糖转化率增加不显著(P>0.05);还原糖的转化率在KGM质量浓度为10 g/L时达到最大(51.6%);继续增加KGM浓度时,还原糖的转化率随之降低,当KGM质量浓度为30g/L时,还原糖转化率下降至35.9%。这主要是由于魔芋胶吸水性强,随着底物浓度的增大,黏度迅速增加,严重阻碍酶对底物的充分水解,同时也限制了可溶性还原糖的释放,因此,还原糖转化率下降[15]。然而,本实验中筛选的β-甘露聚糖酶对30 g/L的KGM底物仍具有较好的转化效果(35.9%),酶解2 h后还原糖转化率可以达到30%以上,表明来源于B.subtilisG1的β-甘露聚糖酶具有较好的应用前景。
2.2.5 酶解时间对魔芋低聚糖制备的影响
为了加强高底物浓度下的酶解效果,考察了酶解时间对魔芋低聚糖制备的影响。不同底物浓度(10 g/L、20 g/L、30 g/L)条件下,酶解时间对魔芋低聚糖制备的影响结果如图7所示。
由图7可知,当底物质量浓度为10 g/L时,酶解2 h时还原糖转化率达到51.6%,之后还原糖的转化率趋于稳定,稳定在50.1%~54.5%范围内;当底物质量浓度为20 g/L时,酶解时间为0~4 h时,随着酶解时间的延长,还原糖转化率迅速增加,在4 h时还原糖转化率达到49.5%,4~10 h时增加速率减慢,由49.5%增加至56.2%;当底物质量浓度为30 g/L时,酶解时间为0~4 h时,还原糖转化率随着酶解时间的延长而迅速增加,酶解4h时,还原糖转化率达到46.9%,之后趋于缓慢增加,由46.9%增加至53.6%。
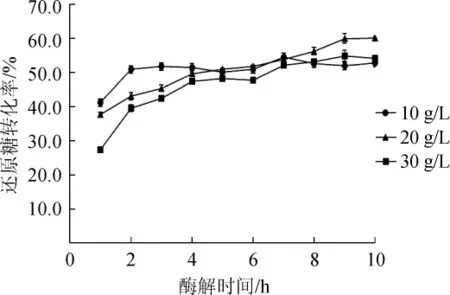
图7 酶解时间对还原糖转化率的影响Fig.7 Effect of enzymolysis time on the conversion ratio of reducing sugar
由此得出魔芋低聚糖制备的最佳工艺条件为:温度55℃,pH 6.5,酶添加量50 U/g,KGM质量浓度10 g/L时,酶解时间为2h,KGM质量浓度为20~30g/L,酶解时间为4h。
2.3 酶解产物的定性检测
酶解产物的定性检测结果如图8所示。

图8 魔芋葡甘聚糖酶解产物的薄层层析分析Fig.8 Thin layer chromatography of enzymolysis products of konjac glucomannan
由图8可知,随着酶解时间的延长,点样处的颜色逐渐变浅,KGM质量浓度为10 g/L,酶解1 h和2 h后的酶解产物主要为三糖及三糖以上的低聚糖。
3 结论
本研究从魔芋地土壤中定向筛选出了一株高产β-甘露聚糖酶的菌株枯草芽孢杆菌(Bacillus subtili)G1。该酶水解魔芋胶制备魔芋低聚糖的工艺条件为:酶添加量50 U/g,酶解pH6.5,酶解温度55℃;KGM质量浓度为10g/L时,酶解时间为2 h,还原糖转化率为51.6%;KGM质量浓度为30 g/L时,酶解时间4 h,还原糖转化率仍可达到46.9%,表明该酶具有较高的催化效率。通过薄层层析定性检测,发现酶解产物主要为三糖及三糖以上的低聚糖。本研究中获得的β-甘露聚糖酶在制备魔芋低聚糖上表现出优良的性能,为实现酶法制备魔芋低聚糖的工业化生产奠定了基础。
