海洋尿酸氧化酶菌株发酵条件响应面优化
2018-09-07周新尚肖景惠张庆芳窦少华
逄 飞,周新尚,肖景惠,张庆芳,窦少华*
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物生物工程技术研究中心,辽宁 大连 116622)
尿酸氧化酶(urate oxidase)EC 1.7.3.3是参与生物体内核酸代谢的一种重要的氧化酶。尿酸的嘌呤环能被尿酸氧化酶催化开放,使尿酸被分解为尿囊素、二氧化碳和过氧化氢。尿酸的溶解度是尿囊素的1/10~1/5,尿酸被分解为尿囊素从而排出体外。该酶存在于哺乳动物,昆虫,植物,微生物中[1-4]。但是,人类和其他高等灵长类动物由于相关基因缺失而不能产生尿酸氧化酶[5]。因此,尿酸才是人类和某些猿类嘌呤代谢的终产物。尿酸氧化酶的来源非常广泛,尿酸氧化酶最早被SCHITTENHELM发现,他从牛的肾脏中提纯了此酶[6]。随着生命科学和化学的不断发展,极大丰富了尿酸氧化酶的来源,并对尿酸氧化酶的性质进行研究[7]。其中,从微生物中发现尿酸氧化酶是尿酸氧化酶研究的重要进步。20世纪70年代,BONGAERTS G P等[8]发现苛求芽孢杆菌(Bacillus fastidious)能产生尿酸氧化酶,并且其能把尿酸作为唯一碳源。此后,不同微生物来源的尿酸氧化酶不断被发现,已经研究了许多产生尿酸酶的微生物,例如枯草芽孢杆菌(Bacillus subtilis)、铜绿假单胞菌(Pseudomona aeruginosa)、黄曲霉(Aspergillus flavus)和产朊假丝酵母(Candida utilis),其生产尿酸氧化酶的能力已经被研究[6]。从微生物中分离出的尿酸氧化酶绝大多数都是胞内酶。大多数的尿酸氧化酶菌株都是从土壤样品中筛选得到的[4,9-10],降解物着色法、水解圈法及透明圈法[11]等是较为常用的筛选方法。现在报道比较多的尿酸氧化酶的产生菌主要有芽孢杆菌、真菌、酵母等[11],但是筛选方法大都是选择的透明圈法,因为这种筛选的方法操作简单。从海洋中筛选尿酸氧化酶菌株少见报道。因此,本研究从大连黄海海泥中分离出一株尿酸氧化酶高产菌苛求芽孢杆菌(Bacillus fastidious)菌株Z7-1,通过单因素试验和响应面设计试验优化其发酵条件,首先基于Plackett-Burman(PB)试验设计找出重要影响因子,然后经DesignExpert.V8.0.6软件中响应面Box-Behnken试验设计对响应过程变量进行数学建模及分析,进一步优化响应因子,确定最优发酵条件,目的是提高尿酸氧化酶的活力,从而为该尿酸氧化酶更深入研究及中试实验奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
苛求芽孢杆菌(Bacillus fastidious)Z7-1:大连黄海海域海泥中筛选出来的Z7菌株经紫外(ultraviolet,UV)-亚硝基胍(nitrosoguanidine,NTG)复合诱变得到,保藏在辽宁省海洋微生物工程技术研究中心。
1.1.2 化学试剂
尿酸、蛋白胨、酵母膏、葡萄糖、磷酸氢二钾、牛肉膏、葡萄糖、氯化钠、硫酸亚铁、硫酸镁、琼脂粉(均为生化试剂):生物工程上海股份有限公司。其他实验所用试剂均为国产分析纯。
1.1.3 培养基
种子培养基:尿酸5 g,酵母膏3 g,NaCl 0.1 g,MgSO40.5g,K2HPO42.0g,KH2PO40.5g,pH7.5,0.1MPa灭菌20min。
发酵培养基:尿酸5 g,酵母膏3 g,NaCl 0.1 g,MgSO40.5g,K2HPO42.0g,KH2PO40.5g,pH7.5,0.1MPa灭菌20min。
1.2 仪器与设备
HZP-250全温振荡培养箱、DK-S26电热恒温水浴锅:上海精宏实验设备有限公司;LTI-700低温恒温培养箱:上海爱朗仪器有限公司;DHG-9070电热恒温鼓风干燥箱:上海一恒科技有限公司;UV-2102C紫外可见分光光度计:尼柯仪器有限公司;LDZX-40BI立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3 方法
1.3.1 种子液制备
在无菌条件下,将斜面保藏的菌株Z7-1接种于发酵培养基中,25℃、160 r/min摇床中振荡培养24 h,作为一级种子液。用移液枪吸取5%的一级种子液接种到发酵培养中,同样条件培养24 h,作为二级种子液。
1.3.2 粗酶液制备方法
取发酵液8 000 r/min离心15 min,离心获得的湿菌经pH8.5的硼酸缓冲溶液洗涤3次以上,直至发酵液洗净为止。将洗涤后的菌体悬浮于pH8.5的硼酸缓冲溶液中,冰浴条件下超声波破碎,能量30%,每次破碎3s,间隙3s,破碎30min。将破碎液12 000 r/min离心15 min,上清液即为粗酶液。
1.3.3 尿酸氧化酶酶活测定方法
将粗酶溶液0.1 mL与含有2 mmol/L尿酸的0.6 mL硼酸钠缓冲液(pH8.5,0.1 mol/L)、0.15 mL 4-氨基安替比林(30 mmol/L)、0.1 mL苯酚(1.5%)、0.05 mL过氧化物酶(15 U/mL)加入到25 mL比色管中,25℃孵育10 min。然后通过加入1.0 mL乙醇停止反应,去离子水定容至20 mL。空白对照:把粗酶液置换为硼酸钠缓冲液。采用分光光度计测定波长540 nm处的吸光度值。
尿酸氧化酶酶活单位的定义:在标准测定条件下,每min可产生1.0 μmol H2O2的酶量为一个酶活单位(U/mL)。
1.3.4 发酵条件优化单因素试验
(1)碳源、氮源优化:分别在发酵培养基中加入可溶性淀粉、尿酸、蔗糖、乳糖、麦芽糖、葡萄糖作为碳源,添加量为0.5%;分别在发酵培养基中加入蛋白胨、酵母膏、牛肉膏、磷酸氢二铵、氯化铵、尿素作为氮源,添加量为3%。在25℃、160 r/min条件下培养36 h,按照酶活测定方法测定酶活,考察碳源、氮源对苛求芽孢杆菌Z7-1产尿酸氧化酶的影响。每个处理做3个平行。
(2)尿酸添加量分别为0.25%、0.50%、0.75%、1.00%、1.25%,酵母膏添加量分别为0.25%、0.50%、0.75%、1.00%、1.25%,K2HPO4添加量分别为0.10%、0.15%、0.20%、0.25%、0.30%;KH2PO4添加量分别为0.01、0.03%、0.05%、0.07%、0.09%的;MgSO4添加量分别为0.01%、0.03%、0.05%、0.07%、0.09%,培养基初始pH值分别为6.5、7.0、7.5、8.0、8.5,发酵温度分别为10℃、15℃、20℃、25℃、30℃、35℃、40℃,转速分别为140 r/min、150 r/min、160 r/min、170 r/min、180 r/min,装液量分别为50 mL/500 mL、75 mL/500 mL、100 mL/500 mL、125 mL/500 mL、150 mL/500 mL、175 mL/500 mL,接种量分别为3%、4%、5%、6%、7%。在25℃、160 r/min条件下振荡培养36 h后测定酶活,考察各个因素对苛求芽孢杆菌Z7-1产尿酸氧化酶的影响。每个处理做3个平行。
1.3.5 Plackett-Burman设计
在单因素试验的基础上,选取9个影响因素作为研究对象,以尿酸氧化酶酶活(Y)为响应值,进行试验次数N=12的Plackett-Burman(PB)设计,PB试验设计的因素与水平见表1。

表1 Plackett-Burman试验因素及水平设计Table 1 Factors and levels of Plackett-Burman experiments
1.3.6 最陡爬坡试验设计
根据Plackett-Burman试验结果中各个显著影响因素效应的大小来设定步长及变化方向,找出峰值,快速逼近最佳值区域。
1.3.7 中心组合试验设计
根据最佳爬坡试验结果,将酶活最高的一组作为中心组合试验中心点,运用Minitab 15软件进行Box-Behnken试验设计,采用响应面分析法对产酶条件参数进行优化分析。运用Minitab15软件分析得到最优结果,最后对预测值进行验证。每个试验重复3次,取平均值。
2 结果与分析
2.1 发酵条件优化
2.1.1 最适碳源的确定
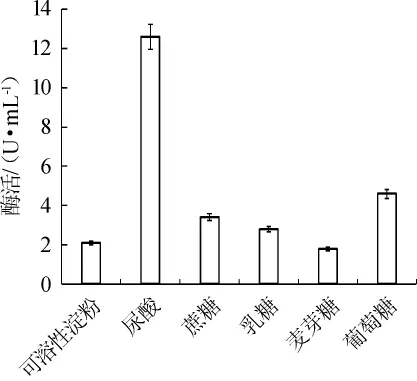
图1 不同的碳源对酶活的影响Fig.1 Effects of different carbon sources on enzyme activity
如图1所示,尿酸作为唯一碳源时,菌株Z7-1产尿酸氧化酶的酶活最高,葡萄糖次之,可溶性淀粉、蔗糖、乳糖、麦芽糖作为碳源时,酶活很低。因此,尿酸是菌株Z7-1产尿酸氧化酶的最适碳源。
2.1.2 尿酸添加量的确定

图2 不同的尿酸添加量对酶活的影响Fig.2 Effects of different uric acid addition on enzyme activity
如图2所示,尿酸添加量从0.25%升至1.25%,尿酸氧化酶的酶活随着尿酸添加量的增加而增高,当尿酸添加量达到1.00%时尿酸氧化酶的酶活最高。然而当尿酸添加量>1.00%之后,酶活反而下降,是因为尿酸难溶于水,尿酸浓度增加反而阻碍了菌株Z7-1对尿酸的利用。因此,最适尿酸添加量为1.00%。
2.1.3 最适氮源的确定
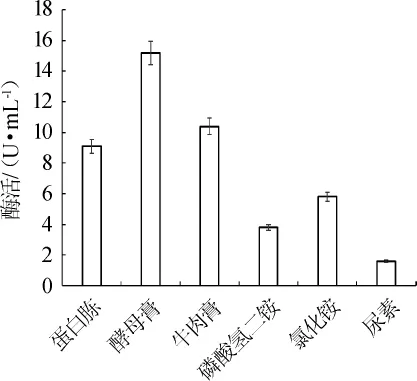
图3 不同的氮源对酶活的影响Fig.3 Effects of different nitrogen sources on enzyme activity
如图3所示,当无机氮作为唯一氮源时,菌株Z7-1产酶酶活很低。而菌株利用蛋白胨、酵母膏、牛肉膏时酶活很高。因此菌株Z7-1产酶是利用的有机氮。其中将酵母膏作为氮源时酶活最高。因此,选酵母膏为最适氮源。
2.1.4 酵母膏添加量的确定
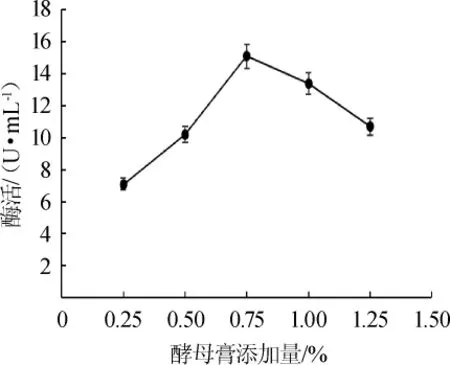
图4 酵母膏添加量对酶活的影响Fig.4 Effects of yeast extract addition on enzyme activity
如图4所示,随着酵母膏添加量在0.25%~0.75%范围内增加,菌株产酶酶活也随之增高。当酵母膏添加量达到0.75%时酶活最高。而酵母膏添加量过高时,酶活反而下降。说明浓度过高的酵母膏会对菌体生长有一定抑制作用,进而影响尿酸氧化酶的合成,然而酵母膏添加量过低就会影响酶的大量合成[12]。因此,最适酵母膏添加量为0.75%。
2.1.5 无机盐最适添加量的确定
如表2所示,当K2HPO4添加量为0.25%时,尿酸氧化酶酶活最高,为16.1 U/mL;KH2PO4添加量0.07%时尿酸氧化酶酶活最高,为16.4 U/mL,说明适量KH2PO4和K2HPO4对该菌株产酶有促进作用;MgSO4添加量0.05%时,尿酸氧化酶酶活最高,为15.8 U/mL;说明少量的硫酸镁对该菌株产酶有促进作用。
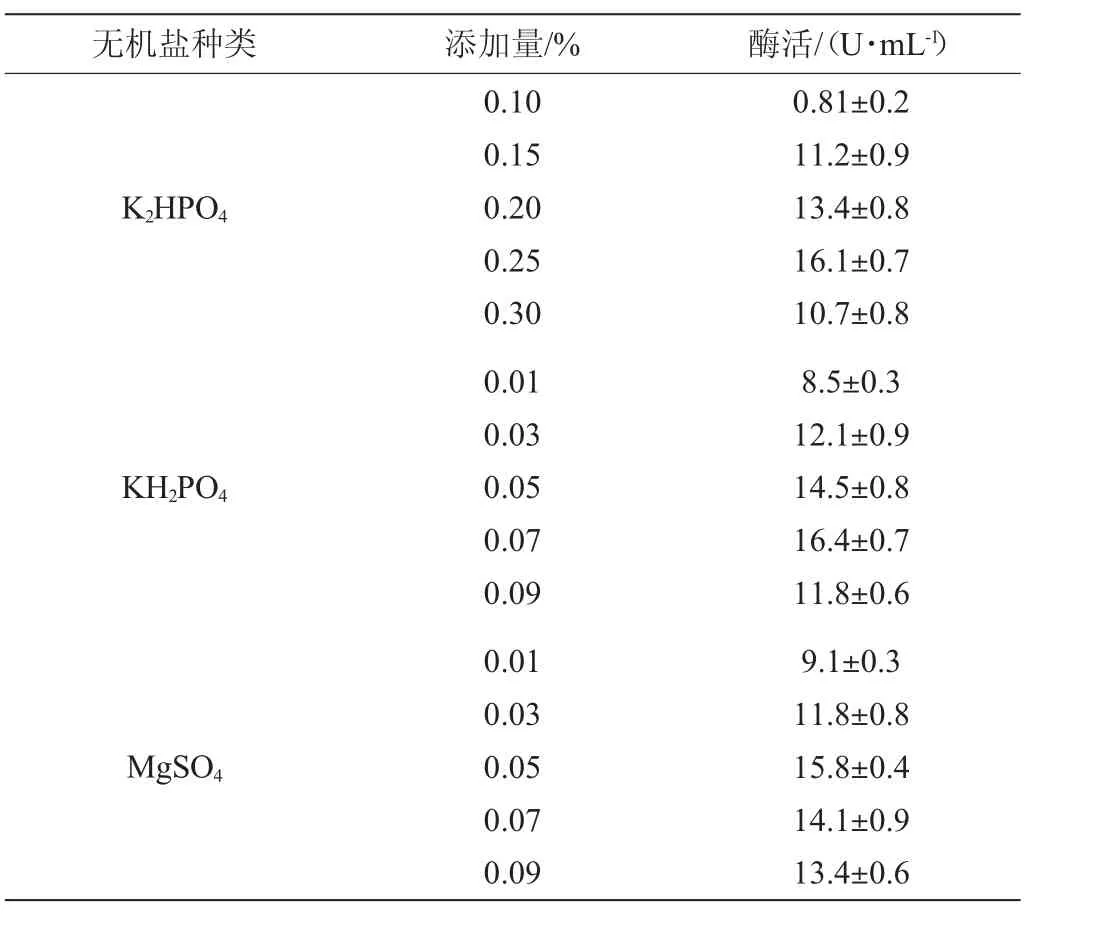
表2 无机盐添加量对酶活的影响Table 2 Effects of inorganic salt addition on enzyme activity
2.1.6 发酵初始pH值对产酶的影响
如图5所示,当发酵初始pH值为6.5~7.5时,菌株产酶酶活也随之增高;当发酵初始pH值为7.5时,酶活最高,为16.5 U/mL;当发酵初始pH值>7.5之后,酶活有所下降,过酸过碱都会影响菌株产酶。因此,最适发酵初始pH值为7.5。

图5 初始pH值对酶活的影响Fig.5 Effects of initial pH value on enzyme activity
2.1.7 发酵温度对产酶的影响

图6 发酵温度对酶活的影响Fig.6 Effects of fermentation temperature on enzyme activity
如图6所示,当发酵温度为10~25℃时,菌株酶活也随之增高;当发酵温度为25℃时,发酵酶活最高,为17.5 U/mL;随着发酵温度>25℃之后,酶活降低。因此,最适发酵温度为25℃。
2.1.8 转速对产酶的影响
如图7所示,酶活随着转速在140~160 r/min范围内的增加而增高;当转速为160 r/min时酶活最高,为17.8 U/mL;转速>160 r/min之后,酶活会随之下降,过高的转速可能影响了菌体的生长。因此,最适转速为160 r/min。
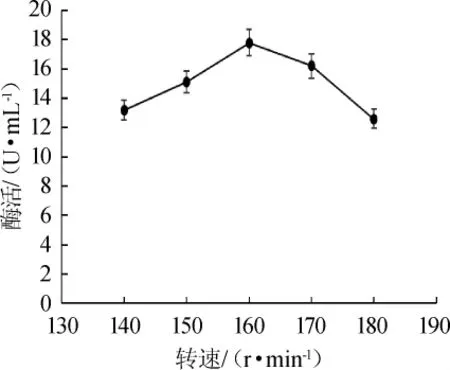
图7 转速对酶活的影响Fig.7 Effects of rotating speed on enzyme activity
2.1.9 装液量对产酶的影响
如图8所示,在装液量为(50~125)mL/500mL时,菌株Z7-1产尿酸氧化酶的酶活随之增加;当装液量为125 mL/500 mL时,酶活最大,为17.9 U/mL;当装液量>125 mL/500 mL之后,酶活随之下降。装液量影响酶活,主要是影响菌株对溶氧的需求。装液量为125 mL/500 mL时,能达到菌株对溶氧的需求,促进了菌株的生长,进而促进了菌株产酶。因此,最适装液量为125 mL/500 mL。
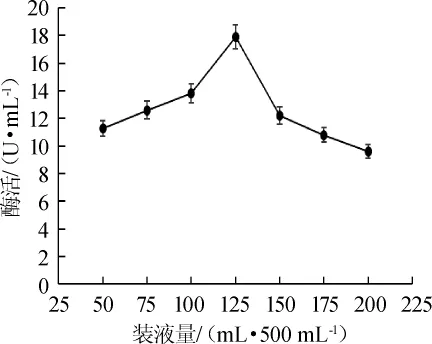
图8 装液量对酶活的影响Fig.8 Effects of liquid volume on enzyme activity
2.1.10 接种量对产酶的影响
如图9所示,当接种量为3.0%~5.0%时,菌株产尿酸氧化酶随接种量增大而升高;当接种量为5%时,酶活达到最大,为17.6 U/mL;当接种量>5.0%之后,酶活反而下降。这是因为培养基中的营养物质是有限的,培养基中菌体数目过多也会影响菌株的生长,进而影响菌株产酶。因此,最佳接种量为5.0%。
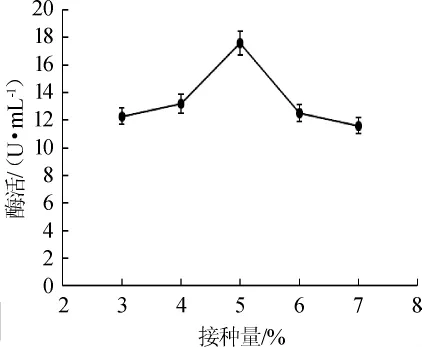
图9 接种量对酶活的影响Fig.9 Effects of inoculum on enzyme activity
2.2 Plackett-Burman设计筛选显著因子[13-15]
在单因素试验的基础上,设计Plackett-Burman(N=12)实验,对影响尿酸氧化酶发酵工艺中的9个因素的显著性进行考察。试验的设计及结果见表3,利用Minitab15软件进行主效应分析,结果见表4。
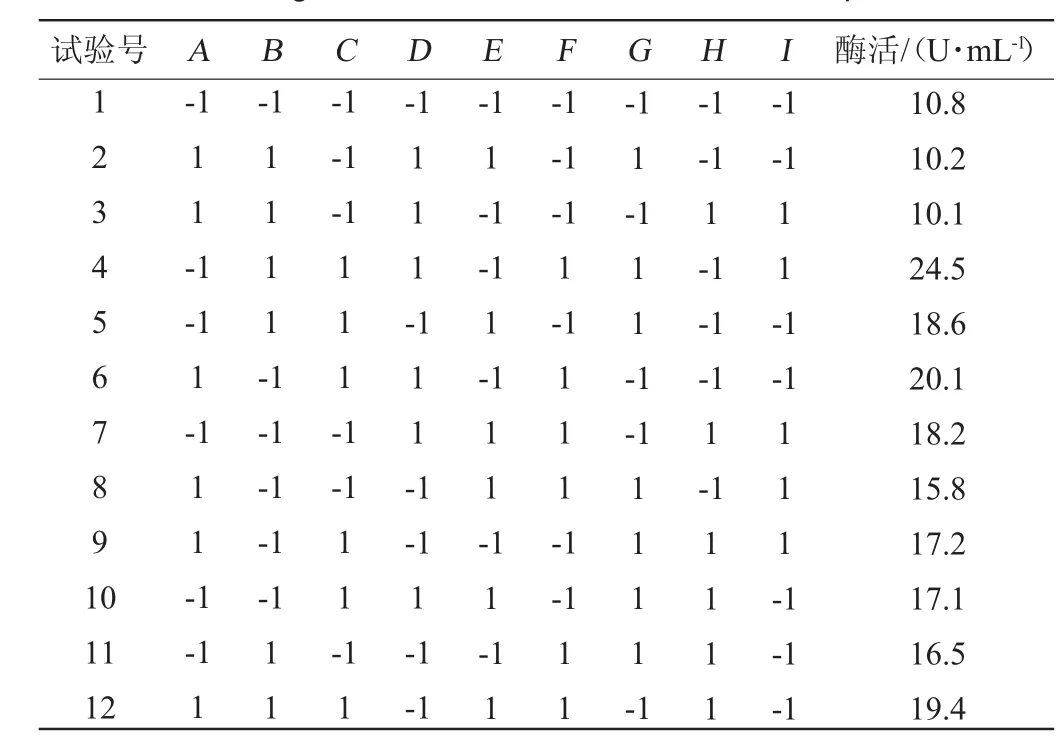
表3 Plackett-Burman试验设计与结果Table 3 Design and results of Plackett-Burman experiments
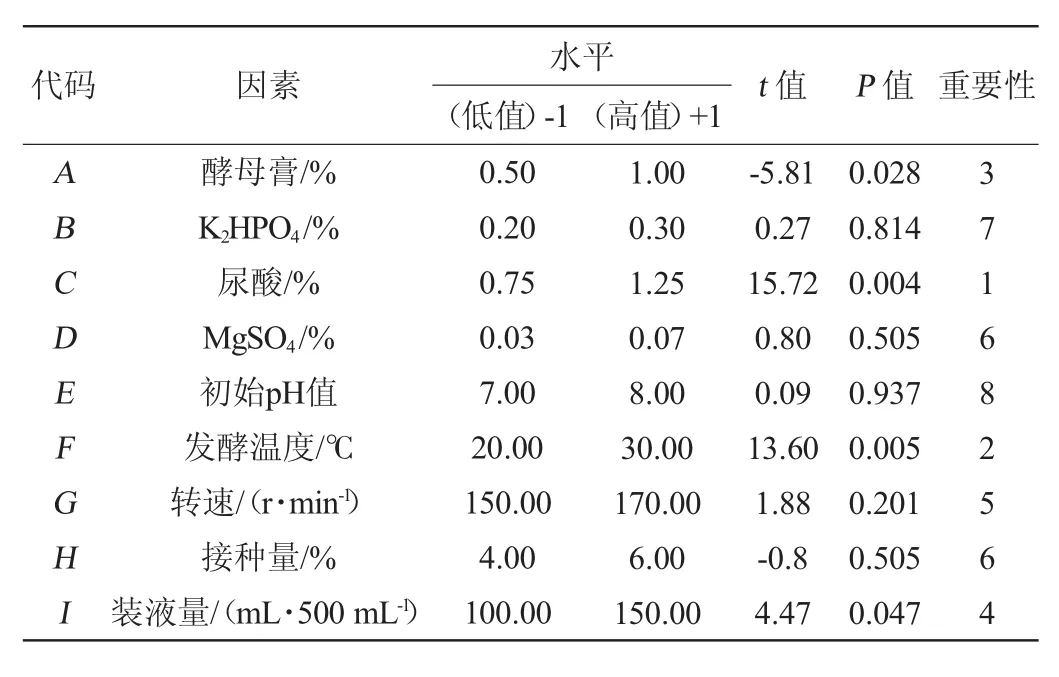
表4 Plackett-Burman设计的各因素水平及主效应分析Table 4 Factors,levels and significance analysis of Plackett-Burman design
由表4中的P值可知,尿酸、发酵温度、酵母膏的P值分别为0.004、0.005、0.028,由于这三个因素的P值均<0.05,所以这3个因素对试验结果的影响均>95%,达到显著水平,在所选因素中对试验结果影响最大,其中尿酸、发酵温度具有正效应,酵母膏具有负效应。因此选尿酸添加量、酵母膏添加量、发酵温度设计响应面试验。
2.3 最陡爬坡试验
最陡爬坡试验是为了确定显著影响因素的取值逼近中心点以及提高尿酸氧化酶的产量,尿酸添加量、发酵温度和酵母膏添加量这3个因素的变化方向和步长的试验设计及结果见表5。由表5可知,3个显著影响因素的中心点在第2组试验附近,因此确定以第2组的水平作为响应面试验的中心点,即尿酸添加量(X1)、酵母膏添加量(X2)、发酵温度(X3)分别为1.00%,0.75%和25℃。
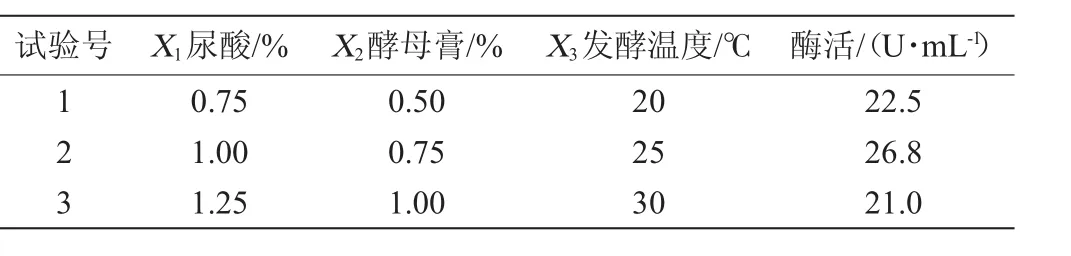
表5 最陡爬坡试验设计及结果Table 5 Design and results of the steepest ascent experiments
2.4 响应面试验设计
利用上述Plackett-Burman试验结果,在PB试验和最陡爬坡试验确定的3因素3水平的基础上,以酶活(Y)为响应值,响应面试验因素与水平见表6,设计及结果见表7。
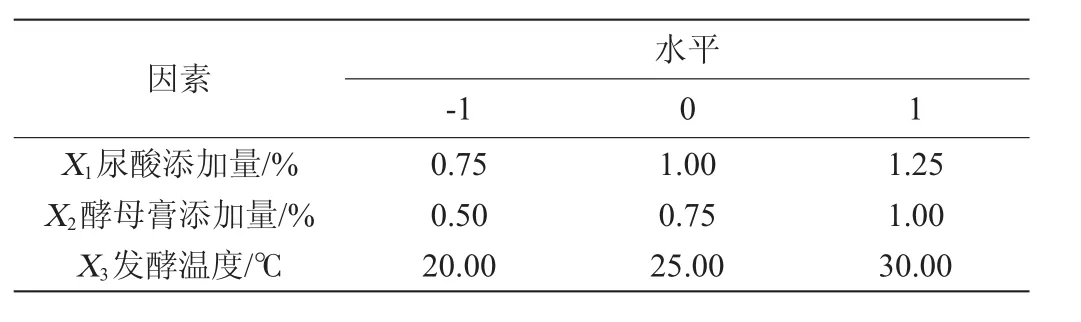
表6 响应面试验因素与水平Table 6 Factors and levels of response surface experiments
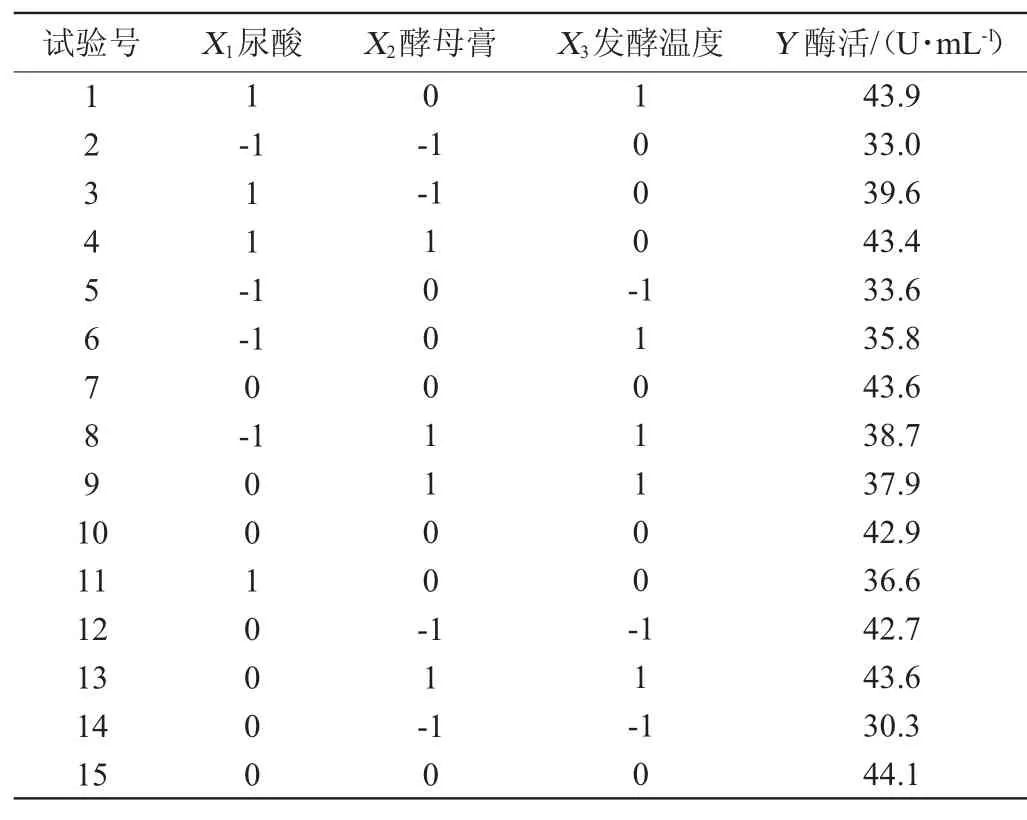
表7 Box-Behnken试验设计及结果Table 7 Design and results of Box-Behnken experiments
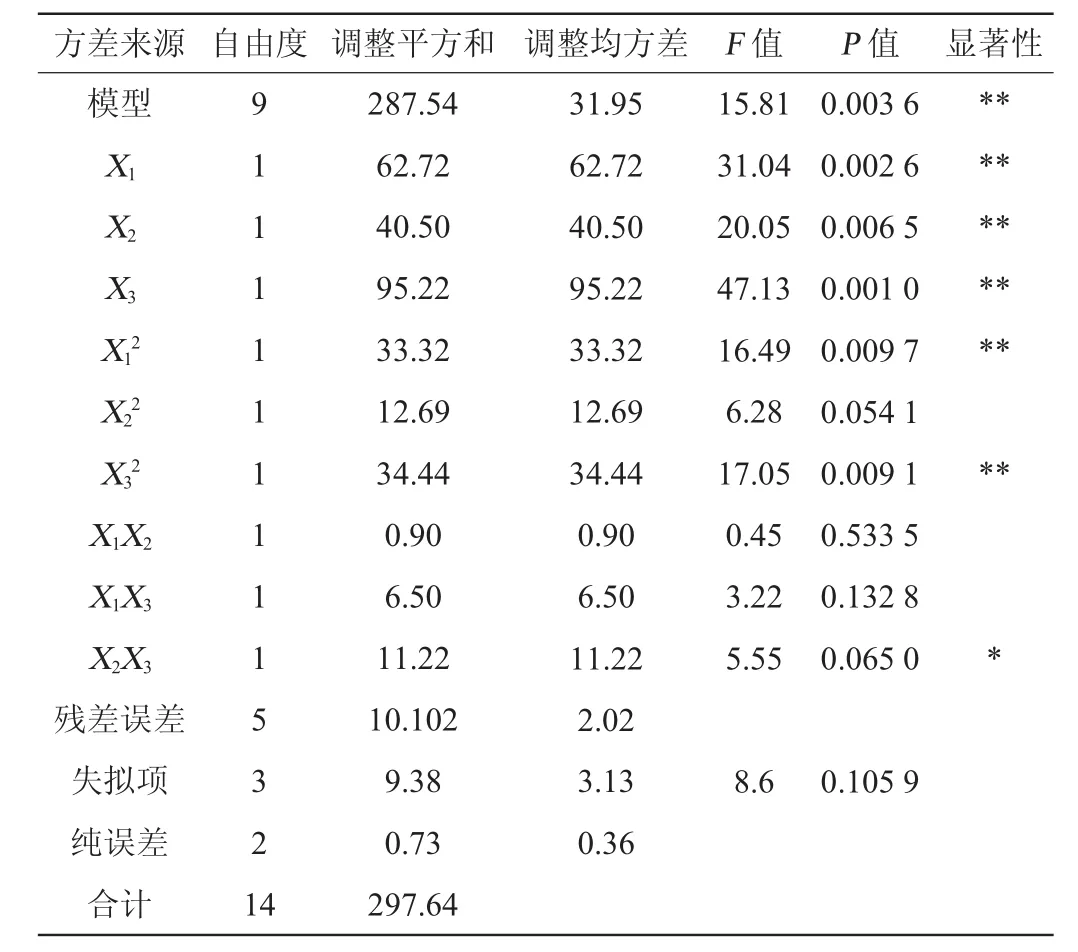
表8 回归方程方差分析Table 8 Variance analysis of the quadratic model
运用Minitab15软件对表7中心组合试验数据进行回归模型方差分析,结果见表8。回归拟合二次多项式得到回归方程:Y=45.53+2.80X1+2.25X2+3.45X3-0.48X1X2+1.28X1X3-
由表8可知,该回归模型的影响达到极显著水平(P<0.01),失拟项P值为0.106>0.05,因而无失拟因素存在。其自变量X1,X2,X3,X2X3,X32对响应值影响显著(P<0.05),其他项均不显著(P>0.05)。回归方程的决定系数R2=0.9661>0.9,校正决定系数R2Adj为0.951 2>0.9,表明响应值变化有96.61%来源于所选变量,说明模型拟合度较好,该回归方程可用于代替试验真实点对试验结果进行初步分析和预测[16-18]。
利用Minitab15软件绘制响应面曲线图,结果见图10。由图10可知,响应值存在最大值,经软件分析获得酶活发酵条件为尿酸添加量1.14%,酵母膏添加量0.81%,发酵温度28.1℃,软件分析预测最大酶活为45.6 U/mL。为了便于实际操作,将发酵条件修改为尿酸添加量1.00%,酵母膏添加量0.80%,发酵温度28℃,在此条件下重复3次验证试验,平均酶活为42.5 U/mL,与理论值接近,表明采用响应面法优化得到的最佳条件准确可靠。优化后的酶活比优化前的12.1 U/mL提高了251.8%。
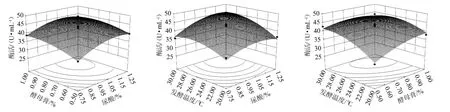
图10 发酵温度与尿酸,酵母膏添加量对酶活交互影响的曲面及等高线Fig.10 Response surface plots and contour line of effects of interaction between fermentation temperature,uric acid and yeast extract addition on enzyme activity
3 结论
本试验对苛求芽孢杆菌(Bacillus fastidiosus)Z7-1产酶条件进行优化。在单因素试验基础上采用Mintab软件设计Plackett-Burman试验得出尿酸、酵母膏、发酵温度3个最重要影响因素;利用Box-Behnken模型对菌株Z7-1发酵生产尿酸氧化酶的培养条件进行优化,方差分析后表明模型拟合度良好。单因素及响应面优化结果为尿酸添加量1.00%、酵母膏添加量0.80%、K2HPO4添加量0.25%、MgSO4添加量0.05%、KH2PO4添加量0.07%、培养温度28℃、转速160r/min、接种量5%、pH7.5、装液量125mL/500mL。通过产酶条件优化尿酸氧化酶酶活由优化前的约12.1U/mL提高到42.57U/mL,比优化前提高了251.8%。
苛求芽孢杆菌Z7-1最适生长温度为25℃,该菌株属于耐冷菌,发酵粗酶液最适作用温度为25℃,属于低温酶。海洋环境低温、高盐、高压,菌株Z7-1与其他国内外筛选的尿酸氧化酶酶菌株相比[4],具有适应低温环境(25℃),耐盐性极好,耐高压等优良特征。海洋尿酸氧化酶对催化尿酸嘌呤环的氧化开放的性质、临床分析和临床药物以及染发剂商业配方中的添加剂的制备更具有优势。因此,对该菌株发酵条件的研究,可为其进一步发酵放大乃至工业化生产提供理论基础。
