酱香大曲中3株放线菌的分离筛选及挥发性成分分析
2018-09-07罗小叶王晓丹邱树毅
罗小叶,王晓丹,邱树毅*
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
酱香大曲是一种高温大曲,通过传统固态发酵的方法,在65℃条件下,用小麦加母曲经过60 d的发酵自然形成的一个含有多种微生物体系的发酵制品[1-3]。多种微生物富集在大曲里在制曲过程中自然生长起来,整个大曲微生物复杂而多样。目前采用纯培养技术及分子生物学手段对茅台大曲中的细菌、霉菌及酵母进行了深入的研究,证实了细菌的生香动力、霉菌的糖化主力以及酵母的酒醅发酵原动力的作用,诠释了大曲中微生物在大曲酒的品质及风味呈现方面的重要作用[4-6]。
在大曲中“菌系”中的放线菌是一类具有高鸟嘌呤(G)和胞嘧啶(C)含量的革兰氏阳性细菌,其因产生丰富的活性次生代谢产物而著名,是一种重要的微生物类群。对于传统白酒生产领域有关放线菌研究,主要集中在白酒发酵过程中酒醅、大曲、窖泥、发酵池、曲房和窖房空气中放线菌的分离及鉴定,如崔福来等[7-9]对酒醅中的放线菌进行分离筛选研究。并有少量文献如王涛等[10-11]对酿造相关的放线菌挥发性物质及代谢酶活性进行了研究报道。放线菌作为抗生素的主要生产菌种,在其他领域的研究较为深入,但作为白酒酿造的四大菌类之一,放线菌某些独特代谢产物具有土味等特征,对白酒风味的影响不可忽视[12],在白酒酿造过程中影响着酒体的风味、风格,相对于其他三大类微生物,还没被引起足够的重视。目前,研究人员仅对酱香大曲生产过程中周围土壤及糟醅中的放线菌进行了研究,对酱香大曲中放线菌的种类及功能鲜有研究报道。
本研究旨在建立了一种有效的放线菌分离筛选方法,通过形态学、生理生化及26S rDNA分子生物学对筛选的放线菌进行了鉴定,并采用大曲酶系酶活力测定方法对其酶活性质及通过固态微萃取与气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)技术对发酵代谢产物成分进行了分析,为了解放线菌在酱香大曲中的作用奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱香大曲来源于贵州茅台镇某酱香型白酒企业车间生产用高温大曲,大曲样品为已经在车间贮存半年且准备用于生产的已经粉碎至20目的曲粉,在混合好的曲粉袋中按上、中、下层分别随机取20个样品,再经过充分混合后,迅速放入无菌保鲜袋中,于4℃冰箱中保存备用。
1.1.2 试剂
细菌基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)提取试剂盒:美国BIOMIGA公司;萘啶酮酸、制霉菌素:上海源叶生物科技有限公司;新生霉素:北京索莱宝科技有限公司;其他试剂均国产分析纯。
1.1.3 培养基
分离培养基采用高氏一号培养基(M1)、国际链霉菌计划(international streptomyces project,ISP)指定的链霉菌固体培养基ISP2(M2)、ISP3培养基(M3)、ISP4培养基(M4)、ISP5培养基(M5)、R2A培养基(M6)、淀粉-甘油培养基(M7)、GYM培养基(M8)、GTY培养基(M9)、HV培养基(M10)。上述培养基均自配,121℃灭菌20 min。
纯化及菌种保藏培养基采用ISP2培养基:酵母提取物4 g,麦芽提取物1 g,葡萄糖4 g及琼脂15 g,用1 L蒸馏水溶解,然后用5 mol/L NaOH溶液调pH值为7.3,121℃灭菌20 min。
液体发酵培养基:葡萄糖10 g、酵母膏4 g、蛋白胨4 g、酵母浸粉4 g、K2HPO44 g、KH2PO42 g、MgSO4·7H2O 0.5 g,用1L蒸馏水溶解,然后用5mol/LNaOH溶液调pH值为7.2~7.4,然后121℃灭菌20 min。
生理生化实验培养基:明胶培养基、淀粉琼脂培养基、硝酸盐液体培养基、纤维素分解培养基。
酶活力测定培养基采用麸皮培养基:称取麸皮15 g,用15 mL蒸馏水搅拌均匀,然后121℃灭菌20 min。
固态发酵产香培养基:将粉碎的高粱与未粉碎的高粱按3∶1(g∶g)进行混合,然后将混合的高粱与粉碎的小麦按1∶1(g∶g)进行混合,加入40%的水混合均匀,润粮24h后用瓶进行分装(50g/瓶),用8层纱布进行封口,121℃灭菌20min。
1.2 仪器与设备
库尔特BECKMAN离心机:美国贝克曼库尔特中国有限公司;Flex cycler多功能PCR仪:德国耶拿分析仪器股份公司;DYCP44P电泳仪:北京欣惠泽奥科技有限公司;ZF25凝胶成像仪:上海方畦仪器有限公司;S3400N扫描电镜:日本日立有限公司;FD-1C-80冷冻干燥机:上海乔跃电子有限公司;HP6890/5975C气质联用仪:美国安捷伦公司。
1.3 方法
1.3.1 筛选方法
(1)样品预处理
干热处理(a1):用灭菌的烧杯称取10 g茅台大曲样品,然后将烧杯封口并置于100℃烘箱中加热1 h;最后将大曲样品放入含有90 mL无菌稀释液并带有玻璃珠的三角瓶中振荡培养30 min备用;
湿热处理(a2):称取10 g茅台大曲样品放入含有90 mL无菌稀释液并带有玻璃珠的三角烧瓶中,在50℃恒温水浴锅中热处理10 min,再振荡培养30 min备用;
先干热后湿热处理(a3):用灭菌的烧杯称取10 g茅台大曲样品,然后将烧杯封口并置于100℃烘箱中加热1 h,再将大曲样品放入含有90 mL无菌稀释液并带有玻璃珠的三角瓶中,在50℃恒温水浴锅中热处理10 min,最后振荡培养30 min备用;
CaCO3富集培养(a4):按照大曲样品与CaCO3为10∶1(g∶g)的比例在无菌烧杯中混合,添加适量无菌水,在湿度为30%、温度为28℃的培养箱中培养7 d,然后放入含有90 mL无菌水并带有玻璃珠的三角烧瓶中振荡培养30 min后备用;
先CaCO3富集培养后再进行湿热处理(a5):在a4处理基础上在振荡培养之前将三角瓶放在50℃恒温水浴锅中热处理10 min,再振荡培养30 min备用。
(2)分离培养基的选择
在28℃条件下,比较5种预处理方法的样品在10种分离培养基上的生长状况。
(3)稀释液的筛选
分别选择无菌生理盐水(质量浓度为9 g/L)及羧甲基纤维素钠(carboxyl methyl cellulose-Na,CMC-Na)水溶液(质量浓度为2.5 g/L)作为稀释液[13]。
(4)抑制剂的添加
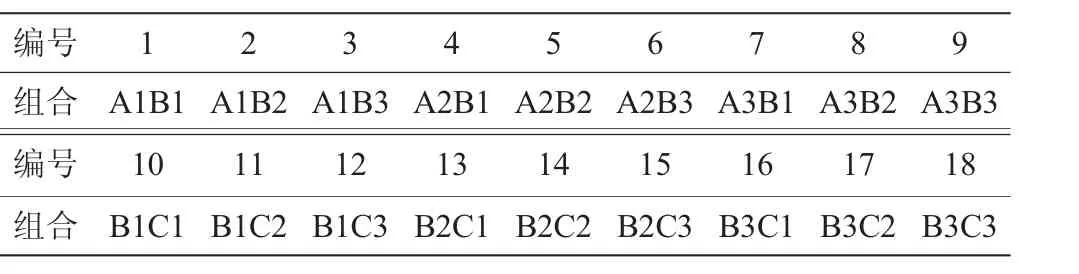
表1 抑制剂的添加组合Table 1 Addition combinations of inhibitors
用0.1 mol/L NaOH溶液将萘啶酮酸配制成质量浓度为50 mg/L(A1)、100 mg/L(A2)及150 mg/L(A3)的溶液;用二甲基亚砜(dimethyl sulfoxide,DMSO)溶液将制霉菌素配制成质量浓度为20 mg/L(B1)、40 mg/L(B2)及60 mg/L(B3)的溶液;用无菌水将新生霉素配制成质量浓度为30 mg/L(C1)、40 mg/L(C2)及50 mg/L(C3)的溶液;用无菌水将重铬酸钾配制成质量浓度为25 mg/L(D1)、50 mg/L(D2)及75 mg/L(D3)的溶液。同时,抑制剂均用0.22 μm的无菌滤膜过滤,然后加入灭菌培养基中混匀,倒入培养皿中[14]。其中,抑制剂的添加组合如表1所示。
(5)分离涂布的方法
称取10 g茅台大曲样品加入含有90 mL无菌稀释液并带有玻璃珠的三角烧瓶中,将三角烧杯置于28℃、200r/min的恒温水浴锅中振荡培养30 min。然后取1 mL上述样品悬浮液进行10倍梯度稀释,分别取0.2 mL各稀释度菌悬液涂布于分离培养基上,将培养基置于28℃培养箱中倒置培养,并进行分离纯化,分离得到的菌株用ISP2培养基斜面培养,并在4℃冰箱中保藏备用。
1.3.2 菌种的鉴定
(1)形态培养特征观察
菌株的培养特征观察参照ISP中有关放线菌的培养特征进行观察[15]。
(2)扫描电镜观察
用液体培养基发酵培养48 h后,离心后弃上清,加入1.5 mL 0.2 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤菌体3次;向菌体沉淀中加入2.5%戊二醛固定液1.5 mL,4℃固定过夜;用体积分数30%、50%、70%、90%的叔丁醇/乙醇混合液进行脱水,每次5 min,再用100%叔丁醇脱水2次,每次5 min;然后冷冻干燥4 h,干燥后的粉末样品镀金膜,用扫描电镜进行观察[16-17]。
(3)生理生化特征鉴定
对放线菌进行明胶液化实验、淀粉水解实验、碳源利用实验、纤维素分解实验、硝酸盐实验及牛奶凝固与胨化实验,并参照《链霉菌鉴定手册》推荐的标准培养基和常用生理生化方法培养、观察和记录[14]。
(4)分子生物学鉴定
采用细菌基因组DNA提取试剂盒提取DNA,以F(5'-CCTACGGGAGGCAGCAG-3')及R(5'-CCGTCAATTCMTTTRAGT-3')为引物进行聚合酶链反应(polymerasechain reaction,PCR)扩增,PCR扩增程序为94℃预变性5 min,然后94℃变性1 min,56℃退火1 min,72℃延伸1.5 min,共30个循环,最后72℃延伸9 min;取2 μLPCR产物用1%琼脂糖凝胶检测DNA提取效果;PCR产物在上海立菲生物工程技术服务有限公司进行测序;将测序数据在美国国家生物技术信息中心(national center of biotechnologyinformation,NCBI)数据库中进行同源序列搜索,用MEGA5.05软件进行多序列比对,然后用邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.3 放线菌粗酶液的制备及酶活力的测定
(1)粗酶液的制备
用接菌环取两环活化的菌株接种到液体发酵培养基中,28℃培养48 h,然后以10%的接种量接种到麸皮培养基中,再28 ℃培养5 d,所得培养物与水按照1∶10(g∶mL)的比例混合搅匀,40℃水浴1 h,每隔15 min搅拌1次,最后进行过滤,所得滤液为粗酶液。
(2)酶活力的测定
糖化型淀粉酶与纤维素酶活力的测定采用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法;酸性蛋白酶活力的测定根据商业行业标准SB/T 10317—1999《蛋白酶活力测定法》中的方法进行测定;脂肪酶活力的测定根据国标GB/T 23535—2009《脂肪酶制剂》中的动态滴定法进行测定;果胶酶活力的测定根据轻工业行业标准QB1502—1992《食品添加剂——果胶酶制剂》中的方法进行测定。
糖化型淀粉酶酶活定义:在40℃、pH4.6条件下,1 h水解淀粉产生1 mg葡萄糖作为一个酶活力单位。纤维素酶酶活定义:50℃条件下,1 min催化纤维素水解成1 μmol葡萄糖的酶量为一个酶活力单位。蛋白酶酶活定义:在40℃下1 min水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位。脂肪酶酶活定义:在40℃,pH7.5条件下,粗酶液1 min水解底物生成1 μmol可滴定的脂肪酸为一个酶活力单位。果胶酶酶活定义:在50℃、pH3.5的条件下,粗酶液1 h分解果胶产生l mg半乳糖醛酸为一个酶活单位。
1.3.4 放线菌固态发酵产物的香气成分测定
放线菌固态发酵产物的香气成分测定采用气质联用法。用接菌环取两环活化的菌株接种到液体发酵培养基中,28℃培养48 h,以10%的接种量接入高粱与小麦固体发酵培养基中,28℃培养7 d。
气相色谱条件:色谱柱为Zebron ZB-5MSI弹性石英毛细管柱(30 cm×0.25 mm×0.25 μm),柱温为40℃,保留时间为2 min,以5℃/min升温至270℃,运行时间为48 min,汽化室温度为250℃,载气为高纯氦气(He)(99.999%),载气流量为1 mL/min,不分流进样,溶剂延迟时间为1 min。
质谱条件:离子源为电子电离(electronic ionization,EI)源,离子源温度为230℃,四极杆温度为150℃,电子能量为70 eV,发射电流为34.6 μA,倍增器电压为1 294 V;接口温度为280℃,质量范围为20~450 amu,用峰面积归一化法测定各化学成分的相对含量。
2 结果与分析
2.1 分离筛选条件的确定
5种预处理方法的样品在10种分离培养基上,28℃条件下培养,培养结果表明在常温条件下先干热处理再湿热处理能够有效抑制分离平板上非目的菌主要是细菌的生长,大大促进分离平板上放线菌的生长。高氏一号培养基(M1)、ISP2培养基(M2)、淀粉-甘油培养基(M7)上均能生长出具有放线菌菌落形态特征的菌落,其余各培养基及各预处理方法均未见任何菌落生长。
2.2 放线菌的鉴定
从酱香大曲中分离纯化出3株具有放线菌菌落形态特征菌株,本实验室保藏编号分别为FBKL4.001、FBKL4.002、FBKL4.003。菌株进行形态学特征、生理生化实验及分子生物学鉴定。
2.2.1 形态学特征
由3株菌单菌落形态及显微镜特征(图1)可知,FBKL4.001菌落形状缺刻状圆形,基内菌丝淡黄色,气生菌丝白色,菌落凸起、干燥致密,无可溶性色素产生;FBKL4.002菌落形状缺刻状圆形,基内菌丝淡灰色,气生菌丝白色,菌落凸起、干燥致密,无可溶性色素产生;FBKL4.003菌落形状椭圆形,基内菌丝淡黄色,气生菌丝白色,菌落中间凸起半干燥,无可溶性色素产生。3株菌在显微镜下的特征结合《伯杰氏细菌鉴定手册》,FBKL4.001、FBKL4.002、FBKL4.003菌丝分散度好,相互交叉重叠,菌丝表面光滑饱满,有明显孢子链[15],FBKL4.001和FBKL4.002的孢子链较为相似。

图1 3株菌株的菌落形态及显微镜特征Fig.1 Colonial morphology and microscope features of 3 strains
2.2.2 生理生化特征
各菌株的生理生化试验结果见表2。
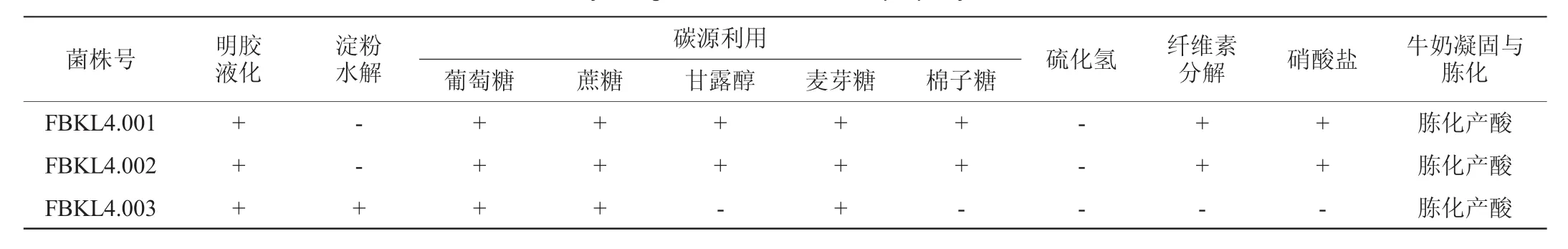
表2 3株菌株的生理生化特征Table 2 Physiological and biochemical property of 3 strains
由表2可知,3株菌株能利用碳源范围较广,能利用葡萄糖、蔗糖、甘露醇、麦芽糖、棉子糖等,FBKL4.003能使淀粉水解,但不能分解纤维素,明胶液化实验中所有菌株使明胶液化,使牛奶胨化产酸。
2.2.3 分子生物学鉴定
以3株菌株基因组DNA为模板进行PCR扩增,其PCR产物的琼脂糖凝胶电泳结果见图2。

图2 3株菌株16S rDNA PCR扩增产物电泳图Fig.2 Electrophoretogram of 16S rDNA PCR amplification products of 3 strains
由图2可知,3株菌株PCR扩增结果在400 bp处出现明显条带。基因序列测定后,测序结果在GenBank数据库中进行同源序列搜索(BLAST search),用MEGA5.05软件进行多序列比对,邻接法构建系统发育树如图3。
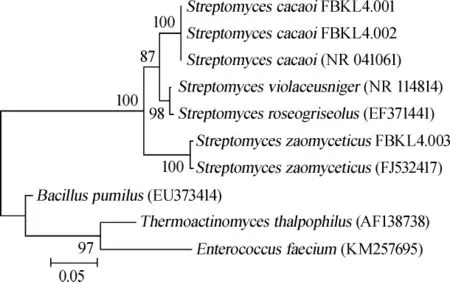
图3 菌株FBKL4.004的16S rDNA基因序列系统发育树Fig.3 Phylogenetic tree of strain FBKL4.004 based on 16S rDNA gene sequence
根据《伯杰氏细菌鉴定手册》、《链霉菌鉴定手册》,结合菌株形态、生理生化特征及分子生物学比对分析,FBKL4.001、FBKL4.002鉴定为可可链霉菌(Streptomyces cacaoi);FBKL4.003为沙阿霉素链霉菌(Streptomyces zaomyceticus)。Streptomyces cacaoi最先是从尼日利亚发霉的可可豆发现的,后来从海洋沉积物中也能分离到,且该菌一些代谢产物可提供有治疗价值的先导化合物,其变种发酵产生多氧霉素B(polyoxin B)[18],抗生素KA08[19-20]。Streptomyces zaomyceticus最先是从日本的沙阿山(Mt.Zao)的土壤中分离到,可产生一种新的双功能酶几丁质酶并应用在壳寡糖抗氧化剂生产中[21-22]。
2.3 放线菌的产酶特性
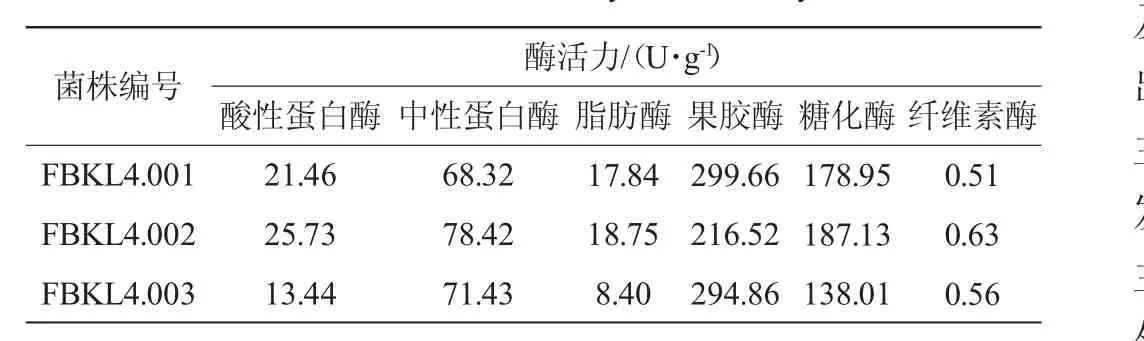
表3 3株菌株酶活力测定结果Table 3 Determination results of enzymatic activity of 3 strains
由表3可看出,各种酶的酶活力差异较大,菌株FBKL4.001、FBKL4.002、FBKL4.003的果胶酶活力均为最高,FBKL4.001和FBKL4.003所产果胶酶均高于酱香大曲细菌所产果胶酶最高酶活(259 U/g)和霉菌所产果胶酶最高酶活(260 U/g)[23],表明放线菌也能产生酶活力水平相对较高的果胶酶;其次是糖化酶活力,但3株菌糖化酶酶活均低于细菌和霉菌所产果胶酶酶活。其中菌株FBKL4003不产脂肪酶,3株菌剩余酶活种类的酶活力相对较弱,其中纤维素酶活力最弱,说明该3株放线菌对纤维素的分解能力比较弱。
2.4 放线菌固态发酵香气成分分析
对从酱香大曲中分离得到的3株放线菌进行了固态发酵,并通过固态微萃取与气相色谱-质谱联用技术对其挥发性成分组成及成分风味进行了测定,结果见图4及表4。从图4及表4可以看出,研究报道从酿造环境、土壤、空气等分离出的放线菌固态发酵挥发性成分分析主要以萜烯类物质为主[10-11],而从大曲中分离得到的菌株FBKL4.001固态发酵挥发性成分组成看出,代谢产物种类丰富,主要以酯类物质为主,占62.80%,其次包括13.86%醇类、6.17%萜烯类物质,此外该菌还能代谢产生5.39%吡嗪类物质。菌株FBKL4.003挥发性成分组成与菌株FBKL4.001相似,主要以酯类物质为主,占46.77%,其次萜烯类物质占23%,也能产生4.49%吡嗪类物质,此外能产生少量酮类、醛类、酚类等代谢产物。

图4 3株菌株固态发酵产物挥发性成分总离子流色谱图Fig.4 Total ions chromatogram of the volatile components of solid-state fermentation products of 3 strains
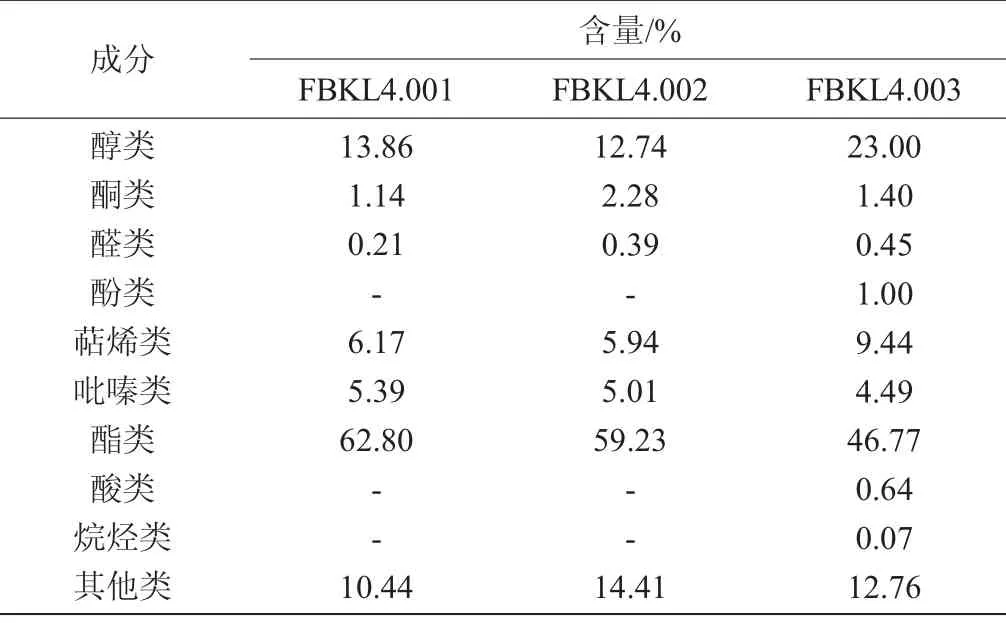
表4 3株菌株挥发性成分组成分析Table 4 Composition analysis of volatile components produced by 3 strains
3 结论
本研究建立了一种有效的分离放线菌的方法,从酱香大曲中分离筛选出3株放线菌,其中FBKL4.001、FBKL4.002为可可链霉菌(Streptomyces cacaoi)、FBKL4.003为沙阿霉素链霉菌(Streptomyces zaomyceticus)。通过对其酶活和固态发酵产物挥发性成分进行探讨,发现放线菌产果胶酶较为突出,分别高达299.66 U/g、216.52 U/g、294.86U/g;同时,通过对其固态发酵挥发性成分进行分析,发现酯类物质含量最高,分别占62.80%、59.23%、46.77%;均能代谢产生吡嗪类物质,此外能产生少量酮类、醛类、酚类等物质。本研究为发现固态发酵更多的微生物资源及其在白酒发酵生产中的作用及应用奠定了基础。
