硫酸二乙酯化学诱变选育高核糖核酸酿酒酵母及培养基组成优化
2018-09-07倪晓丰王东旭彭伟林陈叶福肖冬光郭学武
倪晓丰,赵 宾,王东旭,彭伟林,陈叶福,肖冬光,郭学武*
(1.天津科技大学 生物工程学院 工业发酵微生物重点实验室 天津市工业微生物重点实验室,天津 300457;2.深圳市福田区彩田学校,广东 深圳 518036)
核糖核酸(ribonucleic acid,RNA)简称核酸,是生物体内重要的一类高分子化合物,也是生物体的基本组成成分之一[1]。核酸类物质及其降解产物在遗传工程、医药、食品、农业生产等领域有着广泛的用途[2]。呈味核苷酸(5'-鸟苷酸和5'-肌苷酸)作为鲜味剂与氨基酸按一定比例混合使用时可使氨基酸的鲜味成倍增加[3]。其次,核酸降解产物三磷酸腺苷(adenosine triphosphate,ATP)是一种有效的心肌梗塞抢救药物,也可以用于冠心病的预防[4]。另外,核酸还可以直接作为保健品,能够有效提高机体的免疫力。
核酸的来源较为广泛,其中从酵母中提取RNA最为常见,也是近年来研究的热点。普通酵母菌中RNA含量约为6%~8%,脱氧核糖核酸(deoxyribonucleic acid,DNA)含量不超过0.3%,而高核酸酵母则是指核酸含量为12%~14%的酵母菌[5]。在自然界中,RNA含量高的酵母菌多属于假丝酵母(Candida)[6]。之前关于高核酸酵母菌株的选育多集中在假丝酵母属[7-8]。林忠等[9]通过使用高密度发酵技术发酵解脂假丝酵母(Candida lipolytica),在最适pH和溶氧条件下采用pH-stat补糖分批发酵,最高核酸含量达到14.2%,最高菌体质量浓度达到35.6g/L。普为民等[10]通过紫外-氟尿嘧啶复合诱变筛选到一株产朊假丝酵母(C.utilis),核酸含量达到了14.75%。但是,假丝酵母并不是通常被认为安全(generally recognized as safe,GRAS)的菌株,因此,近年来随着对食品安全性的考虑,越来越多的研究集中在选育高核酸酿酒酵母的工作方面[11-13]。杨依顺等[14]利用酿酒酵母(Saccharomycescerevisiae)的氯化钾敏感性,通过硫酸二乙酯化学诱变,筛选到一株酿酒酵母,RNA含量提高了25%,其RNA含量达到6.05%。俞灿等[15]利用酿酒酵母为出发菌株进行诱变选育,筛选出一株酿酒酵母,RNA含量提高了10.62%,其RNA含量达到8.11%。但是,前面的研究所筛选的酵母的核酸含量仍低于假丝酵母属的酵母的核酸含量,因此,若想实现采用酿酒酵母工业化生产核酸,还需进一步提高酿酒酵母的核酸含量。
在工业化生产中,首先,酵母的培养大多主要利用废糖蜜培养基,因糖蜜含糖量高、且糖蜜自身大部分糖类为酵母可发酵利用的糖类,如蔗糖和还原糖,同时其自身还含有酵母生长所必需的矿物质(钾、氯、钠、镁等)和维生素。其次,糖蜜主要是蔗糖厂生产蔗糖的副产物,产量很高,而且价格低廉,是一种工业生产酵母理想的碳源[3,16-17]。
因此,本研究主要通过对酿酒酵母BY23进行硫酸二乙酯(diethyl sulfate,DES)化学诱变,筛选到一株胞内RNA含量较高的突变株BY23-195。其后,以糖蜜作为碳源,通过单因素及正交试验优化培养基的配方,提高菌株BY23-195胞内的RNA含量。BY23是一株工业化菌株,这在一定程度上为后续工业化生产核酸奠定了理论基础和提供了技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
DES(分析纯):美国Sigma公司;酵母提取物:安琪酵母股份有限公司;蛋白胨:山东玉宝生物科技有限公司;葡萄糖、高氯酸等化学试剂均为国产分析纯。
1.1.2 菌种
酿酒酵母(Saccharomyces cerevisiae)BY23:由天津科技大学生物工程学院现代酿造实验室筛选并保藏;所有突变菌株由天津科技大学生物工程学院现代酿造实验室筛选并保藏。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖2%,蛋白胨2%,酵母粉1%,固体培养基中加入琼脂2%。
糖蜜培养基:糖蜜(糖度调至12°Bx),酵母浸粉0.5%,硫酸铵0.05%。
以上3种培养基,自然pH值,121℃灭菌15 min。
1.2 仪器与设备
Cary8454型紫外-可见分光光度计:美国安捷伦科技有限公司;D-37520型离心冷冻机:Eppendorf中国有限公司;LDZM-60KCS型高压蒸汽灭菌锅:上海申安医疗器械厂;HWS-28型恒温水浴锅:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 化学诱变及高产核酸酿酒酵母的筛选
菌株活化:利用接种环从斜面上挑取一环菌泥接种于装有YEPD培养基的试管中,于30℃、180 r/min条件下培养12 h。
化学诱变:取培养至对数生长中期的S.cerevisiaeBY23菌悬液100 mL于250 mL三角瓶中,分别加入总体积的0、5.0%、7.5%、10.0%、12.5%、15.0%的DES(5%(V/V)),于30℃、180r/min条件下振荡处理30min,取1.0mL处理液迅速加入1.0 mL 25%(V/V)的硫代硫酸钠溶液终止反应。在10-4稀释倍数下,取0.10 mL涂布于YEPD平板上,30℃静置培养,直至有菌落生成。
诱变菌株的筛选:采用平板菌落计数方法计算菌落数,进而计算得出菌株的致死率,考察菌株致死率与DES浓度的关系。致死率计算公式如下:

待菌落长出后,从菌株致死率在80%~90%的平板上挑取生长快、菌落大的单菌落点接于YEPD平板上,并编号。将这些菌株接种于YEPD液体培养基中,30℃、180r/min条件下进行摇瓶发酵4~6 h,测定突变菌株胞内RNA的含量,筛选出RNA含量较高的突变菌株,并对其生产性能进行测定。
1.3.2 最优突变株糖蜜培养基中发酵性能的测定
种子液的制备:利用接种环从斜面上挑取一环菌泥接种于装有YEPD培养基的试管中,于30℃、180 r/min条件下培养12 h。
扩大培养:按2%(V/V)的接种量接种于含有250 mL优化前糖蜜培养基的500 mL锥形瓶中,30℃、180 r/min摇床培养。
发酵性能的测定:每隔1 h取一次样,测定样品的生物量及胞内RNA含量,考察最优突变株在糖蜜培养基中的发酵性能。
1.3.3 单因素优化糖蜜培养基
采用单因素轮换法,以最优突变菌株为试验菌株,对糖蜜培养基成分酵母浸粉含量(0、1%、2%、3%、4%、5%)、磷酸二氢钾含量(0、0.05%、0.10%、0.15%、0.20%、0.25%)、硫酸亚铁含量(0、0.05%、0.10%、0.15%、0.20%、0.25%)、硫酸锌含量(0、0.05%、0.10%、0.15%、0.20%、0.25%)进行优化,测定发酵12 h时菌体胞内RNA的含量,确定培养基中各个成分的最佳浓度。
1.3.4 正交试验优化糖蜜培养基

表1 糖蜜培养基组成优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for optimization of molasses medium components
根据单因素优化试验结果,以胞内RNA含量(Y)为评价指标,选取酵母浸粉含量(A)、磷酸二氢钾含量(B)、硫酸亚铁含量(C)、硫酸锌含量(D)4个因素,进行4因素3水平的正交优化试验,确定糖蜜培养基的最优配方。正交试验因素与水平见表1。
1.3.5 RNA含量的测定[19]
菌株的培养:菌种过夜活化,以2%的接种量接至装有100mLYEPD培养基的250mL三角瓶中,在30℃、180r/min的条件下培养。
干质量的测定:培养2h后,每隔2h取一次样,以稀释同样倍数的新鲜培养基作空白对照,测定OD600nm值。另取3份20 mL菌液离心去上清,在7 000 r/min条件下离心收集菌体,经无菌去离子水重新悬浮,洗涤2次后,于70℃条件下恒温干燥至恒质量,测定细胞干质量。得到对数期样品的干质量(y)与对应OD600nm值(x)的回归方程:
y=0.382x+0.832,R2=0.9937。
RNA含量的测定:移取在30℃、180r/min的条件下发酵4 h的发酵液10 mL,在波长600 nm处测定吸光度值。10 mL发酵液以5 000 r/min离心10 min,无菌水洗涤两次,并收集菌体。菌体以5 mL 0.5 mol/L高氯酸溶液重悬,70℃水浴20 min,离心,收集上清液。吸取1 mL上清液定容至50 mL,测量上清液在波长260 nm处的吸光度值,计算胞内总RNA含量(%),计算公式如下:
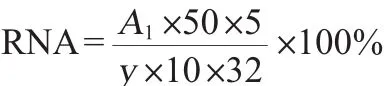
式中:A1为A260nm吸光度值;y为酵母干质量;32为单位光吸收值;50为稀释倍数;5为高氯酸体积,mL;10为发酵液体积,mL。
2 结果与分析
2.1 DES化学诱变及高产核酸酿酒酵母的筛选
菌落培养3d后,菌体致死率与DES添加量关系见图1A。由图1A可知,5%(V/V)DES添加量为7.5%,处理30 min时,致死率接近100%。首先,从致死率在80%~90%范围的平板上(DES添加量为5%)挑取生长性能良好的菌株9株,编号分别为:BY23-16、BY23-190、BY23-191、BY23-193、BY23-195、BY23-198、BY23-199、BY23-200、BY23-201,然后测定突变菌株胞内RNA的含量,测定结果见图1B。由图1B可知,在所挑取的9株突变菌株中,突变株BY23-195的RNA含量最高,为19.56%(P<0.01),与出发菌株BY23的核酸含量(16.46%)相比,提高了18.85%。最后,对出发菌株BY-23以及突变株BY23-195的生长性能进行测定,结果见图1C。由图1C可知,突变株BY23-195的生长性能并未受到影响,且生物量大于出发菌株BY23,所以选取突变株BY23-195为高产RNA的菌株。
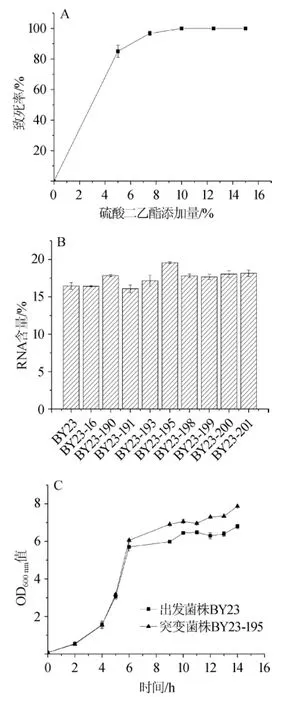
图1 出发菌株BY23的致死曲线(A)、突变株的RNA含量(B)及出发菌株BY23与突变株BY23-195的生长性能比较(C)Fig.1 Results of the lethal curve of original strain BY23(A),RNA contents of mutant strain(B)and comparison of growth performance between mutant strain BY23-195 and original strain BY23(C)
2.2 糖蜜培养基中突变株BY23-195发酵性能的测定
突变株BY23-195在糖蜜培养基中的发酵性能的测定结果见图2。
由图2可知,突变株BY23-195在延滞期(0~4 h),菌体生物量变化不大,其OD600nm值从0.18到0.60,RNA含量从1.38%增加至2.62%,说明这段时间细胞生长缓慢。在对数期(5~11 h),菌体生物量直线上升,其OD600nm值从1.09到13.48,RNA含量从7.31%增加至9.84%,说明菌株在对数期生长迅速,并且大量合成RNA。其次,在发酵8 h时,菌株RNA含量达到最大,为12.68%。在稳定期(12h之后),菌株生物量达到最大,其OD600nm值达到了14.00,且基本保持不变,其RNA含量也趋于平稳,基本保持在9.00%~10.00%。

图2 突变株BY23-195在糖蜜培养基中发酵过程中的生长曲线(A)及RNA的含量(B)Fig.2 Growth curve(A)and RNA contents(B)of mutant strain BY23-195 in the molasses medium during fermentation process
2.3 糖蜜培养基配方优化单因素试验
2.3.1 酵母浸粉含量的优化

图3 不同酵母浸粉含量对突变株BY23-195胞内RNA含量的影响Fig.3 Effects of different yeast extract concentration on intracellular RNA contents of mutant strain BY23-195
由图3可知,酵母浸粉含量在0~4%时,酵母胞内RNA含量随酵母浸粉含量的增加而提高,由6.33%提高至13.18%;当酵母浸粉含量为4%时,RNA含量达到最大,为13.28%,所以酵母浸粉在本试验中的最佳含量为4%。
2.3.2 磷酸二氢钾含量的优化
由图4可知,磷酸二氢钾含量在0~0.10%时,突变株BY23-195胞内RNA含量随磷酸二氢钾含量的增加而提高,从13.28%提高至14.13%;当磷酸二氢钾含量为0.10%时,RNA含量达到最大,达到了14.13%;当磷酸二氢钾含量>0.10%之后,RNA含量开始下降,所以磷酸二氢钾在本试验中的最佳含量为0.10%。

图4 不同磷酸二氢钾含量对突变株BY23-195胞内RNA含量的影响Fig.4 Effects of different KH2PO4concentration on intracellular RNA contents of mutant strain BY23-195
2.3.3 硫酸亚铁含量优化
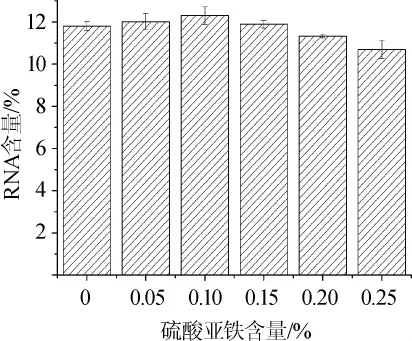
图5 不同硫酸亚铁含量对突变株BY23-195胞内RNA含量的影响Fig.5 Effects of different FeSO4concentration on intracellular RNA contents of mutant strain BY23-195
由图5可知,硫酸亚铁含量在0~0.10%时,突变株BY23-195胞内RNA含量随硫酸亚铁含量的增加而提高,从11.30%提高至12.31%;当硫酸亚铁含量为0.10%时,RNA含量达到最大,为12.31%;在硫酸亚铁含量>0.10%之后,RNA含量开始下降,由12.31%下降为10.69%,所以硫酸亚铁在本试验中的最佳含量为0.10%。
2.3.4 硫酸锌含量优化
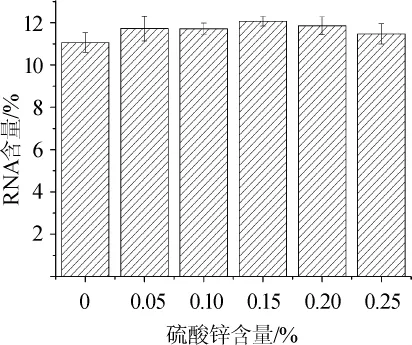
图6 不同硫酸锌含量对突变株BY23-195胞内RNA含量的影响Fig.6 Effects of different ZnSO4concentration on intracellular RNA contents of mutant strain BY23-195
由图6可知,硫酸锌含量在0~0.15%时,突变株BY23-195胞内RNA含量随硫酸锌含量的增加而提高,从11.06%提高至12.07%;当硫酸锌含量为0.10%时,RNA含量达到最大,为12.07%;当硫酸锌含量>0.15%之后,RNA含量开始下降,由12.07%下降为11.47%,所以硫酸锌在本试验中的最佳含量为0.15%。
2.4 糖蜜培养基配方优化正交试验
根据单因素优化试验结果,以突变株BY23-195胞内RNA含量(Y)为评价指标,选取酵母浸粉含量(Y)、磷酸二氢钾含量(B)、硫酸亚铁含量(C)、硫酸锌含量(D)为评价因素,进行4因素3水平的正交优化试验,正交试验结果分析见表2。

表2 糖蜜培养基组成优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for optimization of molasses medium components
由表2的极差分析可知,影响突变株BY23-195胞内RNA含量的4个因素的主次顺序为C>A>D>B,即硫酸亚铁含量>酵母浸粉含量>硫酸锌含量>磷酸二氢钾含量。最优培养基组合为A3B1C1D1,即酵母浸粉含量5%、磷酸二氢钾含量0.05%、硫酸亚铁含量0.05%、硫酸锌含量0.10%。为了进一步验证最适发酵培养基,分别对优化前培养基和A3B1C1D1进行复测,优化后突变株BY23-195胞内RNA的含量为16.01%,与未优化之前的13.66%相比,RNA含量提高了17.20%。因此,最优培养基为糖蜜(糖度调至12°Bx),酵母浸粉5%,硫酸铵0.05%,磷酸二氢钾0.05%,硫酸亚铁0.05%,硫酸锌0.10%。
3 结论
本研究以一株S.cerevisiaeBY23为出发菌株,通过DES化学诱变筛选得到了一株胞内RNA含量较高的突变株BY23-195,其在YEPD液体培养基中培养4 h,胞内RNA含量为19.56%,与出发菌株相比提高了18.85%。其次,通过单因素以及正交试验优化得到最优糖蜜培养基配方为糖蜜(糖度调至12°Bx),酵母浸粉5%,硫酸铵0.05%,磷酸二氢钾0.05%,硫酸亚铁0.05%,硫酸锌0.10%。在此优化条件下,突变株S.cerevisiaeBY23-195胞内的RNA含量为16.01%,较优化前提高了17.20%。
