液相色谱-串联质谱法同时测定8种花草茶中77种农药残留
2018-09-05蓝梦哲刘雅琼王海鸣曹小彦
蓝梦哲, 林 绪, 刘雅琼, 王海鸣, 曹小彦
(广州广电计量检测股份有限公司, 广东 广州 510000)
所谓花草茶,是以花卉植物的花蕾、花瓣为材料,经过采收、干燥、加工后制作而成的保健饮品。冲泡花草茶已成为一种流行趋势,在现代都市里特别受到女性消费群体的青睐。人们越来越关注花草茶的搭配方法和保健功效,同时花草茶的农药残留问题也日益受到人们的关注。
国内关于花草茶的检测方法主要参照NY/T 761-2008标准,该方法适用于蔬菜水果农药残留的测定[1]。对于花草茶而言,其前处理方式缺乏针对性,无法有效消除基质干扰。农药残留的分析方法主要有气相色谱法(GC)[2-7]、高效液相色谱法(HPLC)[8]、气相色谱-质谱法(GC-MS)[9]和液相色谱-串联质谱法(LC-MS/MS)[10-18]等。主要的前处理方法有液液分配萃取结合填充柱净化、固相萃取(SPE)和QuEChER净化等。液液分配萃取法需要消耗大量溶剂;填充柱净化耗时耗力,步骤繁琐,不适于大批量样品的分析;SPE净化过程复杂且价格偏高。
QuEChERS是由美国农业部农业研究服务中心开发的一种快速简便、价格低廉、环境友好的预处理方法,是实验室大规模样品处理的理想方法,有较高的实际应用价值。花草茶含有的成分较多,如多糖类、脂质、生物碱和多酚类化合物等[19-23],对多组分农药残留的测定干扰较大,样品的萃取净化和农残目标物的富集是实现准确分析的前提。目前以QuEChERS为样品前处理方法,HPLC-MS/MS为检测方法进行多种类花草茶和多种类农药多残留测定的文献报道较少。
本文建立了液相色谱-串联质谱检测花草茶中77种农药残留的方法,该法能够快速、准确地同时分离测定花草茶中77种农药,并已用于实际样品检测。
1 实验部分
1.1 仪器、试剂与材料
Nexera X2液相色谱仪(日本岛津公司); Triple Quad 4500串联质谱仪(配电喷雾离子源)、Analyst Software仪器控制及数据处理软件(美国AB Sciex公司)。
77种农药标准品(纯度≥99%)均购于德国Dr. Ehrenstorfer公司;甲醇和乙腈(色谱纯)、乙酸(优级纯)、乙酸铵、N-丙基乙二胺(PSA)、十八烷基硅烷键合硅胶(C18)、石墨化炭黑(GCB)和无水硫酸镁(分析纯)均购于德国CNW公司。无水硫酸镁用前于650 ℃灼烧4 h。
花草茶:玫瑰花、茉莉花、桂花、木棉花、洛神花、鸡蛋花、金银花、菊花等均为干制花草茶,粉碎研磨,过20目筛,备用。
1.2 标准溶液的配制
准确称取各农药标准品10 mg(精确至0.1 mg),置于10 mL容量瓶中,以乙腈定容,配制成1 000 mg/L的标准储备液;用乙腈稀释标准储备液,配制成10 mg/L的标准中间液,于-18 ℃储存;用乙腈将标准中间液配制成各浓度的混合标准工作液,于4 ℃储存。
1.3 样品前处理
准确称取花草茶样品约2 g,置于50 mL聚乙烯离心管中,用5 mL超纯水浸泡30 min,加入20 mL 1%(v/v)乙酸乙腈、1 g乙酸铵、4 g无水硫酸镁(若5 mL超纯水不足以浸泡2 g花草茶样品,则每加入5 mL超纯水就加入4 g无水硫酸镁)和2 g氯化钠,涡旋提取,以4 000 r/min离心5 min。取10 mL提取液,加入0.5 g C18、0.5 g PSA、0.05 g GCB和100 μL甲苯,涡旋振荡,以6 000 r/min离心5 min,取1 mL上清液过0.22 μm微孔滤膜,待测进样分析。
1.4 HPLC-MS/MS条件
色谱柱:Venusil MP C18色谱柱(100 mm×2.1 mm, 3 μm);柱温:40 ℃;进样量:10 μL;流速:0.3 mL/min;流动相:(A)0.1%(v/v)甲酸水溶液和(B)乙腈。梯度洗脱条件:0~5.00 min, 10%B~90%B; 5.00~8.00 min, 90%B; 8.00~8.01 min, 90%B~10%B; 8.01~11.00 min, 10%B。
离子源:电喷雾电离(ESI)源;扫描方式:正离子、负离子交替扫描;检测方式:MRM模式;气帘气流速:30 L/min;雾化气流速(GS1): 50 L/min;辅助加热气流速(GS2): 50 L/min;碰撞气(CAD):中等强度(medium);辅助加热气温度:500 ℃;喷雾电压:5 000 V(ESI+)/-4 500 V(ESI-)。77种农药的定性离子对、定量离子对、碰撞能量、去簇电压、碰撞室入口电压和碰撞室出口电压见表1。
2 结果与讨论
2.1 质谱条件的优化
质谱条件的优化主要包括选择各化合物的母离子、子离子、去簇电压、碰撞能量等。取20 μg/L的农药混合标准溶液,用针泵进样的方式,首先进行母离子扫描(Q1 scan),获取待测物的母离子,然后通过子离子扫描获取其碎片离子,最后在MRM模式下优化各质谱参数,优化结果见表1。加标玫瑰花花草茶中化学成分较复杂,直接用有机溶剂提取会产生严重的基质效应,不利于检测。干制过的花草茶,其含水量小于10%,不利于目标化合物的提取。因此,在加入有机溶剂前,需要加入适量的水浸泡,以改善提取效果。此外,研究表明,乙酸铵的加入能够防止对酸碱性敏感的有机磷酸酯类和氨基甲酸酯类农药的降解[24-26]。因此,实验比较了采用不同提取剂(乙腈、1%(v/v)乙酸乙腈、乙腈+1 g乙酸铵,1%(v/v)乙酸乙腈+1 g乙酸铵)提取时加标玫瑰花样品(40 μg/kg)中77种农药的加标回收率(见图2)。由图2可知,1%(v/v)乙酸乙腈+1 g乙酸铵作为提取剂时,玫瑰花中77种农药的加标回收率在70%~120%的农药有59种,基本满足要求,因此以此选为所用。

表 1 77种农药的保留时间和质谱参数
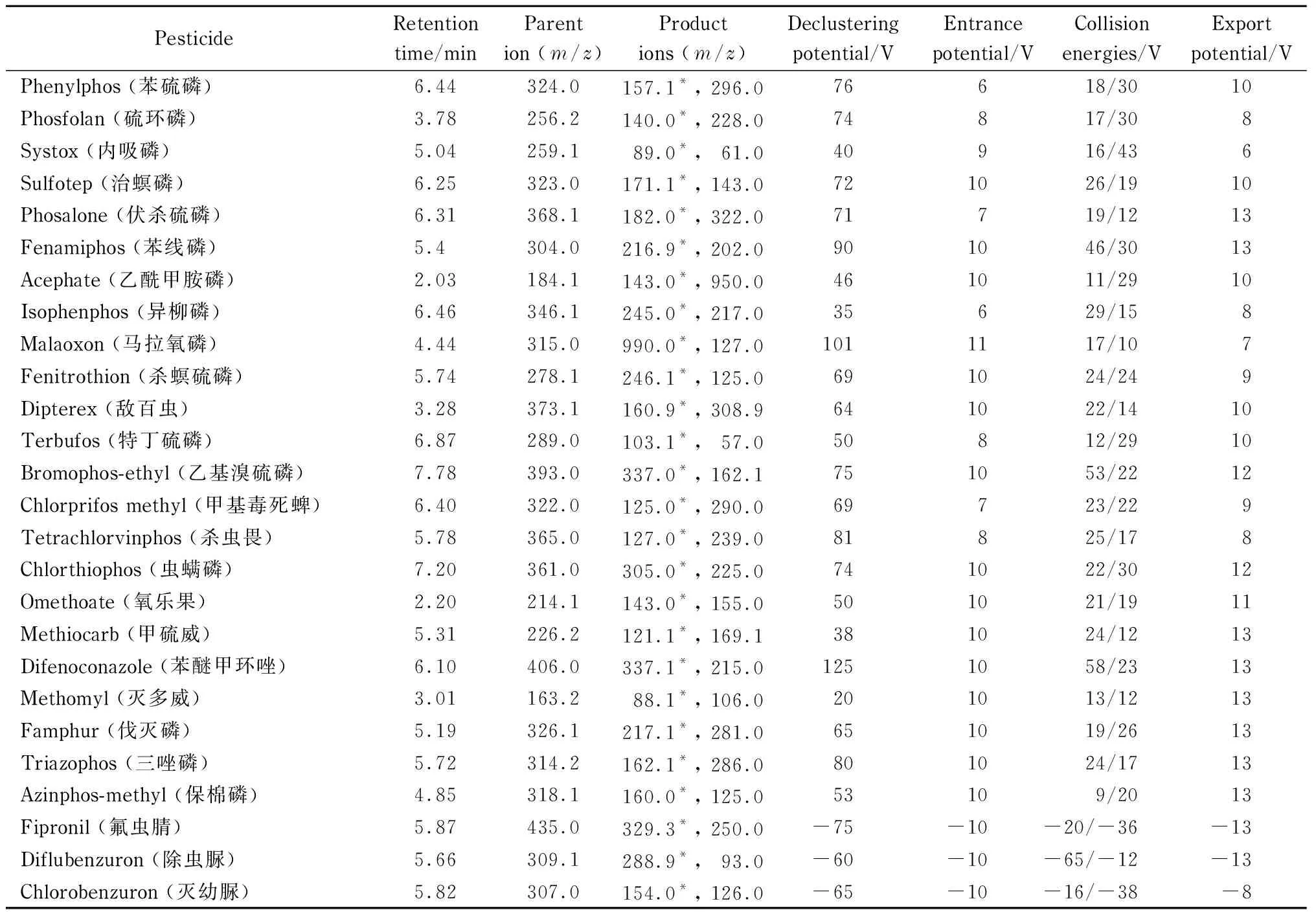
表 1 (续)
* Quantitative ion.
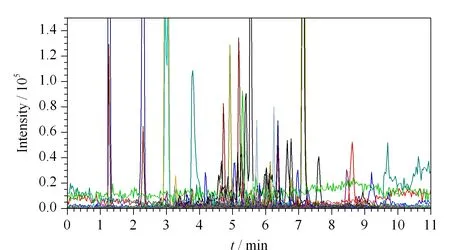
图 1 加标玫瑰花样品(40 μg/kg)中77种农药的 总离子流色谱图Fig. 1 Total ion chromatogram of the 77 pesticides in a spiked rose sample (40 μg/kg)
样品(40 μg/kg)中77种农药的总离子流色谱图见图1。
2.2 QuEChERS方法的优化
2.2.1提取剂的选择
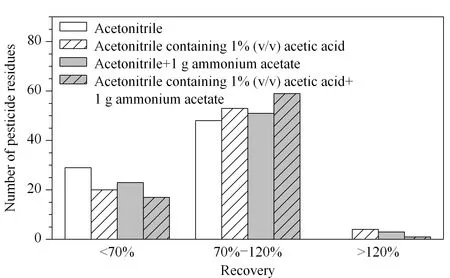
图 2 采用不同提取溶剂时玫瑰花中77种农药的回收率分布Fig. 2 Recovery distribution of the 77 pesticides in rose by different extraction solvent
2.2.2吸附剂和吸附剂用量的选择
QuEChERS方法是通过基质分散固相萃取(MSPD)实现样品的净化。PSA填料可有效去除脂肪酸和有机酸,主要检测的化合物以氨基甲酸酯类农药为主[27-29];C18对非极性组分具有吸附作用,且能有效去除低极性杂质和高级脂肪酸酯类等大分子基质干扰物;C18和PSA混合使用能有效去除强极性至弱极性的基质干扰物[30]。GCB由于其特殊的六边形表面结构,使其对含苯环的有机物吸附能力较强,能有效分离化合物并去除大多数色素[31]。花草茶含有脂肪酸、糖分、黄酮类、色素、类酯体和极性物质等多种复杂化合物质[32],采用单一吸附剂的净化效果不明显,因此本实验同时使用3种不同含量的PSA、C18和GCB吸附剂净化样品。
当玫瑰花中农药加标量为40 μg/kg时,分别比较单独使用不同用量的GCB(0.05、0.1和0.5 g)、PSA(0.1、0.5和1.0 g)和C18 (0.1、0.5和1.0 g)对目标化合物回收率的影响(见图3)。当GCB、PSA、C18的添加量分别为0.05 g、0.5 g、0.5 g时,回收率在70%~120%之间的农药最多,为70种,约占90%。

图 3 采用不同吸附剂时玫瑰花中77种农药的回收率分布Fig. 3 Recovery distribution of the 77 pesticides in rose by different contents of adsorbents GCB: graphitized carbon black; PSA: primary secondary amine.

图 4 加标玫瑰花样品(40 μg/kg)MSPD前后 77种农药的回收率分布Fig. 4 Recovery distribution of the 77 pesticides in spiked rose samples (40 μg/kg) before and after MSPD MSPD: matrix solid-phase dispersion.
实验比较了同时采用0.05 g GCB、0.5 g PSA和0.5 g C18萃取前后,玫瑰花中77种农药的回收率。由图4可知,分散萃取净化前,回收率在70%~120%之间的农药仅有59种;净化萃取后,回收率在70%~120%之间的农药有70种。因此,同时采用0.05 g GCB、0.5 g PSA和0.5 g C18对花草茶样品进行净化萃取。
3种吸附剂可以导致萃取过程中具有平面结构的农药被吸附,有文献[33]表明添加100 μL甲苯可以提高萃取效率。为了研究甲苯对于具有平面结构的农药的提取效率的影响,比较了添加和不添加甲苯时时加标玫瑰花样品(40 μg/kg)的萃取效果。结果表明,萃取液中加入100 μL甲苯后,有10种平面结构的农药化合物,如多菌灵、特丁硫磷等,回收率均有所提高。
2.3 基质效应
基质效应是指样品中除了待测目标物外样品基质中的一些共同提取物对测定待测物含量准确度的影响。基质效应主要源自色谱分离过程中与被测物共流出的物质对被测物离子化过程的影响。基质效应是在农药残留检测时,分析复杂样品基质需要考虑的重要问题之一。和气相色谱-质谱联用法不同,液相色谱-串联质谱法的基质效应以抑制效应为主。因此,为降低离子抑制效应对定量测定的影响,需要用花草茶空白样品提取液配制系列基质标准工作液,绘制标准曲线进行定量。
2.4 线性范围、定量限、回收率和精密度
按1.3节方法对空白玫瑰花样品进行前处理,配制系列不同质量浓度(1、5、10、20、50、100和200 μg/L)的基质混合标准工作液,在1.4节条件下对77种农药进行分析测定。以农药的色谱峰面积对各目标化合物的质量浓度进行线性回归。结果表明,77种农药在0.5~100 μg/L范围内线性关系良好,相关系数均大于0.995。以3倍信噪比(S/N=3)对应的含量作为方法的检出限(LOD),为1.0~10.0 μg/kg。
按1.3节描述对空白玫瑰花样品进行前处理,并分别加入低、中、高(10、40、80 μg/kg)3个水平的混合标准溶液进行加标回收率实验(n=3)。结果表明,玫瑰花样品中77种农药的平均加标回收率为70.3%~110.0%,RSD为2.6%~9.8%(见表2)。
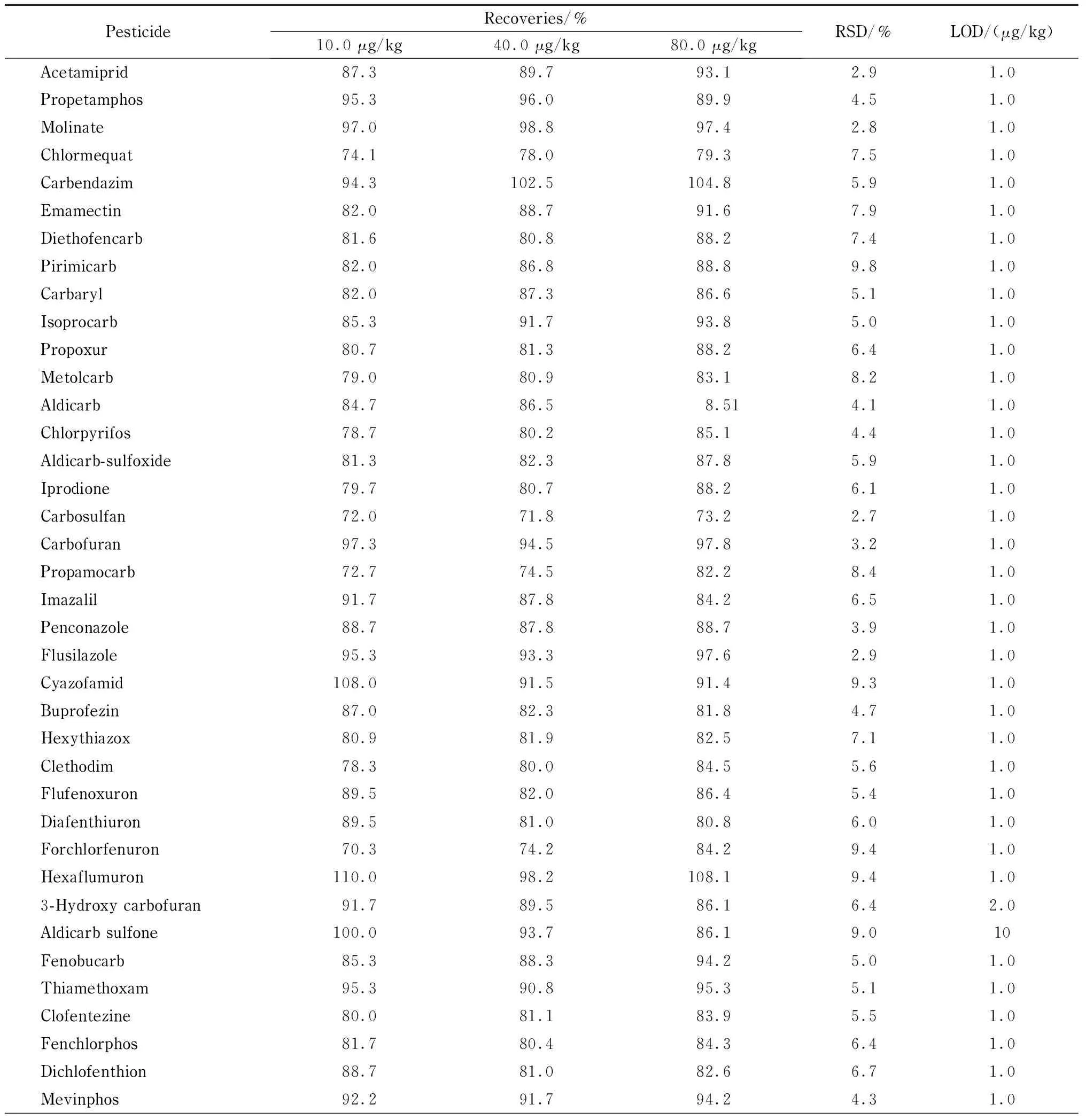
表 2 玫瑰花中77种农药的加标回收率、相对标准偏差和检出限(n=3)

表 2 (续)
2.5 实际样品分析
随机购买市售玫瑰花、茉莉花、桂花、菊花、洛神花、木棉花、鸡蛋花、金银花8种花草茶,共30份样品,应用所建立的分析方法进行农药残留含量测定。结果表明,氧乐果检出4份,含量为10.4~22.9 μg/kg;倍硫磷检出2份,含量分别为8.2 μg/kg和4.9 μg/kg;多菌灵检出4份,含量分别为3.9~19.7 μg/kg。同时对上述8种花草茶样品进行40 μg/kg水平的加标回收试验,77种农药的回收率为70.3%~110.0%,精密度为1.9%~9.4%(n=6)。
3 结论
本文建立了QuEChERS-HPLC-MS/MS测定花草茶中77种农药残留的方法,该法简便快速,使用溶剂少,灵敏可靠,有较强的针对性和适应性。该法提高了实验室的检测速率和检测通量,为花草茶中多种药物残留的例行检测、风险评估等提供了高效可靠的分析手段。
