气相色谱-串联质谱法测定水果中50种农药残留
2018-09-05孟志娟黄云霞赵丽敏孙文毅范素芳潘灿平
孟志娟, 黄云霞, 赵丽敏, 孙文毅, 范素芳*, 李 强*, 潘灿平
(1. 河北省食品检验研究院, 河北省食品安全重点实验室, 河北 石家庄 050091; 2. 中国农业大学理学院, 北京 100193)
食品安全问题是当今世界面临的重大问题,而农药残留是影响食品安全的重要因素之一。目前全球已注册的农药超过2 000余种,其中常用的约500种。农药的施用在保障农业生产的同时也对生态环境造成一定程度的污染,特别是农药的滥用在破坏环境的同时也威胁到人类健康。为保护消费安全,各国家和地区都制定了农药最大残留限量标准。因此,为控制农药残留、保证食用者安全和避免贸易争端,发展快速、可靠、灵敏和实用的农药残留分析技术,建立快速筛查农药残留的方法显得尤为重要[1-5]。
农药残留分析是一项复杂的痕量分析技术,而传统的提取净化技术已远远满足不了现代农药残留分析的要求,更快速、高效的前处理技术随之产生。QuEChERS方法由2003年美国农业部率先提出,美国食品药品监督管理局(FDA)和欧盟共同参与开发的一种对水果、蔬菜中多农药残留提取和净化的方法,采用硫酸镁盐析分层和分散固相萃取净化。随后,美国官方分析化学师协会认证的方法(AOAC 2007.01)引用了乙酸缓冲盐提取体系[6];欧洲标准化委员会认证的欧盟标准方法(EN 15662-2008),采用柠檬酸缓冲盐提取体系[7],以上方法均是在QuEChERS的基础上发展起来的。目前QuEChERS方法已用于枸杞、生菜、橙子等水果和蔬菜中200多种农药残留的检测[8,9]。
为了提高检测效率和回收率,国内外研究者对QuEChERS方法开展了多种改进研究,如向提取溶剂中加入缓冲盐、选择合适的提取溶剂和新型的净化材料等[10-13]。Tomasini等[14]采用改良的QuEChERS方法对蜂蜜中的8种杀虫剂残留进行同时测定,实验中加入氨水调节pH值,使体系呈弱碱性,回收率为86.7%~107%, RSD<20%;金芬等[15]同时测定了水果中19种酸性农药,结果证明采用乙酸-乙腈(1∶99, v/v)提取多农药残留效果最好,可以显著改善不稳定农药的回收率。Zhao等[16]用多壁碳纳米管材料(MWCNTs)替代乙二胺-N-丙基硅烷(PSA)作为净化剂,测定蔬菜和水果中30种农药残留,结果显示回收率在71%~110%之间,RSD<15%。
SinChERS-Nano分散基质固相萃取柱是基于QuEChERS开发的一种新型快速样品前处理的净化柱。通过优化的柱体结构与改良的多壁碳纳米材料相结合,可以避免样品净化过程中溶剂转移所造成的损失,同时去除基质中的干扰成分,大大节省了样品制备时间。目前关于SinChERS-Nano柱结合气相色谱-串联质谱(GC-MS/MS)的相关研究尚未见报道。本实验建立了SinChERS-Nano柱净化结合GC-MS/MS检测水果中常见的50种农药残留的分析方法,能够对水果中多农药残留进行筛查分析。
1 实验部分
1.1 仪器、试剂与材料
TSQTM8000气相色谱-三重四极杆质谱联用仪(美国Thermo公司); DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm,美国Agilent公司); 3K15型高速冷冻离心机(德国Sigma公司); 0.22 μm微孔滤膜(天津艾杰尔公司)。
乙腈(色谱纯,德国Merck公司); QuEChERS净化离心管,包括100.0 mg PSA和50.0 mg MgSO4(美国Thermo公司); SinChERS-Nano柱,包括2 g NaSO4、0.6 g MgSO4、90 mg PSA和15 mg MWCNTs(北京绿绵科技有限公司);普通盐包(无缓冲盐),包括4 g MgSO4和1 g NaCl(美国Thermo公司);乙酸缓冲盐体系盐包,包括6 g MgSO4和1.5 g醋酸钠(北京绿绵科技有限公司);柠檬酸缓冲盐体系盐包,包括4 g MgSO4、1 g NaCl、1 g柠檬酸钠和0.5 g柠檬酸氢二钠(北京绿绵科技有限公司)。
50种农药标准品及内标环氧七氯均购自农业部环境保护科研监测所(质量浓度均为100 mg/L)。用乙腈配制10 mg/L的农药混合标准溶液和10 mg/L内标环氧七氯标准溶液,置于-18 ℃储存。
实验用柑橘、葡萄、苹果、梨、草莓、猕猴桃、樱桃、枣、桃、杏均购于当地超市。
1.2 样品前处理
1.2.1提取
方式一:分别称取已匀浆的柑橘和葡萄样品10.0 g(精确到0.001g),置于50 mL塑料离心管中,加入10 mL乙腈,涡旋1 min,加入普通盐包,涡旋1 min,以9 000 r/min离心5 min。
方式二:分别称取已匀浆的柑橘和葡萄样品15.0 g(精确到0.001 g),置于50 mL塑料离心管中,加入15 mL乙腈,涡旋1 min,加入乙酸缓冲盐体系盐包,涡旋1 min,以9 000 r/min离心5 min。
方式三:除加入柠檬酸缓冲盐体系盐包外,其他操作同方式一。
1.2.2净化
PSA净化:移取2 mL提取上清液至QuEChERS净化离心管中,振荡混合1 min,以9 000 r/min离心3 min,吸取上清液,过0.22 μm滤膜,待GC-MS/MS分析。
SinChERS-Nano柱净化:取SinChERS-Nano柱,置于盛有提取液的50 mL离心管内,缓慢下压至刻度处(储液池内净化液4 mL),用注射器吸取上清液,过0.22 μm滤膜,待GC-MS/MS分析。
按照上述提取、净化步骤制得柑橘和葡萄空白提取液。
1.3 标准溶液的配制
将10 mg/L 50种农药混合标准溶液用柑橘和葡萄的空白提取液稀释,配制成0.1 mg/L和2 mg/L的基质标准溶液;用柑橘和葡萄的空白提取液配制质量浓度分别为0.005、0.02、0.05、0.1和0.2 mg/L的系列混合基质标准溶液,现用现配。
1.4 分析条件
1.4.1色谱条件
Agilent HP-5MS色谱柱(30 m×0.25 mm×0.25 μm);进样口温度:250 ℃;升温程序:初始温度80 ℃,保持1 min,以30 ℃/min升温至150 ℃,再以3 ℃/min升温至210 ℃,最后以10 ℃/min升温至290 ℃,保持20 min;载气:氮气(纯度≥99.999%),流速:1.0 mL/min;进样方式:不分流进样,进样体积:1 μL。
1.4.2质谱条件
离子源:EI源;离子源温度:280 ℃;传输线温度:300 ℃;电子能量:70 eV。采用AutoSRM软件对质谱参数进行分析。50种农药的质谱参数见表1。
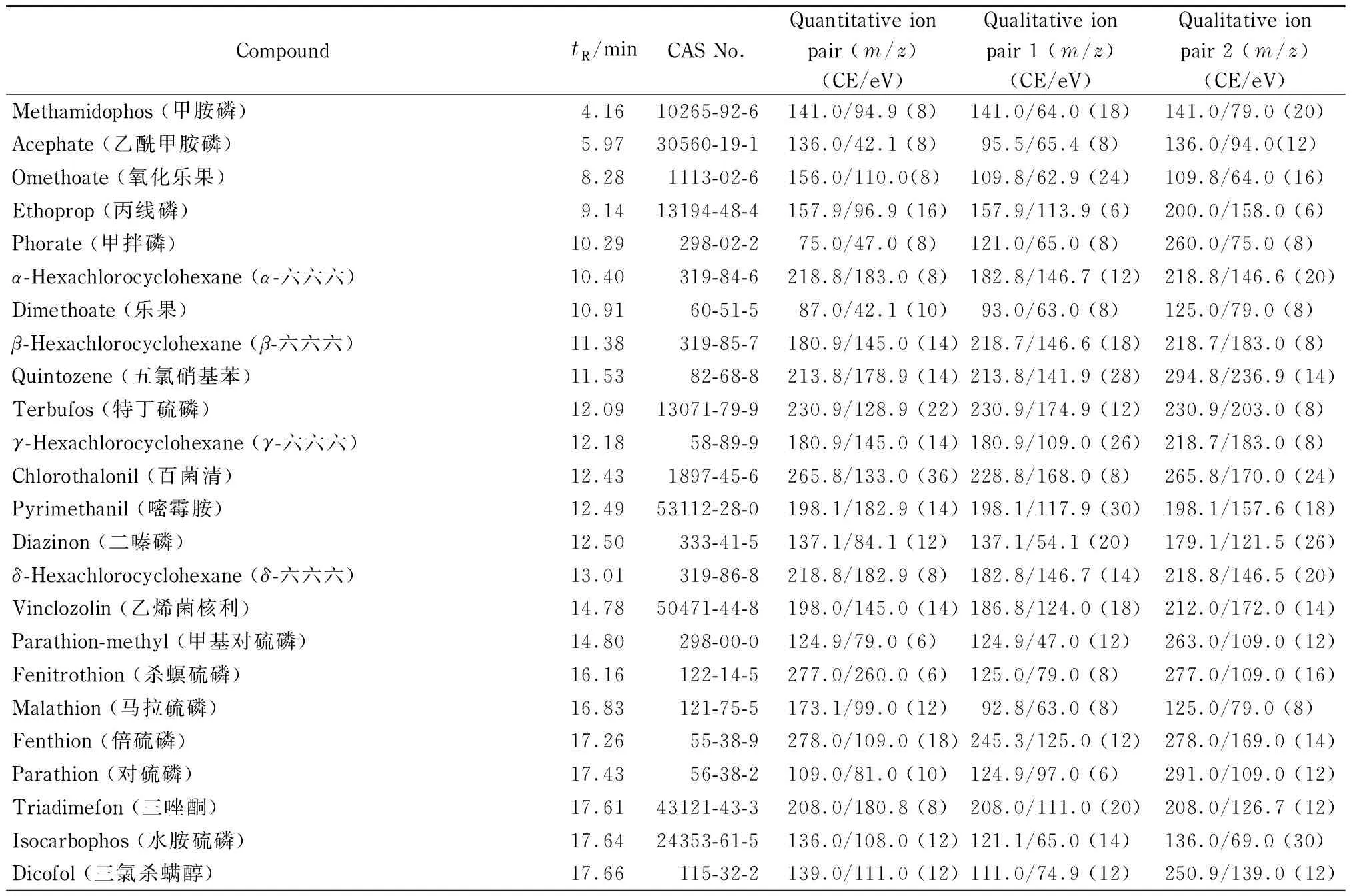
表 1 50种农药的保留时间及质谱参数
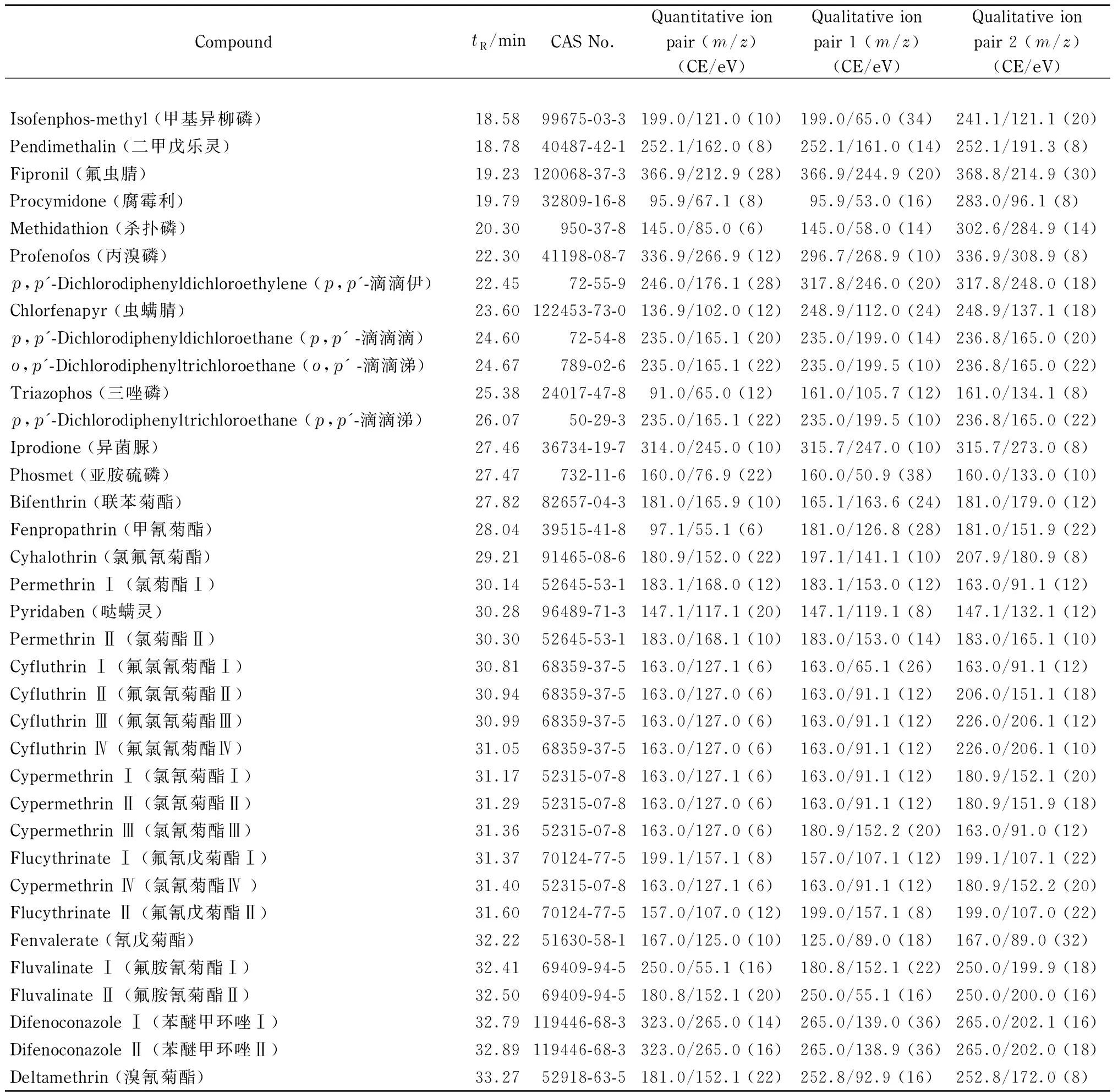
表 1 (续)
CE: collision energy.
2 结果与讨论
2.1 提取方式的选择
本实验选择柑橘和葡萄基质,采用PSA净化,考察了普通盐包、乙酸缓冲盐体系盐包和柠檬酸缓冲盐体系盐包对提取效果的影响。分别在10、50和150 μg/kg 3个添加水平下进行加标回收试验,每个添加水平重复测定6次。样品在提取过程中,基质pH值会影响某些农药的回收率。柑橘和葡萄都属于酸性基质,对酸敏感的农药回收率较低。通过对农药回收率的研究,发现甲胺磷、乙酰甲胺磷、氧化乐果、三氯杀螨醇、百菌清5种农药,采用普通盐包提取时,回收率为54%~132%,相对标准偏差为10%~30%;采用乙酸缓冲盐体系盐包和柠檬酸缓冲盐体系盐包时,回收率为70%~130%,相对标准偏差<15%。其余农药采用3种提取方式时回收率为80%~120%,相对标准偏差<15%。说明建立缓冲体系的盐包均能控制有机相的酸碱度,改善对酸敏感的农药的回收率,提取效果优于普通盐包。两种缓冲盐体系盐包无明显差别,后续试验采用乙酸缓冲盐体系盐包提取。
2.2 净化方式的选择
实验比较了PSA净化和SinChERS-Nano柱净化的净化效果(见图1和图2)。从图1中可以看出,不论是柑橘样品还是葡萄样品,采用PSA净化时样品颜色较深;采用SinChERS-Nano柱净化时样品颜色透明。从图2可以看出,PSA净化后样品杂质多,干扰大,而SinChERS-Nano柱净化后样品杂质少,受干扰小。

图 1 采用PSA与SinChERS-Nano柱净化后柑橘和 葡萄样品的净化效果图Fig. 1 Purification effect maps of citrus and grape samples cleaned-up by primary secondary amine (PSA) and SinChERS-Nano column
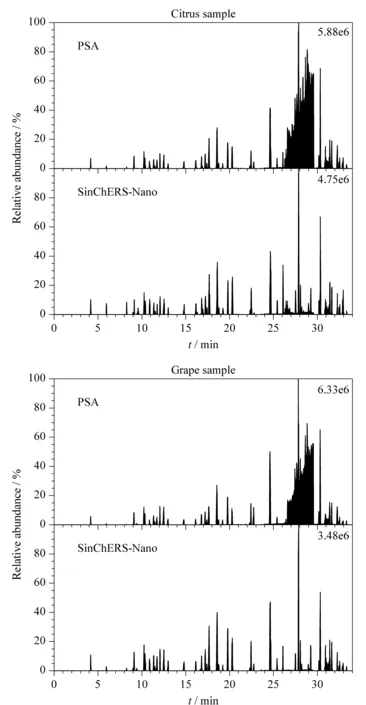
图 2 加标(0.02 μg/kg)柑橘和葡萄经PSA净化与 SinChERS-Nano净化后的总离子流图Fig. 2 Total ion current chromatograms of the spiked (0.02 μg/kg) citrus and grape samples cleaned-up by PSA and SinChERS-Nano
两种净化方式中起主要作用的PSA为弱离子交换的固相萃取材料,用来去除色素、有机酸及一些糖类和脂肪酸。SinChERS-Nano柱中除PSA外,还添加了一定量的MWCNTs。MWCNTs是中密度纤维材质,比表面积大,具有良好的吸附能力,也能够有效去除色素等杂质,且净化效果更好[17-21]。实验表明,PSA和MWCNTs的配合使用能有效清除水果中的杂质,减少对目标物的干扰,同时能延长衬管的使用寿命和减少离子源的污染。因此后续净化采用SinChERS-Nano柱净化。
2.3 基质效应
质谱分析测定中基质效应的存在会影响定量分析结果的准确性和重复性[22]。水果中含有大量有机酸、糖类、色素等不易挥发性物质,这些物质的存在会影响目标农药的离子化[23]。基质效应的相对强度(ME)=(基质标准溶液的峰面积/溶剂标准溶液的峰面积)×100%[24]。本实验对50种农药的基质效应进行了考察,结果显示,柑橘和葡萄样品中40%的目标物的ME在100%~120%之间,剩余目标物的ME>120%,均表现为基质增强效应。因此本实验采用空白基质溶液进行标准曲线配制,以减小基质效应对目标化合物测定结果的影响。

2.4 线性范围、检出限和定量限
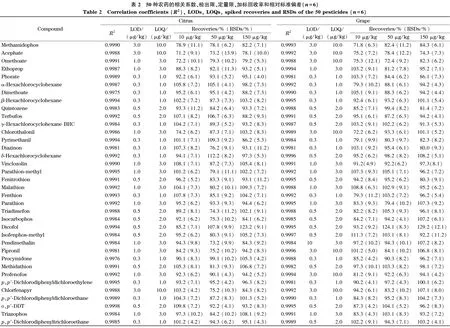
用空白基质溶液配制质量浓度为0.005~0.2 mg/L的系列混合标准溶液,在1.4节条件下进行分析,以各化合物的峰面积为纵坐标、对应的质量浓度为横坐标绘制标准曲线。结果表明,50种农药在0.005~0.2 mg/L范围内均成良好的线性关系,相关系数(R2)均>0.995 0(见表2)。以信噪比(S/N)约为3和10时空白样品添加浓度计算方法的检出限(LOD)和定量限(LOQ),结果分别为0.3~3.0 μg/kg和1.0~10.0 μg/kg(见表2),均符合国内外法规的相关残留限量要求[25-26]。
2.5 回收率与精密度
在空白柑橘和葡萄样品中添加3个水平(10、50和150 μg/kg)的50种农药混合标准溶液进行加标回收试验,每个添加水平重复测定6次。结果表明,其中45种农药的回收率为79.1%~122.3%,相对标准偏差(RSD)低于12.2%。甲胺磷、乙酰甲胺磷、氧化乐果、三氯杀螨醇、百菌清这5种农药的回收率为71.2%~129.2%,相对标准偏差(RSD)低于13.9%(见表2)。
2.6 实际样品检测
用所建方法对市售的10种水果(柑橘、葡萄、苹果、梨、草莓、猕猴桃、樱桃、枣、桃、杏)共50例样品进行测定,检出率达30%,其中草莓和葡萄样品中农药的检出率较高,检出频率较高的农药为腐霉利、氟虫腈、甲拌磷、氯氰菊酯、氧化乐果,但均未超过最大残留限量。
3 结论
本实验采用SinChERS-Nano柱进行样品前处理,结合GC-MS/MS,建立了水果中50种农药的快速定性定量分析的方法,并运用所建方法检测了包括柑橘和葡萄在内的10种水果样品。该法具有操作简单、快速高效和准确可靠等优点,能够对日常大量水果样品中多农药残留进行快速筛查。
