RAS/RAF突变与MSI状态在结直肠癌治疗中的研究进展
2018-09-05李文琪综述耿敬姝审校
李文琪 综述 耿敬姝 审校
结直肠癌是世界第三大高发癌症,是男性癌症死亡的第二大原因,女性死亡的第三大原因。结直肠癌的系统治疗在过去的几十年中逐渐发展起来,如今患者的总生存期可达三十个月或更多[1]。除了传统药物治疗外,靶向治疗和免疫治疗也逐渐应用于结直肠癌的临床治疗中[2]。随着结直肠癌药物治疗谱的不断扩增,患者的生存能力也更有保障。但随之而来的,也为患者如何选择最适合自己病情的个体化治疗带来了极大的挑战。
结直肠癌主要由两条分子通路引起,一条是染色体不稳定性(Chromosome instability,CIN)通路(80%~85%),另一条是微卫星不稳定性(Microsatellite instability,MSI)通路(约15%)[3]。其中RAS-RAF-MEK-ERK-MAPK通路是CIN中最重要的组成部分之一[4],而RAS/RAF基因对这条通路的状态有着极大的影响。但已有大量研究证实,RAS/RAF突变的患者,对贝伐单抗及西妥昔单抗治疗效果不佳,而高微卫星不稳定性(MSI-H)患者同样对5-FU类药物治疗不敏感。即传统治疗方式无法满足这些小亚型患者,如何改善这些患者的生存预后依旧是当今研究的重中之重。本文将重点讨论RAS/RAF突变及MSI-H状态患者的最新治疗进展。
1 CIN通路检测及治疗的最新进展
1.1 RAS-RAF-MEK-ERK-MAPK通路
RAS-RAF-MEK-ERK-MAPK通路中的RAS和RAF基因都是原癌基因,均以两种状态存在,一种是突变型,另一种是野生型。当任一基因发生突变时,都可能会激活腺瘤-癌序列,使黏膜腺体增生,继而可能会形成腺瘤,进一步可导致癌症的发生。即RAS或者RAF突变发生的时候,下游基因不再受上游基因调控,使整个通路处于活跃状态,无限增殖,促使肿瘤形成[5]。此外,由于EGFR是该通路的上游因子,所以当RAS或RAF突变的时候,下游通路激活,导致结直肠癌接受抗EGFR传统治疗的效果不佳。
1.2 RAS突变
1.2.1 RAS突变的检测 RAS是一种异质性基因,由KRAS、NRAS、HRAS组成。随着检测技术的革新,近年来RAS基因突变的检出率与过去有了明显的不同。过去,我们通常采用传统桑格测序法对RAS基因进行检测。大多数学者认为仅35%~45%的结直肠癌患者中存在RAS突变,且突变高发于KRAS 2号外显子的12/13密码子上[6]。随着研究的进展,有学者发现并非所有当时检测非突变的患者都可以从抗EGFR治疗中获益,这可能是由于检测方法落后导致的RAS突变假阴性造成的。随着敏感性更高的高通量测序(Next generation sequencing,NGS)技术的普及,我们可以对RAS基因进行更准确、全面的分析。最新的研究显示,经NGS的RAS扩大检测时(对KRAS/NRAS的2/3/4号外显子同时检测),RAS突变率已上升至56%左右[7]。RAS突变检测已经被纳入2017年晚期结直肠癌治疗的NCCN指南中[8](图1)。
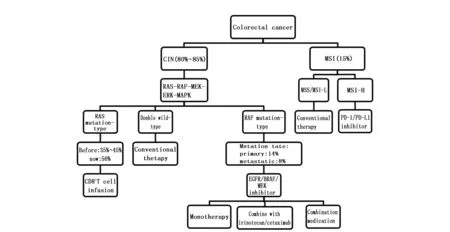
图1 各分型结直肠癌的最新治疗方式Figure 1 The latest treatment for various types of colorectal cancer
1.2.2 RAS突变治疗的进展 结直肠癌患者通常采用FOLFOX/CAPOX或FOLFIRI/CAPIRI联合表皮生长因子受体抑制剂作为其传统的一线治疗方法,但这种治疗方案通常仅对RAS野生型患者有效,RAS突变型患者几乎不能从该治疗方案中获益。所以RAS突变型患者的最佳治疗方案仍需进一步研究。近期,免疫治疗为RAS突变型患者提供了一种治疗的新思路。Tran等对RAS G12D突变的结直肠癌患者进行CD8+T细胞输注的临床试验[9]。输注T细胞的患者,肿瘤体积明显缩小且患者总生存期升高。随后大多学者研究证实,T细胞对突变肿瘤抗原的应答作用可能会为RAS突变的结直肠癌患者提供良好的治疗效果。在此基础上Pek等[10]研究发现,倍美替尼(MEK抑制剂)可以通过增加肿瘤细胞上MHC1的表达来促进CD8+T细胞的积累,以此增加KRAS突变型结直肠癌患者对PD-L1抑制剂的敏感性。这些结论使RAS从预后不良的生物标志物,转变为可以预测是否支持新型免疫治疗的具有积极意义的生物标志物(表1)。

表1 各检查位点的最新治疗方案及其主要效果Table 1 The latest treatment options and their main effects at each site
1.3 RAF突变
1.3.1 RAF突变的检测 RAF是RAS的下游基因,绝大多数学者表示RAS和RAF两种基因不可能同时发生突变。但个别大样本实验证实,RAS/RAF存在共同突变的可能[11-12]。RAF突变具有同质性,其突变几乎均发生在BRAF V600E位点上[13]。最新的研究显示,经NGS测序约有14%的原发性结直肠癌患者和8%的转移性结直肠癌患者的BRAF发生突变[14](图1)。
1.3.2 RAF突变治疗的进展 已有大量研究显示,RAF突变的患者生存期较短,疾病进展较快,复发风险高,是结直肠癌预后不良的标志。一则Meta分析显示,RAF可以作为抗EGFR治疗抵抗的独立预测指标[15]。虽然BRAF突变的结直肠癌患者接受传统疗法疗效差,但新型敏感药物的研发在近三年已取得了极大的进步。早期Corcoran等研究证实,EGFR抑制剂、BRAF抑制剂和MEK抑制剂均有改善BRAF突变患者预后的效果[16]。大多数学者支持此结果,并表示,三药的联合使用效果更佳。但也有少许实验表示反对:BRAF抑制剂的单药使用仅可延长5%患者的生存时间,而BRAF抑制剂联合MEK抑制剂的双药使用效果也不尽如人意[17]。此外,近期Kopetz的团队明确提出:BRAF V600E抑制剂联合伊立替康及西妥昔单抗治疗相较单纯使用伊立替康联合西妥昔单抗治疗的无进展生存时间有显著的延长,由2个月提高至4.4个月,是目前RAF突变的结直肠癌最佳的治疗方式[18]。EGFR/BRAF或BRAF/MEK的双重抑制是BRAF突变的结直肠癌患者最有前途的治疗方向,值得我们继续深入研究(表1)。
2 MSI通路检测及免疫治疗的最新进展
MSI是导致结直肠癌发生的另一大通路,虽然所占比例较CIN通路小很多,但由于其对预后及治疗具有明确的指导作用,所以不可忽视。
2.1 MSI的表达
DNA错配修复基因(dMMR)启动子甲基化导致体内的基因修复功能异常,造成整个基因组中重复元件的扩增,这种异常的生物学状态称为MSI状态[19]。一般体内存在三种状态:微卫星高不稳定性(MSI-H)、微卫星低不稳定性(MSI-L)和微卫星稳定性(MSS)。绝大多数MSI-H状态下的结直肠癌是散发性结直肠癌,其余的为遗传性非息肉病性结直肠癌(林奇综合症)[20]。林奇综合征患者的BRAF基因极少发生突变,当MSI-H状态下的BRAF基因为突变型时,结直肠癌可基本排除家族遗传的可能[21]。
2.2 MSI治疗的最新进展
目前的研究结果表明,MSI状态下的结直肠癌预后较好,但5-FU类药物对其治疗效果不佳[21]。直到2015年,Le等人的研究表明MSI状态可以指导患者进行免疫治疗[22]。对结直肠癌使用Pembrolizumab(PD-1抑制剂)进行治疗时,MSI-H患者的总缓解率和无进展生存率分别为40%和78%,但在MSS患者中则分别为0和11%。即PD-1抑制剂可以明显改善MSI-H状态患者的预后,但对MSS状态下患者的治疗效果不佳。这一发现开启了结直肠癌的免疫治疗方法,在结直肠癌的治疗中具有里程碑式的意义。
自从这一里程碑意义发现以来,越来越多的学者对“免疫检查点阻断”进行研究,并已取得了很好的进展[23]。对于MSI-H患者是否应该在传统治疗的基础上开展免疫治疗也有了比较肯定的答案。2017年胃肠研讨会上,有学者称Atezolizumab(PD-L1抑制剂)与贝伐单抗联合使用,可以治愈40%的MSI-H的转移性结直肠癌[24]。Overman等也更新了CheckMate-142实验的最新进展,表明31.1%的MSI-H患者可通过Nivolumab(PD-1抑制剂)改善预后[25],无进展生存期可达9.6个月。结直肠癌免疫治疗的临床实验数据较少,但也有研究表明[26],免疫抑制剂在结直肠癌治疗中安全性较高,且有明显抗肿瘤作用。如今,MSI已成为FDA批准的PD-1抑制剂使用与否的主要判定靶点(表1)。
2.3 肿瘤突变负荷(Tumor mutation burden,TMB)的检测意义
TMB是指人体庞大的基因组中,每兆碱基(MB)发生的基因异常改变的总数[27]。它是继MSI后又一较成熟的免疫检查点抑制剂的生物标志物,与MSI存在包含关系。癌症基因组图谱(TCGA)显示:16%的结直肠癌患者在修复自发DNA损伤的机制上存在缺陷,这类患者的肿瘤突变负荷明显增加。其中,75%是由于MSI-H状态导致,其余25%则由体细胞MMR基因和聚合酶ε(POLE)突变引起[28]。我们可以得出结论:大多数TMB-H的患者常表现为MSI-H状态。有实验显示,TMB-H与右半结肠癌密切相关。右半结肠肿瘤平均突变负荷为24.5个突变/MB,高于左半结肠肿瘤(5.5个突变/MB)和直肠肿瘤(5.9个突变/MB)[29]。数值差异与MSI-H在结直肠癌中的分布情况基本一致。
TMB增高的患者,其基因组中突变的基因数量明显增高,继而会在体内产生数量庞大的非自身抗原的新抗原。所以TMB-H的结直肠癌,被免疫系统识别的可能性大,更容易引起强烈的免疫反应,对免疫抑制剂的敏感程度也就越高[30-31]。先前也有人提出,突变负荷升高的患者,肿瘤浸润性淋巴细胞数量增高,这也可能是TMB-H患者更适合免疫治疗的原因之一[32]。已有研究证实,在小细胞肺癌中TMB-H的患者可以从PD-1治疗中获益的可能性大。且其对PD-1的治疗效果的预测优于MSI这一指标[33]。我们可以推测,这种规律在结直肠癌中同样适用。一项大样本实验显示[34],部分MSS的结直肠癌患者对PD-1的治疗也有长期的高应答效果,而TMB的检查可以帮助这类患者避免错过免疫治疗这一宝贵机会。
3 RAS/RAF突变与MSI状态的关系
3.1 三者间表达的关系
大多学者认为,RAS在MSI-H状态下较MSS状态下突变率略低;而RAF突变率在MSI-H状态下明显升高,甚至可以达到MSS状态下的5~10倍。即RAF突变率与MSI-H状态之间呈正相关[35]。但也有少数学者认为RAS突变率与MSI-H状态间没有明确相关性,KRAS 13号密码子在MSI状态下的突变率也可能高于MSS状态[36]。
3.2 三者间预后的关系
过去对于结直肠癌预后的评价一直局限于单因子评价。主流观点是RAS/RAF两者中任一基因发生突变则预后较差,而MSI-H状态下结直肠癌预后相对较好[37]。近年来,越来越多的学者尝试使用多因素对结直肠癌预后进行综合评价。大多数学者认为,MSI-H对结直肠癌预后的正影响要远大于RAS、RAF突变带来的负影响,即MSI-H状态下,无论RAS/RAF的突变状态如何,结直肠癌预后较好[38]。也有个别学者认为,即使在MSI-H状态下,RAF突变的结直肠癌预后依旧极差[39]。
3.3 治疗的空白
虽然RAS/RAF突变与MSI的状态间的表达情况和对结直肠癌预后的影响已有大量文献报道,但关于三者综合治疗用药的文献寥寥无几。如今对于单一因子状态用药的选择正在不断革新,但均处于临床试验状态,未规范化写入指南。多因子联合指导用药的研究更为复杂,但对其研究却势在必行,急需大量临床试验来弥补这一领域的空白。这是未来结直肠癌研究的重要方向,以规范不同分子状态下结直肠癌的合理用药。
4 小结与展望
整个外显子测序法(WES)或全基因组测序法(GWS)是更全面的基因测定方法,他们可以对RAS/RAF等基因的表达进行更全面的扩大测序,也可以更精准的评估患者的MSI/TMB及其他免疫检查点抑制剂的生物标志物。如何将这两种测序法普及是患者选择更精确的治疗方法的关键。此外研发突变亚型的治疗新药,寻找更多的靶向治疗及免疫抑制剂的检测位点,以及如何将TMB应用于结直肠癌的治疗,都是当今学者仍需努力研究的方向。虽然现如今大多数结直肠癌患者仍会选用传统的非选择性细胞毒性化疗药物进行治疗,但越来越多的拥有某种基因改变的小亚型患者会针对突变进行靶向治疗。相信选择性靶向药物治疗及免疫治疗终将取代传统的非选择性细胞毒性化疗。所以,我们应持续对影响结直肠癌预后的分子进行研究,为患者带来更好的治疗方案。
