抗病毒病K326新品系Y48抗TMV的细胞学机制研究
2018-09-05文柳璎申莉莉罗成刚程立锐蒋彩虹杨爱国
文柳璎,刘 旦,龚 敏,马 冰,申莉莉,罗成刚,任 民,程立锐,蒋彩虹,杨爱国
抗病毒病K326新品系Y48抗TMV的细胞学机制研究
文柳璎,刘 旦,龚 敏,马 冰,申莉莉,罗成刚,任 民,程立锐,蒋彩虹,杨爱国*
(中国农业科学院烟草研究所,烟草行业烟草基因资源利用重点实验室,青岛 266101)
Y48是对主栽烤烟品种K326的病毒病抗性进行定向改良培育出的新品系,在保持原K326其他性状不变的前提下,对TMV和CMV抗性显著提高。为揭示其在细胞学方面的抗病机制,本研究利用透射电子显微镜(TEM)对TMV接种0~72 h后的K326和Y48叶片进行超微结构观察。结果显示,K326接种24 h时,叶绿体类囊体片层减少,线粒体膨大,胞内出现自噬结构,接种72 h时,叶绿体、线粒体被病毒完全破坏,叶肉细胞病理性坏死;而Y48,在接种48 h时才发生叶绿体内部沉积少量颗粒,线粒体嵴消失,胞内出现降解的囊泡,接种72 h叶绿体,线粒体全部降解,细胞质凝集,叶肉细胞程序化死亡。结果表明,相对于K326,Y48可以延迟TMV病毒的侵染,并启动超敏反应,发生HR-PCD,并且Y48接种8 h后出现过氧化物酶体,可能影响细胞内ROS代谢水平,二者或许是Y48对TMV表现抗病的细胞学证据,研究结果为进一步解析Y48的抗病分子机理奠定了基础。
烟草普通花叶病;透射电子显微镜;超微结构;超敏反应;细胞程序化死亡
烟草普通花叶病毒(Tobacco Mosaic Virus,TMV)、黄瓜花叶病毒(Cucumber Mosaic Virus,CMV)和马铃薯Y病毒(Potato Virus Y,PVY)是烟草上危害最严重的3种病毒病害。对优良主栽品种进行病毒病抗性定向改良,是保障烟叶生产最为快速有效的途径[1]。烤烟品种K326烟叶品质优良,是我国烤烟生产的主栽品种,也是卷烟配方的主选原料,但是在烟叶生产过程中,K326易感病毒病。本研究以K326为背景材料,通过分子标记辅助选择定向改良K326的病毒病抗性,培育出兼抗TMV和CMV的改良K326新品系(暂命名为Y48)。全基因组SNP分析表明,新品系Y48的K326遗传背景回复率为99.71%,在主要植物学性状和农艺性状与K326保持不变的前提下,其TMV和CMV抗性得到明显改良。新品系Y48于2016年7月29日在四川省西昌市通过了国家烟草专卖局科技司和中国烟叶公司组织的田间鉴评,该品系的成功培育得到了烟草行业内外专家的高度评价。
TMV侵染烟草主要引起深绿与浅绿相间的花叶症状[2]。TMV侵染K326的细胞病理学研究表明,随着病程从轻到重,叶片表型从退绿、斑驳到黄化、再到最后叶片皱缩、大量坏死。叶肉细胞的超微结构也随病程变化。早期叶绿体结构较完整,有少量消解,中期叶绿体类囊体部分发生消解,后期叶绿体大部分发生崩解[3]。另一方面,烟草在与TMV互作的进化过程中也产生了多种主动防御手段,例如超敏反应和活性氧迸发等方式[2]。目前研究比较详细的是基因介导的超敏反应(Hypersensitive response,HR)。基因表达的蛋白可以识别TMV病毒解旋酶p50(TMV-p50),通过信号转导诱发烟草在病毒侵染部位发生过敏性坏死,限制TMV病毒在烟草中的扩散[4-5]。这种坏死被认为是超敏反应引起的细胞程序化死亡(HR Programmed cell death,HR-PCD),与被动死亡的病理性坏死(Pathological necrosis)细胞表现不同[6-9]。病理性坏死的细胞,一般表现为细胞核膜破裂、碎核释出,细胞器肿胀、崩解等[6]。HR-PCD的细胞表现与动物细胞凋亡类似。目前对植物HR-PCD的表型定义有争议,尽管发生HR-PCD的细胞有DNA等量断裂,染色质浓缩、细胞质浓缩等细胞凋亡的特征,但是细胞并没有发生水解酶大量释放溶解细胞质的现象[10-13]。最近研究报道,自噬和凋亡相关基因也参与HR-PCD的形成过程,推测自噬和凋亡对HR-PCD有叠加效应[10-11]。
Y48相对K326具有相同遗传背景,但是对TMV的抗性明显提高。目前对Y48抵御TMV侵染的细胞学机制还不清楚,本研究利用透射电子显微镜(Transmission Electronic Microscopy,TEM),对TMV侵染过程的Y48和K326的细胞超微结构进行研究,为解析Y48的抗病机制提供细胞学证据。
1 材料与方法
1.1 试验材料及病毒株系
抗病材料为烤烟新品系Y48(针对K326进行病毒病抗性定向改良获得的新品系),感病材料为烤烟品种K326,TMV病毒为TMV-C株系(普通株系)。烟草种子和病毒均由中国农业科学院烟草研究所烟草遗传育种研究中心保存。
1.2 材料种植及病毒接种
烟草种子在0.1% AgNO3溶液中浸泡消毒2 min,然后用清水浸洗5~6次,播种于50孔育苗盘中,置于人工气候室培养,培养条件为(23±1)℃,光照16 h/d。TMV病毒事先在NC89烟株上活化。当烟苗长至4~5叶期,通过摩擦接种法对烟苗的最上部叶接种TMV病毒,病毒接种液的配置及接种方法参考文献[14]。
1.3 病情调查
于烟草幼苗接种TMV病毒后20 d进行病情调查,调查标准依照全国烟草病虫害分级及调查方法GB/T 23222—2008[15]。病情指数计算公式参照DI=∑(各级病株数×该病级值)/(调查总株数×最高级值)×100。
1.4 超薄切片制备及TEM观察
接种TMV病毒后0、8、24、48、72 h,取两个品种(系)的接种叶,切成1 mm×5 mm叶段。2.5%戊二醛前固定24 h,1%锇酸后固定1 h。丙酮系列脱水,Spurr树脂包埋,65 ℃聚合24 h。样品在Lecia EMUC6超薄切片机上制备超薄切片,切片收集于200目有膜载网上,经醋酸双氧铀染色后,在Hitachi公司H-7650型透射电镜下观察拍照,加速电压为60~80 kV。
2 结 果
2.1 K326和Y48对TMV的抗性差异
图1表明,在接种0~48 h时间段内,K326和Y48的接种叶片无明显差异(图1A-C,图1E-G)。接种TMV 72 h,K326接种叶片可见部分组织发黄萎蔫(图1D),而Y48接种叶的叶面颜色较接种48 h的叶片变浅,叶面有多个直径大约1 mm的浅绿色或者浅黄色的斑点,并出现小面积褐色枯斑,但是总体看坏死斑不明显(图1H)。在接种4 d后,K326有轻微花叶症状,Y48接种叶发生超敏反应,产生坏死斑,K326和Y48的表型可明显区分。接种20 d后,K326新叶出现花叶,为典型的TMV病害症状,植株发生了病毒系统侵染;而Y48的新叶无发病症状,对病毒表现为免疫。病情调查结果显示,K326的发病率为100.00%,病情指数为91.14;Y48的发病率和病情指数均为0,说明K326和Y48在TMV抗性方面存在明显差异。
2.2 接种TMV后K326和Y48的叶肉细胞结构变化
对接种叶片的叶肉细胞结构进行TEM观察,结果表明,接种0 h,K326叶肉细胞结构正常,细胞壁、细胞膜、液泡边界清晰,叶绿体细胞器和细胞核分布于细胞边缘(图2A);接种24 h,液泡内出现膜结构物质(图2B);接种48 h,液泡内有游离细胞器(图2C);接种72 h,细胞核破裂,染色质凝聚,并向细胞核外侧边缘化分布,细胞核膜破裂(图2D)。由此推断,TMV侵染K326的叶肉细胞时,随着病害逐渐加深,细胞发生病理性坏死。而Y48在接种0~24 h,叶肉细胞整体结构较完整,无明显变化,液泡边界清晰(图2E,F);接种48 h,液泡内部出现膜结构物质(图2G);接种72 h后,细胞质凝集,细胞空泡化、液泡内散落降解的细胞器(图2H);Y48在短时间内发生与过敏反应相似的细胞表型变化,推测TMV病毒的侵染引起Y48细胞产生HR-PCD。

图1 K326和Y48在接种TMV后0~72 h的叶片表型
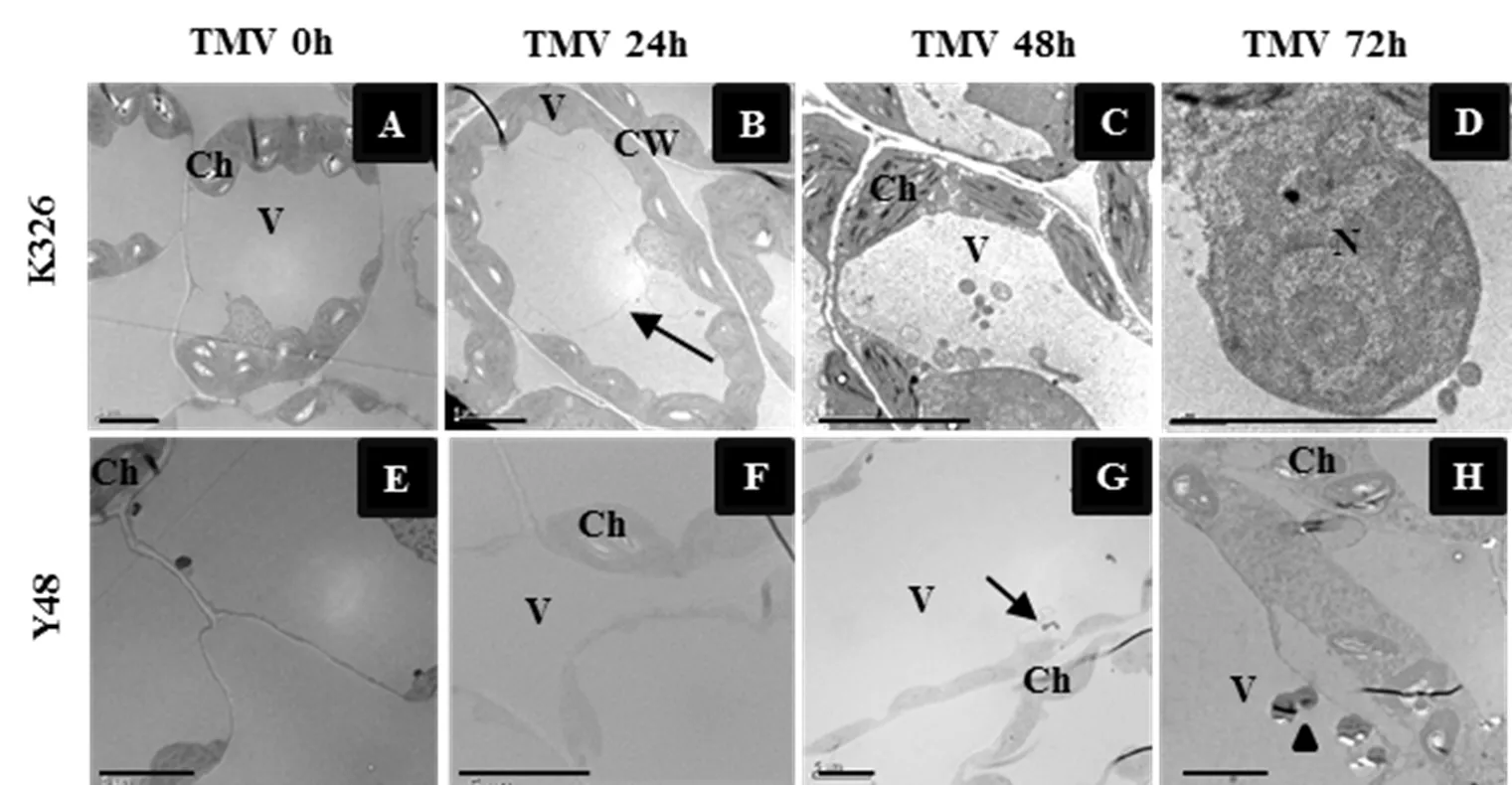
注:N,细胞核;V,液泡;CW,细胞壁;Ch,叶绿体;箭头,膜结构;三角形,降解细胞器;bar=5 μm。
2.3 接种TMV后K326和Y48的叶绿体内部结构变化
叶绿体是植物进行光合作用的主要场所,病毒侵染会影响寄主叶绿体的光合作用[16]。图3显示叶绿体随着TMV侵染发生变化。在接种TMV 0 h时,感病品种K326叶绿体结构完整,外膜光滑、内部有少量淀粉粒,基粒类囊体的片层与叶绿体长轴平行,排列紧凑(图3A,B)。接种24 h,K326叶绿体整体结构较完整,但是基粒类囊体片层减少,垛叠变薄(图3E,F)。接种48 h,K326叶绿体外膜形状不规则,内部出现大量泡状结构。病毒的侵染影响了叶绿体光合作用,干扰淀粉合成代谢。类囊体片层进一步变薄,松散、扭曲,淀粉粒消失(图3I,J),并且叶绿体内部沉积不明颗粒状物质(图3I箭头所示),推测这些颗粒物为病毒复制过程产生的复合体。接种72 h,叶绿体崩解,细胞内散落类似类囊体的残余体(图3M,N)。以上现象说明K326的叶绿体随着病毒侵害加深,发生了病理性死亡。
对于抗病品系Y48,在接种0~24 h,叶绿体未发生变化,整体结构较完整,片层清晰,基粒类囊体排列紧凑(图3C,D,G,H)。接种48 h,叶绿体表现轻微异常,内部沉积少量不明颗粒状物质(图3K,L箭头所示),同时类囊体膜部分降解,片层模糊,淀粉粒可见。接种72 h,叶绿体形状可分辨,多数叶绿体类囊体消失。淀粉粒仍存在,说明淀粉没有被分解(图3O,P)。Y48在接种TMV的0~72 h,叶绿体内部超微结构虽然变化,但整体形状相对保持完整,由此推测Y48可能是由于类囊体膜蛋白,或者组成光合系统II的蛋白发生大量错误折叠而被降解,最终导致了叶绿体内部结构改变。
2.4 接种TMV后K326和Y48的线粒体内部结构的变化
如图4所示,在TMV接种0 h时,K326的线粒体结构,包括膜结构和线粒体嵴均保持完整(图4A)。接种24 h,线粒体膨大,线粒体嵴消失,视野内多见直径1.3 μm以上的线粒体(图4 B)。接种48 h线粒体膜出现破损,内含物流失(图4 C)。接种72 h,线粒体完全破裂,内含物泄露(图4 D)。以上结果表明随着病毒侵害加深,K326线粒体发生了病理性坏死。对于抗病品系Y48,在接种0~24 h,线粒体结构正常(图4E,F)。接种48 h,线粒体外部膜完整,线粒体嵴消失,内含物逐渐弥散降解(图4G)。接种72 h,线粒体外膜仍保持完整,内部空泡化,线粒体嵴消失(图4H)。由此推测Y48叶肉细胞线粒体组成成分发生改变,导致结构变化,失去了能量代谢的功能。

注: CW,细胞壁;S,淀粉粒;黑色方框,表示放大区域;箭头,不明颗粒状物质;bar=0.5 μm。

注Note: bar=0.2 μm。
2.5 接种TMV后K326和Y48自噬结构的变化
细胞自噬是由液泡或溶酶体介导来降解细胞质内蛋白质和细胞器的基本生理代谢过程。在植物中细胞自噬分为两类:一类是微自噬,是溶酶体或液泡膜直接内陷包裹并降解底物;另一类是巨自噬,是双层膜结构包裹底物,随后与溶酶体融合形成自噬溶酶体(autolysosome),或者与液泡融合形成自噬小体(autophagic body)[9]。本研究中,烟草叶肉细胞对TMV病毒侵染发生响应,除了叶绿体和线粒体发生变化外,叶肉细胞也发生了细胞自噬的现象,而且在不同抗感材料中变化特征不同。
在感病材料K326中,出现了微自噬和巨自噬两种自噬现象。首先,接种TMV 8 h,细胞出现巨自噬现象,图5A箭头所指的AV表现为典型的巨自噬结构特征,如多层膜包被,位于液泡内,直径超过1 μm,内含多种细胞器;图5D中出现自噬溶酶体,表现为多泡体结构(MVB),内含多个电子密度低的20~80 nm小泡;TMV接种48 h,细胞质中出现大量空泡,液泡中还有降解的细胞器残余体,推测是由巨自噬降解底物产生的(图3I,图5B,C,E)。其次,接种TMV 8 h,可观察到微自噬现象,图5D箭头所指为临近液泡产生的微自噬小泡,内含一些颗粒成分;TMV接种48 h后,细胞壁浑浊,细胞膜内陷形成自噬小泡(图5E,白色圆圈),并且细胞核也发生变化,出现核膜破裂,细胞核与细胞质断裂分离,染色质弥散等现象(图2D,图5F)。
在抗病材料Y48中也发现了自噬现象,但与K326表现不相同。TMV接种8 h,无自噬现象。仅在TMV接种48 h,叶肉细胞出现向液泡融合的囊泡,内含小泡直径多在50~100 nm,较K326大(图6B)。叶绿体内部形成空泡,直径约500 nm(图6E)。TMV接种72 h,细胞内部出现大量直径1~6 μm空泡,推测是自噬体或者液泡降解底物后形成的(图6C)。Y48接种TMV 72 h与0 h相比,细胞壁亮度较低,细胞壁与细胞质膜贴合较紧密,无微自噬小泡形成(图6F)。另外Y48在接种TMV 8 h,叶肉细胞的线粒体发生聚集,线粒体嵴褶皱明显,由此推测细胞呼吸作用增强(图6A)。而且过氧化物酶体出现在叶绿体和线粒体的周围,表明Y48细胞的活性氧代谢在接种8 h出现了变化(图6D)。

注:CW,细胞壁;Ch,叶绿体;N,细胞核;MVB,多泡体;AV,自噬泡;箭头,自噬结构;bar=0.5 μm。

注:CW,细胞壁;Ch,叶绿体;M,线粒体;P,过氧化物酶体;箭头,自噬结构;bar=0.5 μm。
3 讨 论
3.1 TMV侵染烟草的细胞学研究
对于病毒侵染烟草的病理学研究前人已有报道,多数研究结果是直接拍摄叶片变化,或者利用荧光显微镜观察叶片的细胞变化。而在病毒潜育期,利用TEM观察烟草叶肉细胞及其细胞器的超微结构变化鲜见报道。本研究利用TEM,在TMV侵染烟草叶片早期,从亚细胞水平对叶肉细胞和细胞器进行了一系列观察,研究结果对于病毒侵染烟草的细胞病理学研究是重要补充。
本研究所用的抗病材料Y48是K326的抗病毒病定向改良新品系,经全基因组SNP分析,其与K326的遗传背景相似率为99.71%。本研究选用这两个抗、感材料,基本上消除了遗传背景差异带来的材料本身的细胞结构差异,研究结果可以真实反映受病毒侵染后,不同抗、感品种的亚细胞结构变化,为进一步解析抗病机制奠定基础。
3.2 烟草叶片细胞的细胞器变化与Y48抗性
叶绿体和线粒体是维持植物叶片功能的重要细胞器。TMV外壳蛋白(TMV-CP)可以迅速进入寄主叶绿体中,结合在类囊体膜上,导致烟草发生花叶症状,并且TMV-CP浓度与花叶症状的严重程度正相关[17-20]。本研究观察TMV侵染K326的病变细胞,发现叶绿体畸形、破裂,类囊体片层变薄,不明颗粒物沉积,以及线粒体肿胀破裂等细胞器变化与已有报道的TMV侵染后烟草细胞病理变化相似。在植物体中,叶绿体蛋白也参与HR-PCD,与产生抗性有关。例如叶绿体的D9S蛋白具有维持膜蛋白正确折叠的功能[21]。SEO等[22]报道,在TMV侵染的叶片中,定位在类囊体上的DS9的表达下降导致叶绿体功能受损,并加速细胞产生HR-PCD。还有叶绿体NPIP1蛋白与TMV病毒解旋酶p50一起参与抗原识别[23]。在本研究中,Y48在接种TMV 4 d后产生大面积的枯斑,细胞器的变化与N基因介导的超敏反应表现相似,这也许是叶绿体NPIP1基因参与Y48的抗原识别的结果。Y48在接种TMV 48~72 h之间叶肉细胞产生HR-PCD,叶绿体内部类囊体片层消失,可能与叶绿体DS9表达下降有关,导致蛋白错误折叠被降解,相关结论还在进一步验证中。
3.3 细胞自噬与Y48抗性
自噬在植物与病毒互作中有双重作用。自噬既可以促进感染细胞清除病毒,也可以被病毒利用,促进其在胞内增殖[24]。刘伟等[25]研究表明,TMV-U1株系侵染亮黄烟,感病细胞在接种72 h出现自噬现象。LI等[26]研究发现TMV侵染Hela肿瘤细胞,病毒增殖可引起内质网应激,随之细胞产生自噬。申莉莉[27],李方方等[28]研究表明,CMV侵染本氏烟和三生烟可诱导寄主产生内质网应激,细胞器降解。在本研究中,感病材料K326在TMV接种8 h时,出现自噬体,到接种48 h,细胞质出现大量空泡,液泡中含有很多降解的细胞器。观察结果与以往报道类似,说明TMV侵染诱发感病细胞产生自噬。推测K326细胞自噬的诱发原因是TMV-C株系的增殖,引起细胞持续产生内质网应激。
植物HR-PCD在形成过程中是由凋亡和自噬两类基因参与叠加的结果。自噬在HR-PCD形成过程中有两种作用,一是自噬可以限制过敏性坏死发生的范围,例如基因介导的HR-PCD,LIU等[5]报道在烟草中沉默自噬相关基因,不能将超敏反应有效的抑制在病原侵染部位;二是自噬同时也是HR-PCD的执行者,HOFIUS等[29]报道拟南芥自噬基因突变体影响TIR类型和CC类型免疫反应引起的HR-PCD的产生。本研究中,Y48在接种TMV 48 h叶肉细胞有自噬现象,细胞质、叶绿体和线粒体内部也发生空泡化。由此推断自噬相关基因也参与抗病材料Y48的HR-PCD过程。
3.4 活性氧代谢与Y48抗性
病原侵染可以引起细胞活性氧(ROS)代谢的增强[2]。过氧化物酶体能够产生和清除ROS,并且该细胞器的增殖受ROS调控[30]。本研究中,接种TMV 48 h,Y48的叶绿体中积累不明颗粒物质相对K326少,同时叶绿体畸形程度轻,推测病毒在Y48细胞内的复制受到抑制。对比接种TMV 8 h,过氧化物酶体在Y48的细胞中频繁出现,且紧邻线粒体和叶绿体,推测可能是细胞对ROS的调控出现变化所致。ROS水平的变化或许是Y48细胞内TMV增殖受抑制,病程延缓的原因。
综上所述,本研究利用TEM技术,对比感病品种K326与抗病品系Y48在TMV侵染后,叶肉细胞超微结构的一系列变化。从细胞水平揭示新品系Y48对TMV表现抗性的细胞学证据,为进一步从分子水平解析Y48的抗病机制提供理论支撑,同时为新品系Y48的推广利用和作为突破性基础材料的育种利用提供依据。
4 结 论
感病品种K326和抗病品系Y48的叶肉细胞,在TMV侵染早期,超微结构变化有差异。K326叶肉细胞在接种24 h后已经发生明显变化;72 h后细胞病理性坏死。而Y48在接种48 h后细胞结构才发生轻微变化,72 h后细胞原生质体凝集、细胞器降解。表明Y48可延缓发病,并通过启动细胞HR-PCD,产生抗性,抗病过程可能与细胞自噬有关。
[1] 许石剑,肖炳光,李永平. 烟草抗TMV育种研究进展[J]. 中国农学通报,2009,25(16):91-94.
XU S J, XIAO B G, LI Y P. Progress on TMV resistant breeding of tobacco[J]. Chinese Agricultural Science Bulletin, 2009, 25(16): 91-94.
[2] 董金皋,康振生,周雪平. 植物病理学[M]. 北京:科学出版社,2016.
DONG J G, KANG Z S, ZHOU X P. Plant pathology[M]. Beijing: Science Press, 2016.
[3] 张仲凯,方琦,丁铭,等. 烟草主要病毒病的细胞病理研究[J]. 云南大学学报(自然科学版),1999(S1):12-15.
ZHANG Z K, FANG Q, DING M, et al. The cytopathalogy of manin tobacco virus diseases[J]. Journal of Yunnan University, 1999(S1): 12-15.
[4] ERICKSON F L, HOLZBERG S, CALDERONURREA A, et al. The helicase domain of the TMV replicase proteins induces the N-mediated defence response in tobacco[J]. Plant Journal, 1999, 18(1): 67-75.
[5] LIU Y, SCHIFF M, CZYMMEK K, et al. Autophagy regulates programmed cell death during the plant innate immune response[J]. Cell, 2005, 121(4): 567-577.
[6] 潘耀谦,高丰,成军. 细胞凋亡与细胞坏死比较的研究进展[J]. 动物医学进展,2000(4):5-8.
PAN Y Q, GAO F, CHENG J. Research progress between apoptosis and cellular nectosis[J]. Progress in Veterinary Medicine, 2000(4): 5-8.
[7] 夏启中,吴家和,张献龙. 与植物超敏反应(HR)相关的细胞编程性死亡[J]. 华中农业大学学报,2005,24(1):97-103.
XIA Q Z, WU J H, ZHANG X L. Review on hypersensitive response-related PCD in plant[J]. Journal of Huazhong Agricultural, 2005, 24(1): 97-103.
[8] 蒋丽,孔莹莹,韩凝,等. 植物细胞程序性死亡的分类和膜通透性调控蛋白研究进展[J]. 植物生理学报,2012,48(5):419-424.
JIANG L, KONG Y Y, HAN N, et al. Progress in the classification of plant programmed cell death and the regulatory protein for membrane permeabilization[J]. Plant Physiology Journal, 2012, 48(5): 419-424.
[9] 黄晓,李发强. 细胞自噬在植物细胞程序性死亡中的作用[J]. 植物学报,2016,51(6):859-862.
HUANG X, LI F Q. Roles of autophagy in plant programmed cell death[J]. Chinese Bulletin of Botany, 2016, 51(6): 859-862.
[10] 孔琼,杨红玉,王云月,等. 植物与病原物互作中的细胞程序化死亡[J]. 植物保护,2012,38(6):1-6.
KONG Q, YANG H Y, WANG Y Y, et al. Programmed cell death in plant-pathogen interactions[J]. Plant Protection, 2012, 38(6): 1-6.
[11] 黄立钰,傅彬英. 植物细胞程序化死亡响应非生物逆境胁迫反应机理[J]. 分子植物育种,2010,8(4):764-770.
HUANG L Y, FU B Y. Mechanism of programmed cell death(PCD) responding to abiotic stresses in plant[J]. Molecular Plant Breeding, 2010, 8(4): 764-770.
[12] MITTLER R, SIMON L, LAM E. Pathogen-induced programmed cell death in tobacco[J]. Journal of Cell Science, 1997, 110(11): 1333-1344.
[13] REAPE T J, MCCABE P F. Apoptotic-like programmed cell death in plants[J]. New Phytologist, 2008, 180(1): 13-26.
[14] 陈小翠,代帅帅,张兴伟,等. 烤烟CMV抗性的主基因+多基因混合遗传模型分析[J]. 植物遗传资源学报,2014,15(6):1278-1286.
CHEN X C, DAI S S, ZHANG X W, et al. Mixed major-gene plus polygenes inheritance analysis for cmv disease resistance in flue-cured tobacco[J]. Journal of Plant Genetic Resources, 2014, 15(6): 1278-1286.
[15] 任广伟,孔凡玉,王凤龙,等. 全国烟草病虫害分级及调查方法 GB/T 23222—2008[S]. 北京:中国标准出版社,2008:2-3.
REN G W, KONG F Y, WANG F L, et al. Grade and investigation method of tobacco diseases and insect pests. GB/T 23222—2008[S]. Beijing: Standards Press of China, 2008: 2-3.
[16] 王春梅,施定基,朱水芳,等. 黄瓜花叶病毒对烟草叶片和叶绿体光合活性的影响[J]. 植物生态学报,2000,42(4):388-392.
WANG C M, SHI D J, ZHU S F, et al. Effects of cucumber mosaic virus infection of photosynthetic activities of tobacco leaves and chloroplasts[J]. Acta Botanica Sinica, 2000, 42(4): 388-392.
[17] 於春. 植物病毒衣壳蛋白进入叶绿体的离体跨膜运输研究[D]. 南京:南京农业大学,2008.
YU C. Study on import of plant virus coat protein into intact chloroplasts through membrane in vitro[D]. Nanjing: Nanjing Agricultural University, 2008.
[18] BANERJEE N. Import of tobacco mosaic virus coat protein into intact chloroplasts in vitro[J]. Molecular Plant-Microbe Interactions, 1992, 5(6): 466.
[19] REINERO A, BEACHY R N. Association of TMV coat protein with chloroplast membranes in virus-infected leaves[J]. Plant Molecular Biology, 1986, 6(5): 291-301.
[20] BEACHY R N. Reduced photosystem II activity and accumulation of viral coat protein in chloroplasts of leaves infected with tobacco mosaic virus[J]. Plant Physiology, 1989, 89(1): 111.
[21] 赵瑞杰,李引乾,王会,等. Caspase家族与细胞凋亡的关系[J]. 中国畜牧杂志,2010,46(17):73-78.
ZHAO R J, LI Y Q, WANG H, et al. Relationship of caspase family and apoptosis[J]. Chinese Journal of Animal Science, 2010. 46(17): 73-78.
[22] SEO S, OKAMOTO M, IWAI T, et al. Reduced levels of chloroplast FtsH protein in tobacco mosaic virus-infected tobacco leaves accelerate the hypersensitive reaction[J]. Plant Cell, 2000, 12(6): 917-932.
[23] CAPLAN J L, MAMILLAPALLI P, BURCH-SMITH T M, et al. Chloroplastic protein NRIP1 mediates innate immune receptor recognition of a viral effector[J]. Cell, 2008, 132(3): 449.
[24] JACKSON W T. Viruses and the autophagy pathway[J]. Virology, 2015, 480: 450-456.
[25] 刘伟,李方方,孙航军,等. TMV侵染烟草诱导寄主产生细胞自噬[J]. 植物病理学报,2016,46(6):759-766.
LIU W, LI F F, SUN H J, et al. Tobacco mosaic virus infection on tobacco plants induces autophagy[J]. Acta Phytopathologica Sinica, 2016, 46(6): 759-766.
[26] LI L, WANG L, XIAO R, et al. The invasion of tobacco mosaic virus RNA induces endoplasmic reticulum stress-related autophagy in HeLa cells[J]. Bioscience Reports, 2012, 32(Pt 2): 171.
[27] 申莉莉. CMV诱导烟草内质网应激及调控因子NbbZIP28的研究[D]. 沈阳:沈阳农业大学,2017.
SHEN L L. Endoplasmic reticulum stress induced by CMV and research on the regulator NbbZIP28 in Nicotiana[D]. Shenyang: Shenyang Agricultural University, 2017.
[28] 李方方,申莉莉. 植物病毒侵染诱导寄主内质网应激反应[J]. 中国烟草科学,2016,37(6):95-100.
LI F F, SHEN L L. Endoplasmic reticulum stress induced by plant viral infection[J]. Chinese Tobacco Science, 2016, 37(6): 95-100.
[29] HOFIUS D, SCHULTZLARSEN T, JOENSEN J, et al. Autophagic components contribute to hypersensitive cell death in Arabidopsis[J]. Cell, 2009, 137(4): 773-783.
[30] 崔慧萍,周薇,郭长虹. 植物过氧化物酶体在活性氧信号网络中的作用[J]. 中国生物化学与分子生物学报,2017,33(3):220-226.
CUI H P, ZHOU W, GUO C H. The role of plant peroxisomes in ROS signalling network[J]. Chinese Journal of Biochemistry and Molecular Biology, 2017, 33(3): 220-226.
Analysis of Cytological Mechanism of TMV Resistance in the Novel Anti-Viral Disease Variety Y48 Developed from K326
WEN Liuying, LIU Dan, GONG Min, MA Bing, SHEN Lili, LUO Chenggang, REN Min, CHENG Lirui, JIANG Caihong, YANG Aiguo*
(Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Key Laboratory of Tobacco Gene Resources, Qingdao 266101, China)
A new variety with genetic improvement of K326 (Y48) has great market potential. Y48 was developed by marker-assisted selection for its high anti-TMV & CMV ability with the same agronomic traits. In order to reveal the cytological mechanism of the Y48 resistance, transmission electronic microscopy (TEM) was use to observe the ultrastructure of K326 and Y48 leaves in 0-72 h after TMV inoculation. The results showed that, in K326, chloroplast thylakoid lamellae decreased, mitochondria crista expanded, and autophagy appeared in mesophyll cells at 24 h after TMV inoculation. The chloroplasts and mitochondria were completely destroyed by TMV, then mesophyll cells went through pathological necrosis at 72 h after inoculation. While in Y48, a small amount of particles were deposited inside the chloroplast, the mitochondria cristae degraded, and the degraded-like vesicles appeared in mesophyll cells at 48 h after TMV inoculation. Chloroplasts and mitochondria were degraded totally, cytoplasm was concentrated, mesophyll cells went through programmed cell death (PCD) at 72 h after inoculation. The results indicated that, compared to K326, Y48 could delay TMV infection and activate hypersensitivity response to lead mesophyll cell to go through HR-PCD. Add,the present of peroxisome in Y48 at 72 h agter inoculation, might effect ROS level of cell. The two differences might provide cytological evidence to reveal the Y48 resistance and give the clue to analyze the molecular resistance mechanism of Y48.
tobacco mosaic virus (TMV); transmission electronic microscopy (TEM); ultrastructure; hypersensitivity response(HR); programmed cell death (PCD)
S572.03
1007-5119(2018)04-0018-08
10.13496/j.issn.1007-5119.2018.04.003
中国烟草总公司重大专项项目“以K326为主要底盘品种的烟草全基因组模块构建”(110201601028JY-02);中国烟草总公司重大专项项目“烟草抗CMV和赤星病连锁分子标记开发及NC82、K326品种抗性改良”(110201301009,JY-09);中央级公益性科研院所基本科研业务费专项“CMV病毒侵染烟草叶片过程的电镜样品制备技术研究”(1610232016015)
文柳璎(1983-),女,助理研究员,博士,研究方向为烟草遗传育种。E-mail:wenliuying@caas.cn。
,E-mail:yangaiguo@caas.cn
2018-02-26
2018-05-21
