橄榄苦苷对体外卵巢癌SKOV3细胞增殖的影响
2018-09-04谢树红黄惠娟许玉黎郑小花
谢树红,黄惠娟,许玉黎,郑小花,杨 帆
0 引 言
卵巢癌是女性癌症死亡的第四大原因,其中卵巢上皮性癌占卵巢恶性肿瘤的90%以上,5年生存率受分期影响波动于27%~46%[1-3]。卵巢癌的基本治疗原则为广泛肿瘤细胞减灭术辅以顺铂联合紫杉醇的化疗方案,但易发生化疗耐药及癌灶复发,据统计90%的晚期卵巢癌患者死亡原因与多药耐药的发展有关[4]。因此,目前对于卵巢癌的治疗迫切需要寻找一种既有效且不良反应小的新型药,对提升卵巢癌患者的生活质量、生存率等具有重要意义。多方研究表明,富含于天然橄榄油或橄榄叶中的橄榄苦苷在对抗子宫内膜癌、乳腺癌、宫颈癌、结肠癌、前列腺癌等肿瘤中已显示出积极的抑癌作用。本研究欲通过体外实验进一步探究橄榄苦苷对卵巢癌SKOV3细胞的增殖是否同样有影响以及不同浓度的橄榄苦苷在不同作用时间下细胞改变情况。
1 材料与方法
1.1细胞株、药物及试剂实验用卵巢癌SKOV3细胞由福州总医院实验科提供。橄榄苦苷(Funakoshi,Tokyo Japan ),McCoys 5A培养基(美国sigma公司)、胎牛血清(美国gibco公司)、青霉素链霉素双抗溶液(美国gibco公司)、0.25%胰蛋白酶(美国gibco公司)、PBS缓冲液(美国Hyclone公司)、cck-8试剂盒(美国genview公司),DMSO溶液(二甲基亚砜,南京凯基生物公司),25 cm2培养瓶、15 mL离心管、50 mL离心管(美国corning公司)
1.2方法①细胞培养:用含10%胎牛血清、1%双抗溶液配制的McCoys 5A完全培养基将SKOV3卵巢癌细胞接种到25 cm2的细胞培养瓶中,置于37 ℃的5%CO2培养箱中。待电子显微镜下观察细胞生长至80%~90%汇合度时,用0.25%胰酶消化传代,平均3 d传代1次。②细胞接种:SKOV3细胞生长至80%~90%汇合度后,用0.25%胰酶消化成单个细胞,台盼蓝染色计数后重新调整细胞浓度至5×104个/mL,以细胞数5000个/孔接种至96孔板,即每孔100 μL细胞培养液,每组6个平行样本,设置5个细胞组,包括4个不同浓度药物组(药物+培养液+细胞)和1个对照组(培养液+细胞)。设1个空白组[仅含培养液,用于校正培养液对吸光度(A)的影响],周边空白格以PBS缓冲液等体积填充。③CCK-8法检测细胞增殖变化:接种在96孔板的细胞贴壁后,每孔加入10 μL不同浓度的橄榄苦苷(800、400、200、100、0 μg/mL),其中橄榄苦苷粉末用DMSO有机溶剂溶解,用McCoy’s 5A培养基稀释到需要浓度,并确保DMSO终浓度<0.1%以避免对细胞的损害作用。分别培养细胞至24、48、72 h(观察时间的选择基于SKOV3细胞传代时间在48~72 h)。在相应时间后以换液形式加入含10%CCK-8的培养基,置于37 ℃的5%CO2培养箱中继续培养60 min后用酶标仪在450 nm测定细胞A值。④根据细胞不同生长时间A值绘制细胞生长曲线图,并以柱状图比较不同浓度下药物抑制率随时间的变化。其中细胞抑制率的计算公式如下:
抑制率(%)=[1-(药物组-空白组)/(对照组-空白组)] ×100%

2 结 果
2.1不同浓度橄榄苦苷与作用时间下SKOV3细胞生长A值比较相同作用时间下,各药物浓度组与对照组相比,细胞生长受到抑制,A值随着药物浓度增大而变小,与对照组A值比较差异有统计学意义(P<0.05);相同作用浓度下,100、200、400 μg/mL的细胞可随着作用时间延长A值增大,3个时间A值比较差异有统计学意义(P<0.05),在药物浓度800 μg/mL时,细胞生长明显受到抑制,在24 h和48 h内A值未发生明显变化(P>0.05),当作用时间达72 h时,A值与24、48 h比较差异有统计学意义(P<0.05)。随着药物浓度的增加,细胞生长曲线逐渐降低趋向水平。见表1、图1。


组别A值24h48h72h空白组0.61±0.010.58±0.020.57±0.02对照组0.89±0.021.47±0.062.02±0.03药物组 100μg/mL药物组0.87±0.01*1.40±0.04*#1.94±0.02*#△ 200μg/mL药物组0.83±0.02*1.27±0.06*#1.77±0.10*#△ 400μg/mL药物组0.78±0.02*1.03±0.07*#1.39±0.05*#△ 800μg/mL药物组0.64±0.02*0.64±0.02*0.70±0.03*#△与对照组相比,*P<0.05;同一浓度下,与24h比较,#P<0.05;与48h比较,△P<0.05
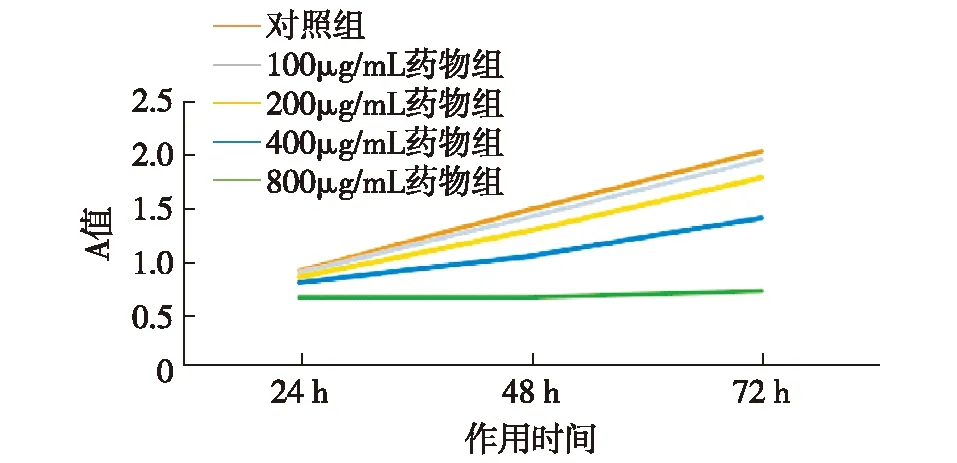
图1 不同浓度橄榄苦苷与作用时间下的SKOV3细胞生长曲线
2.2不同浓度橄榄苦苷与作用时间下SKOV3细胞抑制率比较在相同作用时间下,细胞生长抑制率随着药物浓度增大而增大,组间两两比较差异有统计学意义(P<0.05)。在相同浓度下,药物的抑制率并未随着作用时间的延长发生显著差异,不同时间抑制率两两比较差异无统计学意义(P>0.05)。在100、200、400、800 μg/mL的浓度梯度下,细胞抑制率逐渐增大,但抑制率未随作用延长发生显著改变。见表2。


组别细胞抑制率24h48h72h100μg/mL药物组6.46±10.517.62±7.645.39±3.11200μg/mL药物组21.34±8.97*22.02±9.01*17.24±7.48*400μg/mL药物组41.05±5.32*#49.10±9.82*#43.20±4.71*#800μg/mL药物组88.44±6.64*#△92.80±3.60*#△90.72±2.83*#△与100μg/mL药物组比较,*P<0.05;与200μg/mL药物组比较,#P<0.05;与400μg/mL药物组比较,△P<0.05
3 讨 论
橄榄苦苷是富含于天然橄榄油或橄榄叶中的一种重要的苯酚类咧环烯醚萜苷,更是广泛存在于木犀科的木樨榄属、丁香属、女贞属、木犀属和茉莉属植物中[5]。目前已证明橄榄苦苷对心、脑、肝、肾、皮肤、骨骼等均具有保护作用,既不对正常组织细胞产生毒副作用又可用于降血压、降血糖、抗肿瘤、治疗阿尔茨海默症及预防骨质疏松症等[5-8]。本次体外实验发现橄榄苦苷可抑制卵巢癌SKOV3细胞的的增殖,0~800 μg/mL时随着药物浓度的增加,细胞生长曲线逐渐降低趋向水平,在100、200、400、800 μg/mL的浓度梯度下,细胞抑制率逐渐增大,但抑制率未随作用延长发生显著改变。当药物浓度达800 μg/mL时,48 h内细胞几乎停止增殖状态不佳。SKOV3细胞的正常传代周期为48~72 h,当培养条件极佳时,甚至可24 h增殖至生长高峰传代。我们推测当浓度达800 μg/mL时细胞生长环境可能出现完全不适合SKOV3细胞的生长。由以上实验结果我们推测,橄榄苦苷对SKOV3细胞的增殖有抑制作用,抑制强度在0~800 μg/mL条件下呈现出浓度依赖性,而抑制强度可能无时间依赖性。对橄榄苦苷作用时间的分析有2点:一是该药物可能确实不具备时间依赖性;二是药物反应迅速,可能在测的第一个时间点24 h前就已逐步达到最大作用效应。这一结果的出现给未来橄榄苦苷运用临床治疗卵巢癌患者时,可能不需要考虑药物反应时间即可维持稳定的作用强度。
对该实验的具体作用机制提出以下2种设想:橄榄苦苷与雌二醇(E2)具有相同的芳香环结构,这种相似的化学结构导致橄榄苦苷可有微弱的植物雌激素作用或可竞争性结合雌激素受体起拮抗作用。有研究称植物雌激素可以改变基因的表达,使抑癌基因和促癌基因的表达发生改变,从而表现出预防肿瘤和抑制肿瘤生长的作用[9],如橄榄苦苷可同时通过延缓乳腺癌细胞周期S期(在细胞生长分裂时延缓细胞DNA的合成)、上调细胞周期蛋依赖白性抑制剂p21、抑制抗凋亡和促增殖的NF-KB蛋白及抑制主要致癌的靶细胞周期蛋白D1共同对细胞增殖起到强烈的抑制作用[10]。其次研究证明橄榄苦苷通过抑制与乳腺癌肿瘤细胞失控相关的雌激素依赖的ERK1/2 快速信号的激活[11],从而在乳腺癌细胞增殖中起到化学预防抑制作用。通过对本实验SKOV3细胞生长曲线观察,我们推测卵巢癌与乳腺癌同为激素依赖性肿瘤,橄榄苦苷可能通过延缓SKOV3细胞DNA的合成等以上作用途径使细胞的生长周期延长从而表现出增殖抑制效果。
橄榄苦苷水解后生成游离的羟基酪醇(hydroxytyrosol,HT)[12],实验表明HT可通过调节亲癌和抑癌信号通路阻滞肿瘤细胞的循环及诱发其凋亡[13-15],包括乳腺癌MCF-7细胞[16]、HL60白血病细胞[17]、黑色素瘤细胞[18]、结肠癌细胞[17,19-20]。实验发现在结肠癌细胞中HT通过缩短表皮生长因子受体(epidermal growth factor receptor,EGFR)的半衰期来加速EGFR的降解,而EGFR在细胞中表达下降可抑制肿瘤细胞的增殖[21]。卵巢癌细胞中存在多种原癌基因和抑癌基因,并且有60%以上的卵巢上皮性癌存在EGFR的过度表达[22]。因此我们推测,橄榄苦苷对卵巢癌SKOV3细胞增殖的抑制作用也可能是通过水解后生成HT,通过HT对细胞中原癌基因或抑癌基因的调节如下调EGFR从而抑制肿瘤细胞的增殖。以上两种机制推断均有待于下一步实验研究证明。
综上,橄榄苦苷作为抗肿瘤药物具有广阔的前景,特别是针对妇科恶性肿瘤术后的患者,橄榄苦苷在未来临床的运用不仅能抗肿瘤,还可预防因手术造成的绝经后骨质疏松[23],在妇科方向具有绝对的优势。
