联合灌注加权和弥散加权成像鉴别毛细胞型星形细胞瘤与高级别星形细胞瘤
2018-09-04李玉萍陈群林曹代荣佘德君杨谢锋郑颖彦
李玉萍,陈群林,曹代荣,佘德君,杨谢锋,郑颖彦
毛细胞型星形细胞瘤(pilocytic astrocytomas,PA)是中枢神经系统 WHOⅠ级的良性肿瘤,治疗方法以手术切除为主,预后较好。PA的典型影像学表现为小脑半球囊性病变伴有明显强化壁结节,但部分可表现为完全实性、边界不清且伴有明显瘤周水肿,易与高级别星形细胞瘤(high-grade astrocytomas,HGA)混淆[1-7]。研究表明,灌注加权成像(perfusion-weighted imaging,PWI)和弥散加权成像(diffusion-weighted imaging,DWI)是评价脑肿瘤的快速有效的新型磁共振成像技术,可用于颅内肿瘤的鉴别诊断、胶质瘤的分级以及肿瘤预后评估等[8-12]。本研究通过回顾性分析PA与 HGA的PWI和DWI表现,探讨PWI和DWI对二者的鉴别诊断价值。
1 对象与方法
1.1 对象 收集2013年6月-2017年2月行常规MR、PWI和DWI检查,并经手术和病理证实为PA与HGA的患者共63例。PA患者22例,男性14例,女性8例,年龄中位数17.6岁(3~49岁);HGA患者41例(间变星形细胞瘤14例,胶质母细胞瘤27例),男性25例,女性16例,年龄中位数44.9岁(4~75岁)。63例均为初发病例,且均为单发病灶;均成功行DWI及PWI检查,未出现影响图像分析的严重伪影。
1.2 方法 采用Siemens Verio 3.0T超导型磁共振成像系统8通道头颅线圈对所有患者行常规MR平扫、增强和PWI、DWI扫描。常规MR扫描序列包括 横 断 位 GRE flash T1WI (TR 250ms,TE 2.48ms ),TSE T2WI(TR 6 000ms,TE 96ms),T2-FLAIR(TR 9 000ms,TE 94ms,TI 2 500ms),扫 描 野 220mm×220mm,层 厚5mm,层间距1mm。采用自旋-平面回波成像行DWI检查(TR 6 000ms,TE 60ms),翻转角90°,FOV 240mm×240mm,矩阵128×128,激励次数2,层厚5mm,层间距1mm,在相互垂直的3个方向上施加扩散敏感梯度,取 b=0s/mm2和b=1 000s/mm2。采用梯度回波-平面回波成像行PWI检查(TR 1 500ms,TE 30ms),其余参数与常规MR平扫一致,共扫描20层,每层面60个时相,共1 200幅图像,总成像时间98s,扫描至PWI第2时相时,采用高压注射器经肘正中静脉注射对比剂 Gd-DTPA,流率 3~5mL/s,总剂量按照0.1mmol/kg计算,之后再以相同流率注射20mL生理盐水。PWI扫描结束后,行横断位、矢状位和冠状位T1WI(TR 250ms,TE 2.48ms)增强扫描。
1.3 图像后处理
1.3.1 计算脑血容量值(cerebral blood volume,CBV)与相对脑血容量 值 (relative cerebral blood volume,rCBV) 将PWI图像传输至Siemens Syngo MR B19后处理工作站(版本 NUMARIS/4)的Perfusion MR软件。在图像信号强度变化最大的时相,将ROI(大小30~40mm2)置于血管层面,绘制动脉流入效应图,设定对比剂首过的时间范围(将3个时间点分别置于PWI扫描第1时相、对比剂首过之前和对比剂首过之后),利用动脉流入效应图重建CBV图。将重建出CBV图导入Mean Curve软件,以增强T1WI和T2WI为参考,选择肿瘤强化实性成分层面,将4~5个ROI(大小30~40mm2)置于CBV图肿瘤实性强化区域血供最丰富区域,从而获得肿瘤最大CBV值(CBVmax)。ROI的放置应避开肿瘤的囊变、坏死、瘤内或瘤周血管、出血、钙化等区域。此外,将4~5个ROI(大小30~40mm2)置于病灶对侧正常脑白质区,测量4~5个CBV,取平均值(CBVcon)。计算rCBV值:

1.3.2 计算表观弥散系数值(apparent diffusion coefficient,ADC)及相对ADC值(relative apparent diffusion coefficient,rADC) 应用Siemens Syngo MR B19后处理工作站(版本NUMARIS/4)行后处理。首先观察DWI图像,分析肿瘤实质的信号特点,将4~5个ROI(30~40mm2)置于肿瘤实性强化区域,寻找ADC图上呈相对低信号区域,获得病灶最小ADC值(ADCmin)。ROI的放置应避开肿瘤的囊变、坏死、瘤内或瘤周血管、出血、钙化等区域。以同样大小ROI测量对侧正常脑白质区,取得4~5个ADC后取平均值(ADCcon)。计算rADC值:
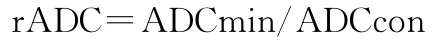
2 结 果
22例 PA 中,10例(10/22,45.5%)发病年龄>18岁;发生于幕下13例(13/22,59.1%),发生于幕上9例(9/22,40.9%)(其中2例发生于鞍上视交叉)。41例 HGA 中,发生于幕下 3 例(3/41,7.3%),发生于幕上38例(38/31,92.7%)。PA 和HGA的rCBV和rADC值比较见表1。在CBV伪彩图上,6例PA(6/22,27.3%)的灌注低于对侧正常白质区,余16例PA(16/22,72.7%)呈斑片状稍高灌注(图1A);HGA的灌注均呈明显不均匀高灌注,均高于对侧正常白质区(图1B)。在ADC图上,PA除1例外,余21例(21/22,95.5%)的信号均低于对侧正常脑白质区(图1C);HGA患者中,26例(26/41,63.4%)的 信 号 低 于 对 侧 正 常 白 质 区(图1D),15例(15/41,36.6%)等于或稍高于对侧正常白质区。ROC曲线分析结果见表2和图2,AUCrCBV和AUCrADC分别为0.97及0.92,二者差别不具有统计学意义(Z=1.112,P=0.266)。

表1 PA和HGA的rCBV和rADC值比较Tab 1 Comparison of rCBV and rADC values between PA and HGA

图1 PA或HGA患者的CBV图及ADC图Fig 1 CBV image and ADC map of PA or HGA patients

表2 rCBV和rADC值鉴别诊断PA和HGA的ROC分析Tab 2 Analysis of ROC of rCBV and rADC for distinguishing PA from HGA
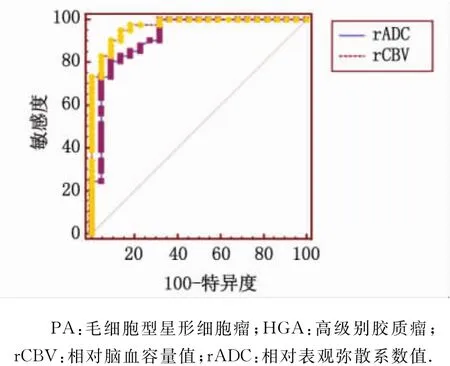
图2 rCBV和rADC鉴别诊断PA和HGA的ROC曲线Fig 2 Diagnostic performance of ROC curves of rCBV and rADC for differentiating PA from HGA
3 讨 论
PA是儿童后颅窝常见肿瘤之一,属于WHO分类为Ⅰ级肿瘤,预后良好。HGA包括间变性星形细胞瘤、间变性多形性黄色星形细胞瘤和胶质母细胞瘤,WHO分类为Ⅲ级或Ⅳ级,多发生于成人幕上,预后差。部分研究显示,PA也可发生于幕上,也可见于成人[1-2,4-7]。此外,在常规 MRI上不典型的PA也可表现为明显强化实性肿瘤伴有明显瘤周水肿,与HGA鉴别困难。本研究中,10例PA发生于成人(年龄>18岁),9例PA发生于幕上脑实质,表现为明显强化,容易误诊为HGA。
目前大多数研究均将WHOⅠ级PA和Ⅱ级的弥漫型星形细胞瘤归纳为低级别胶质瘤,与HGA鉴别;或者仅仅针对弥漫型星形细胞瘤和高级别胶质瘤进行鉴别诊断。然而弥漫型星形细胞瘤是一种弥漫生长的低级别胶质瘤,增强均无明显强化,与高级别胶质瘤的不均匀强化形成强烈对比[13-16]。而PA虽然是良性肿瘤,但在常规MRI上PA增强一般表现为明显强化,与高级别胶质瘤类似。目前,PWI和DWI作为新兴的磁共振诊断成像技术,已常规应用于颅内肿瘤的鉴别诊断及胶质瘤的分级[12-16]。因此,本研究使用PWI和DWI单独对PA和HGA进行对比研究。
PWI是研究正常器官和病变组织的血流灌注情况的一种功能成像,对术前鉴别诊断胶质瘤以及胶质瘤的分级具有重要临床意义。rCBV是PWI的一个常用的血流动力学参数,主要反映组织内的新生微血管数量。研究显示,rCBV可以用于准确对胶质瘤进行分级诊断[15-17]。本研究结果显示,PA的rCBV值明显低于HGA,差别有统计学意义(P<0.01),与文献报道一致[13,17]。PA含有肾小球样或血管瘤样新生肿瘤血管,HGA含有新生肿瘤血管、形态扭曲、结构不成熟且通透性高[17]。PA与HGA在MR增强上的强化均与新生血管有关。Uematsu等发现,PA间质里血管稀少,而在HGA间质里发现大量血管,故HGA的平均血管密度指数高于PA;且根据电镜对内皮细胞间质联接的研究发现,PA与 HGA的血脑屏障完整性相似[18]。而脑肿瘤常规MR的强化程度与肿瘤血管的丰富程度、肿瘤血管发育情况及病变有无血脑屏障或血脑屏障受损等有关。Uematsu等的这2个发现从组织病理学上解释了PA与HGA在MR增强表现相似、而PWI不同的原因。因此,笔者认为,rCBV是鉴别诊断PA和HGA的有效指标,即相对于正常脑白质区,PA呈稍低或稍高灌注,而HGA呈较明显高灌注。
DWI是通过检测人体组织中水分子扩散运动受限制的程度等信息,从而反映组织的内部结构信息、病理生理状态下各组织间水分子交换的功能状况。ADC值是其量化指标,通过反映肿瘤的细胞密度判断肿瘤的良恶性。有文献报道,ADC值与细胞密度和肿瘤的良恶性有很高的相关性,恶性肿瘤的细胞密度越大,ADC值越低,而良性肿瘤ADC值则相对偏高[14,16]。因此,肿瘤组织的最低 ADC值的区域相当于肿瘤组织最高的细胞构成区域,代表了肿瘤分化的最高级别。此外,由于坏死区的ADC值会出现假性增高,本研究亦选择避开坏死区,采用实性强化部分的最小ADC值进行分析,并与对侧正常脑白质对比,计算出rADC值,从而消除个体差异。本研究结果显示,PA的rADC值明显高于HGA(P<0.01)。PA是 WHO Ⅰ级良性肿瘤,肿瘤细胞密集程度不如高级别胶质瘤,因此PA在DWI上呈等或稍低信号,而高级别胶质瘤多为稍高或明显高信号。
本研究ROC曲线结果显示,rCBV和rADC值均能准确、定量鉴别PA和HGA,且二者的诊断效能无明显差别。
综上所述,PWI和DWI有助于术前鉴别诊断PA和HGA,其量化指标rCBV、rADC是鉴别诊断PA与HGA的有效指标。
