马MC1R基因多态位点与毛色相关性分析
2018-09-04赵珊珊李志鹏潘庆杰石德顺刘庆友
赵珊珊,肖 宁,李志鹏,潘庆杰,李 桢,石德顺,刘庆友*
(1.广西大学,亚热带生物资源保护与利用国家重点实验室,南宁 530004;2.青岛农业大学动物科技学院,青岛 266109)
马的毛色是根据覆盖马全身的短毛以及鬃毛、鬣毛、尾毛和距毛的颜色来综合评定[1]。马的毛色是马品种鉴定的重要参考之一,如荷兰的弗里斯兰马,其纯种马极少具有除黑毛以外的其他杂色毛,在进行血统登记时仅允许前额有小星。另外马的毛色还与马的用途、营养健康状况、性格及行为有关[2]。在现代马场马术用马交易中,毛色较好的马匹其价格也相应会高不少。当马作为宠物和游乐场用马,特殊的毛色更能够得到消费者的喜爱,从而给马主带来更好的效益。马的毛色形成主要与酪氨酸源性色素有关,其代表是黑色素及其衍生物[3]。黑色素主要包括真黑色素和褐黑色素两大类,黑色素的种类和含量不同,动物毛发的颜色也会不同,真黑色素和褐黑色素比例决定了毛色的深浅程度[4]。多种基因调控黑色素的产生,外界环境对黑色素的产生也具有明显影响[5]。黑色素皮质素受体1(melanocortin 1 receptor,MC1R)基因是控制黑色素形成的主要基因之一[6]。MC1R在哺乳动物中由E位点(extension locus)编码,是黑色素皮质受体(melanocortin receptors,MCRs)家族成员之一。MC1R只有一个编码区,是编码G蛋白耦合受体中最小的,是具有7个跨膜结构域的蛋白质[7]。马MC1R基因位于3号染色体,全长1 721 bp,外显子长954 bp,编码317个氨基酸。
本研究采用DNA测序和PCR-RFLP方法对马的MC1R基因多态位点进行检测,并进行毛色相关性分析,为马毛色育种提供理论依据。
1 材料与方法
1.1 试验动物
本研究从山东青岛、广西柳州和南宁共6个马场,随机采集10种毛色(分别为黑毛、骝毛、栗毛、白毛、青毛、黑毛白花、骝毛白花、栗毛白花、斑毛、沙毛)涉及15个品种共132匹马颈静脉血,血样于-80 ℃ 条件下保存。
所采集样本中单色毛共有88匹马,复色共有44匹马,比例较大的4种毛色依次是骝毛(48匹)、栗毛(28匹)、青毛(24匹)和骝白花毛(13匹)(表1)。

1.2 主要器材及试剂
医用一次性真空抗凝(EDTA)采血管购于江苏宇力医疗器械有限公司;ExTaqI购于NEB(北京)有限公司;金牌Mix(green)PCR预混液购于北京擎科生物科技有限公司;全血基因组DNA提取试剂盒购于北京艾德莱生物科技有限公司。
1.3 试验方法
1.3.1 全血基因组DNA的提取 按照全血基因组DNA提取试剂盒试验说明提取马全血基因组DNA,并溶于DNA溶解液中,用紫外分光光度仪检测全部样本DNA溶液纯度(OD260 nm/OD280 nm=1.8~2.0)和浓度,测得样本均能够满足试验要求,-4 ℃保存备用。
1.3.2 引物的设计与合成 根据GenBank公布的家马MC1R基因序列(GenBank登录号:AF288357.1),设计两对引物扩增MC1R序列,Primer 1引物扩增片段包含现有文献报道的c.C248T 和c.G250A突变位点,Primer 2引物扩增片段包含MC1R的完整外显子。引物Primer 1和Primer 2均由生工生物工程(上海)股份有限公司合成,引物序列见表2。
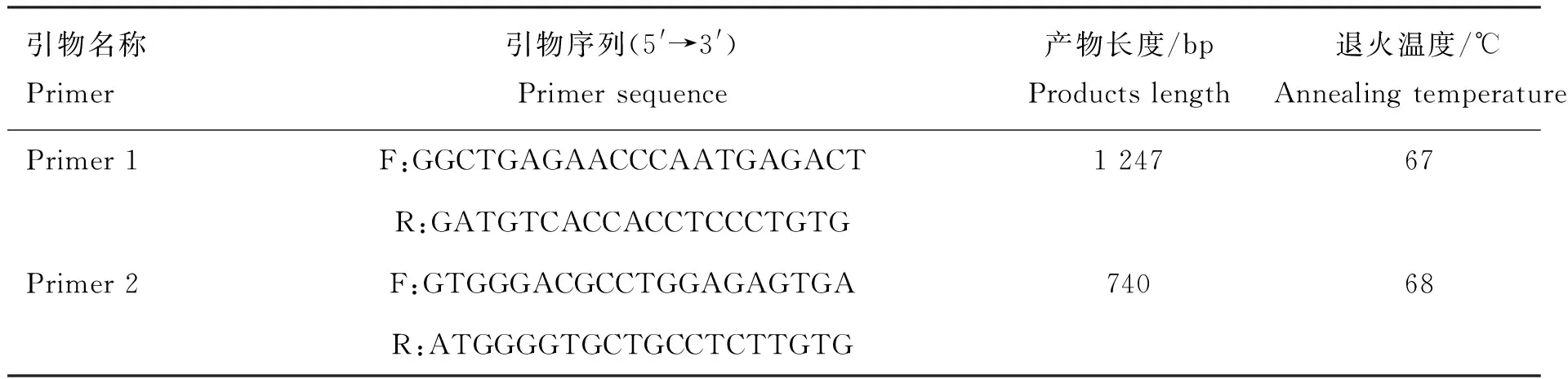
表2 MC1R引物序列
1.3.3 PCR扩增、PCR-RFLP及测序 Primer 1 PCR 反应体系(50 μL):45 μL金牌Mix,Primer 1上、下游引物各2 μL,DNA模板1 μL。反应条件:98 ℃ 预变性2 min;98 ℃变性15 s,67 ℃退火30 s,72 ℃延伸20 s,35个循环;最后72 ℃ 延伸3 min。PCR产物用1%琼脂糖凝胶电泳检测,电压120 V,时间为30 min,凝胶成像仪拍照。将PCR扩增产物送至昆明擎科生物科技有限公司进行测序。采用DNASTAR.Laser-gene v7.1软件的SeqMan工具对测序结果进行拼接,BLAST比对,并分析其多态性。
Primer 2 PCR 反应体系B(25 μL):22 μL金牌Mix,Primer 2上、下游引物各1 μL,DNA模板1 μL。反应条件:98 ℃预变性2 min;98 ℃ 变性15 s,68 ℃退火20 s,72 ℃延伸10 s,35个循环;最后72 ℃延伸3 min。PCR产物用1.5%琼脂糖凝胶电泳检测,电压为120 V,时间为30 min,凝胶成像仪拍照。
RFLP:利用限制性内切酶TaqⅠ消化Primer 2的PCR扩增产物,酶切体系:PCR产物5 μL,内切酶TaqⅠ 0.5 μL,buffer 2 μL,ddH2O 12.5 μL,65 ℃ 30 min。酶切产物用2%琼脂糖凝胶电泳检测,电压140 V,时间20 min,凝胶成像仪拍照。

从NCBI GenBank数据库中得到公开数据,登录号为驴KJ126713,斑马JF718957,普氏野马JF718951,家马AF288357,亚洲貘JF718949,苏门答腊犀牛JF718943,牛BTU39469,印度水牛KR869113,骆驼KU179868,羊驼EU220010,山羊FM212940,绵羊KF198511,野猪AY916521,家猪KF242528,家兔FN658679,大猩猩AY205088,智人AY225228。应用软件MEGA 5用相邻连接方法(NJ,neighbor joining)建立MC1R系统发育树。
本研究所用主要分析软件和网站:PCR引物设计软件为Oligo 6;同源性分析软件为DNAstar;凝胶成像图像处理软件为Image Lab;预测蛋白结构三维图像网站为https://zhanglab.ccmb.med.umich.edu/I-TASSER/;蛋白结构三维图像分析处理软件为PyMOL;蛋白结构预测网站为https://swissmodel.expasy.org/,http://www.cbs.dtu.dk/services/TMHMM-2.0/,https://embnet.vital-it.ch/software/TMPRED_form.html,https://web.expasy.org/protscale/。
乍一听“平地一声雷”这个菜名,我满头雾水,同时也感到非常好奇:什么样的菜肴,会在餐桌上爆出雷一般的响动呢?而且还是“平地一声雷”——瞬间,便发生了奇异的变化!带着这个疑问,我和朋友进了南京一家知名的饭店,专门点了这道“平地一声雷”!
2 结 果
2.1 马MC1R基因CDS扩增与测序分析
使用Primer1引物扩增试验样本的MC1R基因序列,通过1%琼脂糖凝胶电泳检测PCR产物(图1),结果显示,1 200~2 000 bp之间有一条清晰的特异性条带,与预期扩增片段长度(1 247 bp)一致,符合后续试验的要求。

1~15. PCR扩增产物;M.DNA 相对分子质量标准;C.对照组1-15.PCR products;M.DNA marker III;C.Control group图1 马MC1R基因的PCR扩增产物Fig.1 PCR amplification of MC1R of horse
对132匹马MC1R基因的PCR扩增产物进行双向测序分析发现,马MC1R基因CDS存在两处错义突变c.C248T和c.G250A,一处同义突变c.G102A。其中c.C248T由TCC突变为TTC,造成第83位氨基酸由极性亲水丝氨酸变为非极性疏水苯丙氨酸,该突变导致MC1R基因出现EE、Ee和ee 3种基因型(图2 A、2B和2C)。错义突变c.G250A由GAC突变为AAC,其位点由天冬氨酸变为天冬酰胺,该突变导致出现MC1R基因型eea,测序峰图结果见图2D。图2E为c.102野生型测序峰图,图2F为同义突变c.G102A的测序峰图。
2.2 MC1R基因c.C248T位点的 PCR-RFLP分型验证
测序分析发现,MC1R基因在外显子发生的c.C248T 突变产生了TaqⅠ酶切位点,因此可依据酶切试验对马MC1R基因的c.C248T位点的基因分型进行验证。设计特异性引物Primer 2扩增获得试验样本的MC1R基因片段,通过2%琼脂糖凝胶电泳检测PCR产物,结果显示,700~900 bp之间有一条清晰的特异性条带,与预期扩增片段(740 bp) 长度一致。对PCR产物进行TaqⅠ酶切,通过2%琼脂糖凝胶电泳得到3种基因型(图3)。本试验结果显示,样本中EE基因型有31个,Ee基因型有66个,ee基因型有35个,与CDS测序结果不一致,经分析发现,在出现c.G250A后,不再构成TaqⅠ酶切位点,因此17、82和102号3匹马样本DNA的PCR扩增片段在PCR-RFLP试验中不能全部被TaqⅠ酶切开(图4)。

A.EE; B.Ee; C.ee; D.eea; E.c.102野生型; F.c.G102A同义突变A.EE; B.Ee; C.ee; D.eea; E. c.102 wild type; F.c.G102A synonymous mutation图2 MC1R基因多态位点测序峰图Fig.2 Gene sequencing of polymorphic sites in MC1R

C.对照组;M.DNA相对分子质量标准。EE型. 1,5,7,13,16;Ee型. 2,3,6,8,9,12,14,15,17,19;ee型. 4,10,11,18C. Control group; M.DNA Marker II. EE. 1,5,7,13,16; Ee. 2,3,6,8,9,12,14,15,17,19; ee. 4,10,11,18图3 MC1R基因PCR扩增产物的PCR-RFLP结果Fig.3 PCR-RFLP results of PCR amplification products of MC1R
2.3 马MC1R基因多态性与毛色相关性分析
根据测序统计132匹样本基因型与毛色比例,Ee基因型的样本数量最多,有63匹,基因型EE和ee的样本数量相差不大,分别为31和35匹。骝毛马、黑毛马和骝白花毛马的基因型为EE和Ee两种。青毛马、白毛马在EE、Ee和ee 3种基因型中都有分布。栗毛马和栗白花毛马只有ee基因型;黑白花毛马只有EE基因型;沙毛马只有Ee基因型。另外,基因型eea包括2匹栗毛马和1匹青毛马。由此可知,在生产中若想获得栗毛马,其父母必须均携带MC1R等位基因e;如果其父母均不是栗毛且从未生产过栗毛后代,则需要对其基因型进行鉴定,而两匹栗毛马的后代在不发生基因突变的情况下一定是栗毛马。为进一步比较分析,我们下载增加了Rieder等[8]和Wagner和Reissmann[9]、李蓓和芒来[10]等研究者公开发表的与本研究相关的数据后进行整合统计分析(表3)。通过对MC1R基因外显子c.C248T 位点产生的基因型和等位基因频率的分析,X2适合性检验结果表明,黑毛和骝毛马的基因型分布差异极显著(P<0.01),在遗传上出现了Hardy-Weinberg不平衡,E为优势等位基因;在栗色马中未检测到E等位基因,e为优势等位基因;青毛马的该位点处于Hardy-Weinberg平衡;其他毛色数据量较小,未做进一步分析;各毛色合计分析,在遗传上处于Hardy-Weinberg平衡,且等位基因频率相当。

17、82、102号基因型为eea;16、90号基因型为ee;M. DNA相对分子质量标准17,82,102.eea;16,90.ee;M. DNA marker Ⅱ图4 17、82、102号样本Taq I酶切电泳Fig.4 The Taq I enzyme digestion electrophoresis of No.17,82,102 samples
2.4 马MC1R基因蛋白结构预测与分析
2.4.1 马MC1R基因蛋白二级结构预测 通过在线网站预测马MC1R基因编码蛋白的氨基酸亲、疏水性和二级结构等蛋白基本信息,根据预测结果绘制得到马MC1R蛋白二维结构图,发现马的MC1R基因编码蛋白突变位点主要位于第2个跨膜结构域,靠近细胞膜内侧(图5)。
2.4.2 马MC1R基因c.C248T突变结构预测分析 通过软件处理预测同源模型后得到MC1R蛋白α螺旋细节图(图6),因MC1R基因外显子发生c.C248T错义突变导致MC1R第83位氨基酸由极性亲水氨基酸变为非极性疏水氨基酸(pro.S83F),疏水作用力发生改变;发生突变后,与第83位氨基酸有氢键作用的氨基酸数量和位置发生变化,其与周边氨基酸之间作用的氢键减少一个,即该处突变导致其与第三跨膜区的第127位氨基酸丝氨酸之间的氢键消失,致使与其作用的氢键只分布在本跨膜区。由此可以推测,该处突变可能导致第一跨膜区与第三跨膜区距离发生变化,影响MC1R蛋白整体结构,从而使MC1R蛋白功能受到影响;另外,该处蛋白α螺旋结构维持力量的减弱,可能致使α螺旋结构较之前松散,处于该突变之前的α螺旋结构位置改变,有可能部分突出细胞膜进入细胞内,从而引起MC1R蛋白功能发生变化。
2.4.3 马MC1R基因c.G250A突变结构预测分析 在马MC1R的CDS测序结果中发现,有3个样本在c.C248T的基础上,在第250 bp处发生错义突变,由GAC变为AAC,该突变导致MC1R第84位氨基酸由极性带负电荷的天冬氨酸变为极性不带电荷的天冬酰胺(pro.D84N)。通过PyMOL处理预测同源模型后得到MC1R蛋白α螺旋细节图(图7),在第84位氨基酸发生突变后,与其相作用的氨基酸位置发生变化,新增了3个氢键分别作用在第一跨膜区的第56位氨基酸和第7跨膜区的第294位氨基酸;另外,在发生突变后,离子键作用力也发生了改变,侧链由原来倾向于排列在蛋白质表层与水发生反应变为中性氨基酸,不带电荷。
2.4.4 马MC1R蛋白pro.S83F、pro.D84N突变结构综合预测分析 将MC1R蛋白野生型和pro.S83F、pro.D84N一起对比后发现,在出现pro.D84N后,第83、84位氨基酸与周围氨基酸作用的氢键数量增加,氨基酸之间作用力复杂,与只出现pro.S83F相比较,与第三跨膜区的第127位氨基酸丝氨酸之间的氢键又出现,并且还增加了与第一跨膜区和第7跨膜区之间的作用(图8)。可以推测,该处突变在新增的3个氢键的作用力下,有可能会缩小pro.S83F对MC1R蛋白整体结构的影响。
2.5 MC1R基因系统发育树分析
3 讨 论
本试验采用PCR-RFLP和DNA克隆技术研究了马MC1R基因与毛色表型性状的相关性,结果显示,马MC1R基因CDS 248和250 bp两处发生非同义突变。在PCR-RFLP试验中,由于MC1R基因CDS 250 bp处发生非同义突变,造成该c.C248T酶切试验呈现假阴性结果,与Wagner和Reissmann[9]的报道相符。对马MC1R多态性与马毛色表型做统计分析得出,黑毛和骝毛马具有EE和Ee两种基因型,栗毛马有ee和eea两种基因型,青毛马有EE、Ee、ee和eea4种基因型。花马是在原有底色上出现了白色斑块[11-12],因而MC1R基因型与其底色相同。该结果对马的毛色分子育种提供了理论依据,对现代马的毛色定向繁育具有重要指导意义。

图中标示的两处为测序结果中出现突变的第83、84位氨基酸位置The pointed out spheres in the picture are the 83rd, 84th amino acids in the sequencing results图5 马MC1R 蛋白跨膜示意图Fig.5 The MC1R transmembrane regions of horse

A.第83位氨基酸为色氨酸;B. 第83位氨基酸突变为苯丙氨酸A.The 83rd amino acid is tryptophan; B. The 83rd amino acid is mutated to phenylalanine图6 MC1R蛋白第83位氨基酸氢键图Fig.6 Hydrogen bond diagrams of MC1R protein at the 83rd amino acid

A.第84位氨基酸为天冬氨酸;B. 第84位氨基酸突变为天冬酰胺A .The 84th amino acid is aspartic acid; B.The 84th amino acid is mutated to asparagine图7 MC1R蛋白第84位氨基酸氢键图Fig.7 Hydrogen bond diagrams of MC1R protein at the 84th amino acid
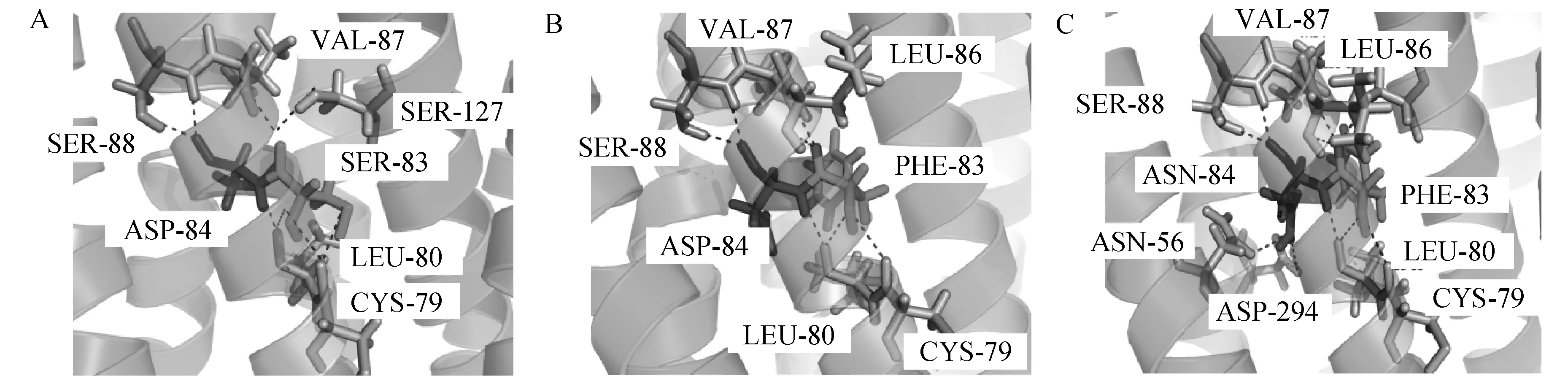
A.野生型第83、84位氨基酸氢键图;B. 第83位氨基酸突变为苯丙氨酸后第83、84位氨基酸氢键图;C. 第83位氨基酸突变为苯丙氨酸、第84位氨基酸突变为天冬酰胺后氢键图A .Wild type 83rd, 84th amino acids hydrogen bond diagram; B. The 83rd, 84th amino acid hydrogen bond diagram when the 83rd amino acid is mutated to phenylalanine; C.The hydrogen bond diagram when the 83rd amino acid is mutated to phenylalanine, the 84th amino acid is mutated to asparagine图8 MC1R蛋白第83、84位氨基酸氢键图Fig.8 Hydrogen bond diagrams of MC1R protein at the 83rd and 84th amino acids
维持蛋白质三级结构的非共价作用力主要有氨基酸的疏水作用、离子键、氢键、范得华力[13]。疏水作用力是蛋白与蛋白之间的主要作用力,影响蛋白之间的距离,在蛋白质分子的表面还往往有凹槽,这种地方多是配体或酶的底物结合的部位,通常就是疏水区。离子键是氨基酸侧链在生理pH条件下解离成带电荷的基团,与介质水分子发生电荷-偶极之间的相互作用,形成排列有序的水化层,从而稳定蛋白质的构象。蛋白质α螺旋则主要靠链内氢键作用力维持。在离子键与疏水作用力存在的情况下,范德华力作用相对较弱[14]。因此,氢键和疏水作用对蛋白结构的影响较大。MC1R基因外显子248 bp处突变位点位于 MC1R 蛋白第二转运膜的功能区域,推测可能导致α螺旋结构和各跨膜区相对位置发生变化。从而影响到受体配对和转移等功能,使受体细胞内cAMP浓度降低,而cAMP 能够激活酪氨酸激酶促成络氨酸酶的合成,该突变能够导致酪氨酸酶的合成减少,从而使更多的酪氨酸产物多巴醌(DQ)变为Cys-DOPA,即褐黑色素合成增多,真黑色素合成减少,从而形成栗色毛色表型[15-18]。
250 bp处突变位点使MC1R蛋白第83、84位氨基酸与周围氨基酸的作用力加强,增加了因248 bp处突变而消失的氢键,因此可能缩小了248 bp突变对MC1R蛋白结构的影响,因此推测,该基因型的马毛色可能比基因型ee的马毛色加深,这也同Wagner和Reissmann[9]的推测一致。在本试验中,未对发生G250A突变样本个体的MC1R产生真黑素、褐黑素通路中相关产物表达量进行研究,无法证明此推测。但是样本中含有数个深栗色马基因样本,测序结果显示并无c.G250A突变。另外,本研究中的一例栗毛西南马基因型为ee,与党珍等[19]研究发现的中国马品种中栗毛马基因型的试验结果不同。
根据GenBank公布的MC1R基因的多态位点进行统计,在现公布的2 257个多态位点中人类所占比例最多,其次是牛、羊和小鼠,马的则具有高度的保守性,只有2处多态位点。MC1R第二转运膜区为受体的关键区域,人、牛、小鼠、猫等哺乳动物的毛色扩展位点也位于此处[20-23]。KIT、ASIP基因对毛色表型也有决定性作用[24],青毛马的毛色与STX17和KIT有关[25-26],PAX3、MITF与马的白色及白色面积、分布有关[27],TBX3对马褐毛和非褐毛的形成具有影响[28]。另外,不同毛色马个体之间的遗传背景不同,马所处的生活环境也会影响基因型的表型度和外显率,可能导致相同的基因型可以产生不同的毛色表型。因此,马的品种、体重、性别、生活环境以及样本采集范围的局限性差异增加了相关分析的复杂性。
近年来,关于马的毛色与马其他性状相关性的研究不断深入,Hauswirth等[29]发现,有飞溅白毛的马在听力、视觉上有缺陷。Stachurska等[30]对多种毛色的纯血马及阿拉伯马进行了 QTL研究,发现马的亮毛色与E位点有相关性,他还发现,在毛色与运动能力无显著关联的情况下,人们更喜欢繁育骝毛与栗毛马[31]。2016年Jacobs等[32]最新研究发现,毛色影响马的行为与性格。在马术运动日益发展的形势下,马的毛色与其性能及性格的相关性影响着马的育种观念,这方面的研究将越来越得到人们的重视并成为马毛色研究的新方向。
本研究中,基因型EE样本与家马、普氏野马相似性最高,而样本基因型为ee和eea则与之相似性低一些。
在进化过程中,马在第四纪更新世时期最先出现的毛色主要是骝色,到公元前5000年以后出现黑毛马,直到公元前2000年左右才出现了毛色更绚丽的栗毛、Tobiano和Sabino毛色的马,因此在进化史上,栗毛的112号和82马比基因型为EE的骝毛马在基因进化树上与家马、普氏野马都同源性低些。其次与样本同源性较高的是斑马和驴,在经典分类学上,马与斑马、驴组成马属动物,而驴与斑马关系更近些。马属动物与亚洲貘、苏门答腊犀牛共同组成奇蹄目,与系统发育树显示内容相吻合。
4 结 论
本研究采用PCR-RFLP和DNA克隆技术研究了马MC1R基因与毛色表型性状的相关性,发现马MC1R基因外显子存在3个SNPs,c.G102A为同义突变,错义突变c.C248T产生等位基因e,错义突变c.G250A产生等位基因ea。骝毛马、黑毛马和骝毛白花毛马均有基因型EE、Ee。青毛马、白毛马均有基因型EE、Ee、ee。栗毛马和栗毛白花马只有ee基因型;黑白花毛马只有EE基因型;沙毛马只有Ee基因型。黑毛和骝毛马中,E为优势等位基因;在栗色马中无E基因,e为优势等位基因基因。本研究结果表明,马MC1R多态位点产生的不同基因型与马的毛色存在相关性。本研究结果为应用基因型对马的毛色进行定向选择育种奠定了基础。
