广东猪群新发非典型瘟病毒病的诊断和病毒鉴定
2018-09-04贺东生殷三鸿李锦辉苏丹萍刘博闻
贺东生,殷三鸿,石 坚, 李锦辉 ,苏丹萍,周 霞,刘博闻
(1.华南农业大学兽医学院,广东 广州 510642;2.东莞市动物疫病预防控制中心,广东 东莞 523000)
非典型猪瘟病毒是区别于猪瘟的一种新型病毒,最近3年国外才开始报道。该病临床症状表现为新生仔猪,以四肢、头部或全身出现有节奏的震颤,发病率和致死率较高,并具有传染性[1]。
2015年,Hause 等从病猪中扩增到一种新的病毒全基因组,与CSFV、牛病毒性腹泻病毒(BVDV)和边界病毒(BDV)等瘟病毒基因组的同源性很低(65%以下),证实了猪非典型瘟病毒是一种新型、高度分化的猪瘟病毒,广泛分布于美国猪体内[2],之后德国、荷兰、奥地利、巴西等多个国家先后发现猪群存在 APPV 流行[3,7-13]。我国对该病仅有少量报道[1,6-7]
近年来,随着规模化、集约化养猪业的持续发展,非典型性猪瘟(APPV)可能给养殖业带来潜在的重大经济损失。目前在国内该病尚缺乏快速有效地诊断方法和防控手段。本文是在华南地区首次报道该病并对诊断方法和病毒遗传变异进行了系统研究,报道如下。
1 材料与方法
1.1 材料
1.1.1 病料来源
本研究检测的47份猪病料(脑、心、肝、脾、肺、肾和淋巴结)于2017-2018年采自广东和华南地区多个规模化猪场的发病新生仔猪和保育猪,病猪临床表现为神经症状、全身震颤、慢性消瘦、喘气、哺乳困难、精神萎靡。病理剖检观察为多器官衰竭,淋巴结肿大并伴有出血症状,疑似为APPV感染。收集病料低温冻存后,送本实验室经无菌处理保存备用。
1.1.2 主要试剂
DNA MarkerDL2000、dNTP、Taq 酶等购自大连宝生物;pMD19-T载体、DH5α感受态细胞、质粒提取试剂盒均购自OMEGA公司;RNA提取试剂盒购自康宁公司;PrimeS-criptTMone Step RT-PCR Kit ver.2购自TaKaRa公司;引物合成由北京睿博兴科公司完成;DNA测序由华大基因公司完成。

表1 APPV及CSFV引物序列
1.1.3 培养基
氨苄青霉素(100 mg/mL)、LB液体培养基、LB固体培养基,LB选择培养基等按常规方法配制。
1.2 方法
1.2.1 样品处理
将待检病料按照1:3加入PBS缓冲液进行稀释研磨,-20 ℃反复冻融3次,12 000 r/min离心15 min后取上清液,用0.22 μm的微孔过滤器过滤除菌,置于-80 ℃保存备用。
1.2.2 病毒总RNA的提取
按 RNA提取试剂盒说明书提取病毒核酸,然后-80 ℃冰箱保存备用。
1.2.3 引物设计与合成
本实验室根据 GeneBank 所发布的序列号,选择全基因序列,运用 Primer Premier5.0 针对 E2基因设计 1 对 APPV引物。其中,CSFV E2基因引物为本实验室设计。由北京睿博兴科生物技术有限公司合成,引物序列见表1。
1.2.4 A P P V/C N/H U ANAN/201801 E2基因的PCR扩增
以病毒RNA为模板进行PCR扩增,反应体系为:2×1step Buffer 10μL,RNase Free dH2O 5.6μL,上 下 游 引 物 各 0.5μL,DNA模板 3μL,Prime Script 1 step Enzyme Mix 0.4μL。PCR 扩 增 程 序为 :50 ℃反转录 30 min ;94 ℃预变性 5 min ;94 ℃ 变 性 30 s;59 ℃ 退 火30 s ;72 ℃ 延 伸 1 min 30 s ;35 个 循环;72 ℃延伸10 min;4 ℃保存。取5μL PCR扩增产物经2%琼脂糖凝胶电泳检测,CLINX凝胶成像系统拍照观察。
1.2.5 基因的克隆和测序
将阳性PCR产物经纯化回收后与 PMD-19T载体连接,转化到大肠杆菌 DH5α感受态细胞中,涂布含氨苄青霉素(100 mg/mL)LB平板,37 ℃培养后挑单个菌落接种含氨苄青霉素(100 mg/mL)LB液体培养基,37 ℃下150 r/min摇菌培养12 h,提取质粒DNA并进行鉴定,鉴定成功的重组质粒送往华大基因公司进行测序。
1.2.6 基因序列分析
将PCR扩增获得的基因片段进行克隆、测序,利用 DNA Star和MEGA7软件处理,与GeneBank上已公布的17株APPV参考毒株(表2)和10株CSFV参考毒株(表3)的基因序列进行E2基因同源性比对及遗传变异分析。

表2 Genebank已登录的APPV参考毒株

表3 Genebank已登录的CSFV参考毒株
2 结果与分析
2.1 病料PCR 检测结果
以提取的RNA为模板,用CSFV和APPV引物分别对样品进行检测。结果所示(图1),CSFV检测结果为阴性,APPV在1 408 bp左右有明显条带,检测结果为阳性。由此说明该病毒为APPV而非CSFV。将 APPV PCR产物纯化后构建至pMD-19T质粒并进行测序,成功克隆了该病毒的目标序列,并获得 E2 段基因序列,序列长度为723 bp。
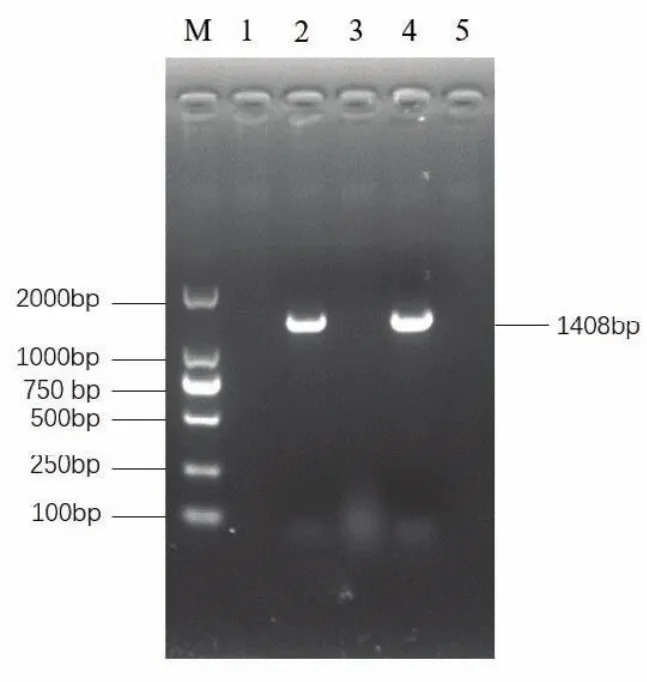
图1 APPV/CN/HUANAN/201801 E2 基因 PCR 扩增结果
2.2 APPV/CN/HUANAN/201801 E2基因的序列同源性分析
APPV 基因组ORF 区编码蛋白 由 Npro、C、Erns、E1、E2、P7、NS2、NS3、NS4A、NS4B、NS5A、NS5B 组成。在结构蛋白中,E2 是 APPV主要的保护性抗原蛋白。将APPV/CN/HUANAN/201801株E2基因测序结果在GeneBank已登录的17株APPV参考毒株(表2)与10株CSFV参考毒株(表3)进行E2基因的序列对比和同源性比较,用DNA Star进行同源性分析(图2), 结 果 表 明,APPV/CN/HUANAN/201801 E2基因与GeneBank上已公布的APPV参考毒株核苷酸序列同源性为81.3%~96.4%:其中与中国已公布毒株相比,核苷酸同源性为82.3%~96.4%;与美国毒株相比核苷酸同源性为81.3%~85.4%;与奥地利毒株相比核苷酸同源性为84.6%;与德国毒株相比核苷酸同源性为84.3%~86.9%;与荷兰毒株相比核苷酸同源性为86.5%。该毒株与中国GD1株同源性最高,为96.4%;与美国000515株同源性最低,为81.3%。与GeneBank上已公布的CSFV参考毒株核苷酸序列同源性为39.0%~41.1%。

图2 基于 APPV/CN/HUANAN/201801 E2基因的序列同源性分析

图3 基于APPV/CN/HUANAN/201801 E2基因的遗传进化树
2.3 基于 APPV/CN/HUANAN/201801株E2基因的遗传进化分析
以 表2中17株APPV毒 株和10株CSFV毒株为参考,运用 MEGA7.0 软 件 采 用 Neighbor-Joining 聚类分析方法构建基于E2基因序列的进化树(图3)。APPV/CN/HUANAN/201801 E2 与中国毒株亲缘关系较近,而与美国、奥地利、德国、荷兰毒株较远。本次鉴定毒株与国内其他毒株虽然亲缘关系较近,但单独形成一个分支,说明该病毒是APPV新成员。
3 讨论
近几年来,非典型瘟病毒(APPV)感染的发病率、致死率呈现上升趋势,给养殖生产造成了较大的经济损失。本次鉴定出的 APPV/CN/HUANAN/201801株与其他毒株不在一个分支,表明在进化过程中高度变异,这种变异给疾病的防控、检测以及疫苗的研制增加了难度。为了进一步证实APPV的致病性,我们进行了病毒分离。猪肾细胞系(PK15),猪睾丸细胞系(ST),猪原代淋巴细胞系和猪原代脾细胞系均能检测到该病毒的复制。Schwarz(2017)报道APPV可以在不同的猪细胞上分离和传代,但滴度非常低[8],病毒的持续传代培养仍未取得突破性进展。该病毒是近年来发现的一种新型瘟病毒,国内外对该病尚未开展全面的研究。由于发病率高、死亡率高、潜在损失大,需要进一步加强其生物学特性以及致病性研究,提供防控预案,减少养殖损失。
致谢:本实验是在华南农业大学兽医学院、人兽共患病防控制剂国家地方联合工程实验室、农业部兽用疫苗创制重点实验室和广东省兽用生物制品技术研究与应用企业重点实验室完成。感谢广东省生猪产业体系创新团队基金的资助。
