以对乙酰氨基酚为电催化介质同时测定谷胱甘肽和酪胺
2018-09-03张翠云
黄 颖, 陈 美, 张翠云
(福建师范大学化学与材料学院,福建福州 350007)
酪胺(TA)在生物机体的正常代谢中具有重要的生理功能。微量的TA能够刺激调节大脑皮层及其精神活动,对血管的收缩和舒张具有明显调节作用。少量的TA不会对人体产生影响,但摄入过量时会对人体产生强烈的毒副作用,严重的还会危及生命[1],因此对食品中TA的分析检测至关重要。谷胱甘肽(GSH)是生物体内主要的含巯基三肽化合物,具有解毒、防辐射、抗衰老等作用[2 - 3],研究表明其浓度与阿尔茨海默氏症、肌肉萎缩症等多种疾病有关[4 - 5],因此对GSH的分析具有重要的意义。目前对GSH和TA的单组分测定已有大量研究[6 - 12],但用电化学方法对这两种物质进行同时分离检测还未见报道。
碳纳米管和石墨烯分别是优良的一维和二维碳材料,具有极大的比表面积、良好的导电性以及优良的机械性能等特性[14 - 16]。将石墨烯和碳纳米管杂化,它们之间可以产生一种协同效应,使其表现出比任意一种单一材料更加优异的性能。本文制备了多壁碳纳米管/石墨烯纳米片(MWCNTs/GRs)杂化材料,将其修饰在玻碳电极(GCE)上,构建了MWCNTs/GRs/GCE。研究了以AP为媒介在MWCNTs/GRs/GCE上GSH和TA的电化学行为。
GSH在常规电极上有较高的过电位和低的电子转移速率使其直接电化学检测困难[13],因此本文采用间接电化学法,以乙酰氨基酚(AP)为电催化媒介,实现在较低电位下测定GSH,同时利用GSH和TA在电化学行为上的差异实现它们的同时测定。
1 实验部分
1.1 仪器与试剂
CHI660D电化学工作站(上海辰华仪器有限公司),三电极体系:未修饰和修饰过的GCE为工作电极,Ag/AgCl|KClsat为参比电极,铂丝电极为辅助电极;pHS-3C型精密酸度计(上海大普仪器有限公司);KQ-218型超声清洗器(昆山市超声仪器有限公司);所有实验均在室温下进行。
还原型谷胱甘肽(GSH)、酪胺(TA)购自于Sigma有限公司;对乙酰氨基酚(AP)购于百灵威化学技术有限公司;多壁碳纳米管(MWCNTs)(纯度>95%,长度1~2 μm,直径20~40 nm)购于深圳纳米技术有限公司;石墨烯纳米片(6~8 nm厚×5 μm 宽)购于Strem化学品有限公司。其他试剂均购于上海国药集团化学试剂有限公司。所有试剂均为分析纯。实验用水为二次蒸馏水。
1.2 多壁碳纳米管/石墨烯纳米片杂化材料制备
用浓H2SO4和浓HNO3(1∶1)组成的混酸分别对MWCNTs和GRs进行氧化处理。实验步骤如下:称取一定量的MWCNTs于烧杯中,加入一定量等体积的混酸后超声振荡3 h,混合物用二次蒸馏水稀释,静置5 h,倒去上层清液用微孔滤膜真空抽滤,洗至中性,所得的固体于80 ℃真空干燥得到处理后的MWCNTs。选用相同的反应条件和步骤得到处理后的GRs。取等量的MWCNTs和GRs分别放入二次蒸馏水中超声分散1 h,然后把这两种分散液混合超声3 h,得到的悬浮液在3 800 r·min-1下离心20 min,倒出上层清夜继续离心2次,得到的MWCNTs/GRs于80 ℃真空干燥。
1.3 工作电极的制备
将GCE(3 mm)依次用0.3、0.1、0.05 μm粒径的Al2O3粉抛光,依次用无水乙醇和二次蒸馏水超声清洗3 min,然后将电极浸入0.5 mol·L-1的H2SO4中,在-1~1 V的电位区间,以50 mV·s-1的扫描速率进行循环伏安扫描直至伏安曲线稳定。称取1 mg MWCNTs/GRs加入到1 mL DMF溶液中,超声分散约0.5 h即得MWCNTs/GRs分散液,取5 μL滴涂到处理好的GCE表面,在空气中自然晾干得到MWCNTs/GRs/GCE。
1.4 实际样品的制备
根据文献方法[17],取等体积的澳牛牛奶和50 mmol·L-1的乙酸溶液混合,在3 000 r·min-1的条件下离心分离20 min,取上清液待用。
2 结果与讨论
2.1 透射电镜表征
如图1所示,采用透射电镜(TEM)对酸化后的MWCNTs和MWCNTs/GRs杂化材料进行了表征。从图1(a)可以看出,混酸处理后的MWCNTs长度较长,彼此之间会互相缠结。图1(b)为MWCNTs/GRs杂化材料的TEM图,从图中可以清晰看出石墨烯有明显的较薄片层,MWCNTs小部分有团聚,大部分嵌插在石墨烯片层中。
2.2 不同工作电极的电化学特征
考察了GCE(a),GRs/GCE(b),MWCNTs/GCE(c),MWCNTs/GRs/GCE(d)在1 mmol·L-1的[Fe(CN)6]4-/3-+0.5 mol·L-1KCl溶液中的循环伏安(CV)行为。如图2所示,曲线a为GCE的CV曲线,其氧化还原峰电位差(ΔEp)为78 mV,曲线b和c分别为GRs/GCE 与MWCNTs/GCE CVs曲线,与曲线a相比ΔEp都减小,峰电流也明显增大。曲线d为MWCNTs/GRs/GCE的CVs曲线,由曲线d可知,MWCNTs/GRs修饰GCE后ΔEp进一步减小,峰电流又进一步提高。实验结果表明MWCNTs/GRs作为修饰材料可以有效加快电极表面的电子传递速率。为进一步考察修饰电极的电化学性能,用交流阻抗法测定了这4种电极在1 mmol·L-1[Fe(CN)6]4-/3-+0.5 mol·L-1KCl溶液中的交流阻抗图。如图2插图所示,交流阻抗曲线的半径从大到小依次是GCE>GRs/GCE>MWCNTs/GCE>MWCNTs/GRs/GCE,由此可知MWCNTs/GRs具有优良的电化学性能。
2.3 GSH的电催化氧化行为
在不同条件下,采用CV法研究了AP作为电催化介质对GSH的电催化氧化效果。由图3可知,GCE(a)和MWCNTs/GRs/GCE(b)在0.1 mol·L-1磷酸盐缓冲溶液(PBS,pH=6.5)中无氧化还原峰,加入40 μmol·L-1GSH后,GCE(c)和MWCNTs/GRs/GCE(d)在实验研究的电位范围内也未出现氧化还原峰,说明GSH在这两种电极上无明显电化学响应。向上述溶液中加入25 μmol·L-1AP,GCE(e)上出现了氧化峰,MWCNTs/GRs/GCE(g)上出现了明显的氧化还原峰,说明AP在MWCNTs/GRs/GCE上具有良好的电化学活性。继续加入40 μmol·L-1GSH,GCE(f)上氧化峰电流增大,MWCNTs/GRs/GCE(h)上氧化峰电流明显增大,还原峰电流减小,说明在MWCNTs/GRs/GCE上AP对GSH有明显的电催化作用。

图2 不同电极的循环伏安(CV)曲线(插图:不同电极的交流阻抗图)Fig.2 CV curves of different electrodes(Inset:Nyquist plots of different electrodes)solution:1 mmol·L-1[Fe(CN)6]4-/3-+0.5 mol·L-1 KCl;scan rate:100 mV·s-1;frequency range:0.1 - 105 Hz;a.GCE,b.GRs/GCE,c.MWCNTs/GCE,d.MWCNTs/GRs/GCE.

图3 不同条件下的循环伏安(CV)曲线Fig.3 CV curves (a) in the absence and(c) presence of 40 μmol·L-1 GSH in 0.1 mol·L-1 PBS (pH=6.5) at GCE.(b) as (a) and(d) as (c) at MWCNTs/GRs/GCE,respectively.CVs of GCE,MWCNTs/GRs/GCE with 25 μmol·L-1 AP(e,g) in the absence and(f,h) presence of 40 μmol·L-1 GSH in 0.1 mol·L-1 PBS(pH=6.5).Scan rate:100 mV·s-1.
2.4 GSH和TA的伏安行为
如图4所示,采用CV法考察了TA与GSH混合溶液的CV行为。图中曲线a和曲线b分别代表在GCE和MWCNTs/GRs/GCE上,500 μmol·L-1TA与40 μmol·L-1GSH的混合溶液在10 μmol·L-1AP条件下的CV曲线,可以看到MWCNTs/GRs/GCE(b)上的氧化峰电流比GCE(a)明显增大,ΔEp也随之增大。说明MWCNTs/GRs能有效地增大电流响应,且可以使TA和GSH的氧化峰很好的分离。图中曲线c是在MWCNTs/GRs/GCE上,500 μmol·L-1TA与40 μmol·L-1GSH的混合溶液在没有AP时的CV曲线,与曲线b相比可知AP对TA没有电催化作用。
2.5 pH的影响
采用CV法考察了溶液pH值对GSH和TA电化学行为的影响。如图5所示,GSH和TA的氧化峰电流均在pH为6.5时达到最大值,并且GSH和TA的氧化峰电位差几乎不受溶液pH值影响,保持在0.3 V左右。故选择pH=6.5溶液为电解质溶液。
2.6 重现性、稳定性和选择性
用同一根MWCNTs/GRs/GCE在含40 μmol·L-1GSH,500 μmol·L-1TA和10 μmol·L-1AP的溶液中平行测定8次,两个峰电流值的相对标准偏差(RSD)分别为3.9%和3.7%。用5根同等条件下制备的MWCNTs/GRs/GCE在上述溶液中分别进行测定,RSD分别为4.3%和3.5%。将MWCNTs/GRs/GCE保存在4 ℃冰箱中7 d、14 d和一个月后,测得两个峰电流分别为初始电流的93.4%、92.8%,90.7%、90.1%和87.5%、88.3%。以上结果说明该电极的重现性和稳定性较好。
在500 μmol·L-1TA与40 μmol·L-1GSH的混合溶液存在10 μmol·L-1AP条件下,考察了一些常见干扰物对GSH和TA测定的干扰。实验发现,5倍浓度的抗坏血酸、多巴胺、尿酸、色氨酸、丙氨酸、甘氨酸、缬氨酸、苯丙氨酸、半胱氨酸、亮氨酸和氧化型谷胱甘肽对GSH和TA的电流响应均小于±5%,因此MWCNTs/GRs/GCE具有良好的选择性。
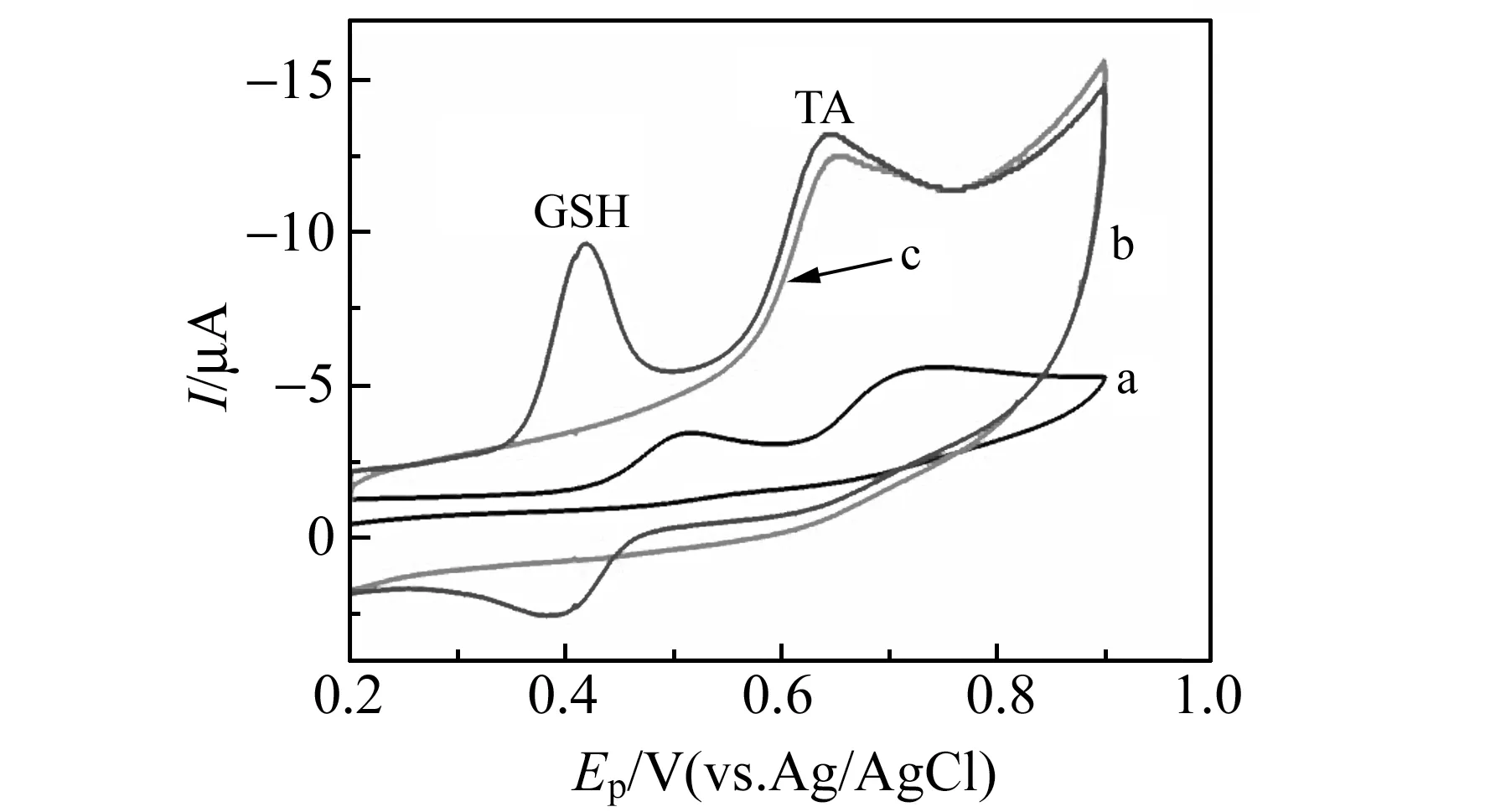
图4 GSH和TA在GCE(a)和MWCNTs/GRs/GCE(b)上的循环伏安(CV)曲线Fig.4 CV curves of 40 μmol·L-1 GSH and 500 μmol·L-1 TA in the presence of 10 μmol·L-1 AP in 0.1 mol·L-1 PBS(pH=6.5) at GCE(a) and MWCNTs/GRs/GCE(b).CV curves of 40 μmol·L-1 GSH and 500 μmol·L-1 TA in 0.1 mol·L-1 PBS(pH=6.5) at MWCNTs/GRs/GCE(c).Scan rate:100 mV·s-1

图5 pH与氧化峰电流和氧化峰电位的关系Fig.5 The effect of pH on anodic peak current and peak potential difference for 25 μmol·L-1 GSH and 500 μmol·L-1 TA in the presence of 10 μmol·L-1 AP in 0.1 mol·L-1 PBS at MWCNTs/GRs/GCE.Scan rate:100 mV·s-1

图6 (A)不同浓度GSH的差分脉冲伏安(DPV)图(插图为GSH峰电流与其浓度的关系曲线);(B)不同浓度TA的DPV图(插图为TA峰电流与其浓度的关系曲线);(C)不同浓度GSH和TA的DPV图(插图分别为GSH(a)和TA(b)峰电流与其浓度的关系曲线)Fig.6 (A)DPVs of GSH determination,from a to g:0.75,2.5,4.0,8.0,12.5,16.0,20.0 μmol·L-1 GSH in 0.1 mol·L-1 pH=6.5 PBS containing 10 μmol·L-1 TA and 5 μmol·L-1 AP at MWCNTs/GRs/GCE(Inset:plots of the peak current vs.GSH concentration);(B) DPVs of TA determination,from a to g:2.5,25.0,50.0,62.0,85.0,110.0,125.0 μmol·L-1 TA in 0.1 mol·L-1 pH=6.5 PBS containing 0.75 μmol·L-1 GSH and 5 μmol·L-1 AP at MWCNTs/GRs/GCE(Inset:plots of the peak current vs.TA concentration).(C) DPVs of GSH and TA determination for different concentrations of GSH(μmol·L-1) and TA(μmol·L-1):a 0.75,2.5;b 2.5,25.0;c 8.0,40.0;d 11.0,60.0;e 13.0,80.0;f 15.0,100.0;g 20.0,125.0 in 0.1 mol·L-1 pH=6.5 PBS containing 5 μmol·L-1 AP at MWCNTs/GRs/GCE(Inset:plots of the peak current vs.GSH concentration(a) and TA concentration(b))
2.7 GSH和TA的定量分析
在最佳实验条件下,采用差分脉冲伏安法(DPV)对GSH和TA进行定量分析。图6(A)为TA和AP保持固定浓度,GSH浓度从0.75~20 μmol·L-1变化时的DPV曲线。如图所示,TA的氧化峰电流几乎不变,GSH的氧化峰电流与其浓度呈线性关系:Ip(μA)=-0.4103-0.0454c(μmol·L-1),相关系数(R2)为0.9920,线性范围为0.75~20 μmol·L-1,检测限(S/N=3)为0.16 μmol·L-1。图6(B)为GSH和AP保持固定浓度,TA浓度从2.5~125 μmol·L-1变化时的DPV曲线。如图所示,GSH的氧化峰电流几乎不变,TA的氧化峰电流与其浓度呈线性关系:Ip(μA)=-0.2245-0.0144c(μmol·L-1),R2=0.9970,线性范围为2.5~125 μmol·L-1,检测限(S/N=3)为0.94 μmol·L-1。实验结果表明在溶液中共存时可选择性测定GSH和TA。图6(C)是在MWCNTs/GRs/GCE上不同浓度GSH和TA共存下的DPV曲线。GSH和TA的氧化峰电流与其对应浓度均呈线性关系:Ip(μA)=-0.4899-0.0454c(μmol·L-1),R2=0.9900,(GSH:0.75~20 μmol·L-1);Ip(μA)=-0.2278-0.0135c(μmol·L-1),R2=0.9988,(TA:2.5~125 μmol·L-1);计算得检测限(S/N=3)分别为0.15 μmol·L-1和0.92 μmol·L-1。综上实验所得结果,在GSH和TA共存时单一测定与同时测定时所得工作曲线的灵敏度和检测限都相差不大,进一步说明该方法可以同时测定溶液中GSH和TA的含量。
2.8 实际样品的检测
在MWCNTs/GRs/GCE上对澳牛牛奶中GSH和TA的含量进行了测定,同时进行加标回收率试验。结果如表1所示,回收率为92.0%~101.6%,表明该方法的灵敏度和准确度较高。

表1 牛奶中GSH和TA的测定(n=4)
3 结论
本文构建了MWCNTs/GRs/GCE,并实现了GSH和TA的同时检测。实验结果表明AP对GSH有良好的电催化作用。在最佳实验条件下,用DPV法测得GSH和TA的氧化峰电流与其浓度分别在浓度范围0.75~20 μmol·L-1和2.5~125 μmol·L-1内呈线性关系,检测限(S/N=3)分别为0.15 μmol·L-1和0.92 μmol·L-1。将该方法应用于牛奶中GSH和TA含量测定结果满意。
