氮肥和多环芳烃对农田土壤细菌群落的影响
2018-09-03戴叶亮朱清禾曾军郑金伟吴宇澄林先贵
戴叶亮 ,朱清禾,曾军,郑金伟,吴宇澄 *,林先贵
1. 中国科学院土壤环境与污染修复重点实验室(中国科学院南京土壤研究所),江苏 南京 210008;
2. 南京农业大学资源环境与科学学院/农业资源与生态环境研究所,江苏 南京 210095;3. 湖泊与环境国家重点实验室,江苏 南京 210008
自20世纪70年代以来,中国氮肥用量不断增加(张卫峰等,2013),至2011年,平均氮肥用量已达到180 kg∙hm-2(以N计),比世界平均水平高75%(China Agricultural Yearbook Editing Committee,2011)。在太湖流域稻田,每年氮素综合使用量高达 500~600 kg∙hm-2(Zhao et al.,2012)。氮肥的过量施用产生了负面环境效应,如温室气体排放(Pearson et al.,1993;Krupa,2003)、土壤酸化(周细红等,2004)、板结和水体富营养化等(Bouwmeester et al.,1985),同时也可能导致土壤微生物群落组成与功能的改变(马冬云等,2007)。氮肥可以直接刺激相关功能微生物的生长,如氨氧化细菌(AOB)、氨氧化古菌(AOA)、亚硝酸氧化细菌(Lisa et al.,2016)等。此外,过量施肥导致的土壤性质变化作用于土壤微生物整体群落结构,会产生更为深远的生态环境影响。
土壤污染是中国农业生产面临的另一重要威胁。多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是一类具有“三致”毒性的稠合苯环结构有机物(周丽虹,2010),主要来自于煤、石油等化石燃料以及一些生物质的不完全燃烧(傅家谟等,1996)。中国 PAHs年排放量达 11.4万吨(Tao et al.,2009),土壤中PAHs的点位超标率达到1.4%(环境保护部等,2014),个别点位每千克土壤含PAHs可达数万微克(Wu et al.,2016)。多环芳烃对土壤生态系统具有广泛的影响,如引起动植物死亡与突变(Staffan et al.,2007;Sverdrup et al.,2002),抑制植物生长(Maliszewska et al.,2000)等,并与微生物发生复杂的相互作用,影响微生物的多样性、组成和生理功能(Sawulski et al.,2014;Demenezes et al.,2012),同时被微生物降解(Fuchs et al.,2011;吴宇澄等,2013)等。
受施肥和污染排放的影响,一些农田土壤可能同时出现过量氮输入和PAHs污染。尽管有关其各自的微生物效应已有不少报道,但对两者叠加情况下的土壤微生物群落响应仍缺乏研究。本研究分别选择尿素和苯并[a]蒽(benz[a]anthracene,BaA)为氮肥和PAHs的代表,模拟土壤中过量施用尿素以及高浓度的BaA污染,设置土壤微宇宙试验,在测定尿素和苯并[a]蒽转化的基础上,采用高通量测序和定量 PCR方法深入解析添加污染物及施肥之后土壤细菌群落的丰度、多样性以及组成变化,结果有助于阐明农田土壤中多环芳烃和铵态氮肥的复合效应,并为探究有机污染物和氮转化间的交互作用机制提供科学依据。
1 材料与方法
1.1 样品采集
采样于2016年4月进行。供试土壤采自南京市郊某冶金企业附近的蔬菜地,采用五点采样法采集土样后充分混匀为1个混合土样,基本理化性质为:pH 6.5,有机质2.47%,总氮1.39 g∙kg-1,铵态氮 5.8 mg∙kg-1,硝态氮 6.4 mg∙kg-1,15 种优控 PAHs总量922 µg∙kg-1。土样经风干磨细后用于微宇宙培养试验。
1.2 微宇宙试验
微宇宙试验:120 mL血清瓶中装入30 g土壤(干质量),调节土壤含水量为田间持水量的60%,于黑暗的环境中(28 ℃)培养。共设置4个处理:对照处理(CK)、只添加苯并[a]蒽(A)、只添加尿素(N)、添加苯并[a]蒽和尿素(NA)。苯并[a]蒽和尿素的最终质量分数分别为100 mg∙kg-1和56 mg∙kg-1,在培养的第28天和第56天补充等N量的尿素。每个处理设置9个重复,在培养的第28天、第56天以及第84天进行破坏性取样(每个处理每次各 3个)。土壤经处理后,一部分用于 pH及无机氮测定,一部分提取DNA后用于下游分子生态分析。
同时设置一组平行土壤微宇宙试验,通过测定[7,12-14C]苯并[a]蒽(American Radiolabeled Chemicals,Inc.)的矿化量表征污染物的转化率。设置2个处理:只添加苯并[a]蒽(A),同时添加尿素和苯并[a]蒽(NA),其中苯并[a]蒽为14C和未标记的苯并[a]蒽混合物,土壤中污染物和尿素的终浓度及含水量同上所述,[7,12-14C]苯并[a]蒽添加量为2.2×105dpi∙g-1,每个处理设置 3个平行。
1.3 土壤pH和硝态氮的测定
采用酸度计测定土壤 pH(水土比 5∶1);用 2 mol∙L-1KCl溶液提取土壤无机氮,用VCl3将硝态氮还原为亚硝态氮后,采用Griess试剂法测定(Wu et al.,2013)。
1.4 多环芳烃矿化量测定
以1 mol·L-1NaOH溶液吸收CO2,采用液体闪烁计数法(Beckman-Coulter,USA)(Wang et al.,2017)测定14CO2量。每两周取样测试1次。
1.5 土壤DNA提取
采用FastDNA SPIN Kit for Soil试剂盒(MP Biomedicals)提取土壤 DNA,微量分光光度计(NanoDrop 2000)和电泳法检测DNA的质量。为避免共提取的土壤腐殖质等杂质干扰 PCR反应,DNA提取液经10倍稀释后用于下游分析。
1.6 硝化微生物功能基因定量PCR分析
参照文献方法(Cebron et al.,2008),采用定量 PCR方法测定各样品细菌和古菌单加氧酶基因(amoA)的拷贝数。定量PCR标准品的制备方法为:克隆目标基因提取质粒后测定其浓度并计算拷贝数,进行梯度稀释后绘制标准曲线(拷贝数范围102~108μL-1),定量 PCR 曲线标准 R2>0.99,扩增效率≥80%。
定量PCR采用Sybr Green方法。总反应体积为 20 μL,包含 10 μL TransStart Green qPCR SuperMix(全式金),2 μL土壤DNA和8 pmol引物。古菌amoA基因(引物序列:5’-ATG GTC TGG YTW AGA CG -3’和 5’-GCC ATC CAB CKR TAN GTC CA-3’)反应程序为:95 ℃预变性 3 min,95 ℃45 s,56 ℃退火30 s,72 ℃延伸45 s并读取荧光信号,38个循环;细菌amoA基因(引物序列:5′-GGG GTT TCT ACT GGT GGT-3′和 5′-CCC CTC KGS AAA GCC TTC TTC-3′)反应程序为:95 ℃预变性3 min,95 ℃ 45 s,53 ℃退火 45 s,72 ℃延伸 30 s并读取荧光信号,36个循环。随后进行熔解曲线分析,采用电泳分析评价其扩增单一性。
1.7 细菌16S rRNA基因高通量测序及数据分析
采用通用引物 519F和 907R(引物序列:5′-CAGCMGCCGCGGTAATWC-3′5′-TTACGACTT-3′)扩增细菌16S rRNA基因片段,其中正向引物序列中包含 5 bp的条形码(barcode)序列。PCR反应体积为50 μL,包括25 μL Taq DNA聚合酶预混液(Takara),1 μL模板(约50 ng基因组 DNA),1 μL正向及反向引物,23 μL ddH2O。PCR扩增条件为 95 ℃ 3 min,95 ℃ 45 s,56 ℃ 45 s,72 ℃60 s,35个循环。PCR产物经纯化后构建测序文库,采用Illumina MiSeq系统进行双向高通量测序(上海美吉)。
1.8 数据分析
基于QIIME分析平台进行高通量数据分析。序列经拼接、比对后在97%相似性水平划分操作分类单元(operational taxonomic unit,OTU),以此为基础计算多样性指数和非度量多维尺度分析(Nonmetric Multidimensional Scaling,NMDS)。运用R软件(vegan数据包)计算细菌群落之间的布雷距离(Bray distance),采用SPSS 19.0对数据进行单因素方差分析(ANOVA)和多重比较,用Graphpad Prism 5作图。图表中数据均为平均值±标准差。
2 结果与分析
2.1 土壤硝化和污染物矿化
随着培养的进行,4个处理微宇宙试验都出现明显的 NO3--N积累(图 1A)。两个添加尿素的处理(N和NA)硝态氮上升幅度更大,pH降低约1个单位,提示土壤硝化导致土壤酸化(图1B)。在84 d时,NA处理相对于N处理硝态氮增加缓慢,同时加入BaA(A和NA)处理相对于不加的处理(CK和N)土壤pH下降幅度有所减小。
培养过程中,14CO2持续积累,84 d矿化量约为10%(图1C)。添加尿素与否对土壤中BaA的矿化没有显著影响。
2.2 硝化微生物功能基因丰度
定量PCR检测中,硝化微生物功能基因扩增产物经熔解曲线分析和电泳分析为单一峰(条带),表明扩增不受引物二聚体或者非特异扩增影响。所有处理中,细菌 amoA基因拷贝数为1.2×107~5.6×107copies·g-1,古菌 amoA 基因拷贝数为 3.0×106~1.3×107copies·g-1。
不添加尿素的CK和A处理中,细菌amoA基因拷贝数无显著变化,N处理在28 d时显著升高而后呈现逐渐下降趋势,NA处理在28 d和56 d持续升高,但在84 d大幅度下降(图2A)。在N和CK处理中,古菌amoA基因拷贝数未发生显著变化;但添加BaA后,虽然NA处理中AOA数量在28 d有所增加,但是到56 d和84 d后,NA和A处理中古菌amoA基因拷贝数显著降低,其中84 d NA处理中AOA的数量相比于CK,降低了63%。(图2B)。
2.3 土壤细菌多样性变化
Miseq测序中,38个样品一共获得962536条16S rRNA基因序列,单个样品的序列数为17795~38255,在 97%序列相似性水平获得 5236个OTU。每个样品随机抽样17700条做OTU表,在此基础上分析土壤细菌的群落组成与多样性。
与原始土壤相比较,84 d的培养导致CK处理中细菌多样性明显降低,BaA的加入则未对土壤微生物多样性指数产生影响。添加尿素的处理中,土壤细菌群落多样性显著下降,在培养84 d时下降趋势尤为明显,Chao1指数、观测到的物种数和香农指数等均显著降低(图3)。
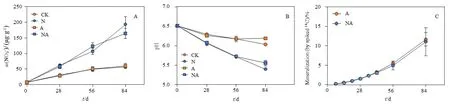
图1 微宇宙培养过程中土壤量(A)、pH(B)以及苯并[a]蒽矿化率(C)的变化Fig. 1 Changes in NO3- (A), soil pH (B) and mineralization of benz[a]anthracene (C) during the incubation n=3
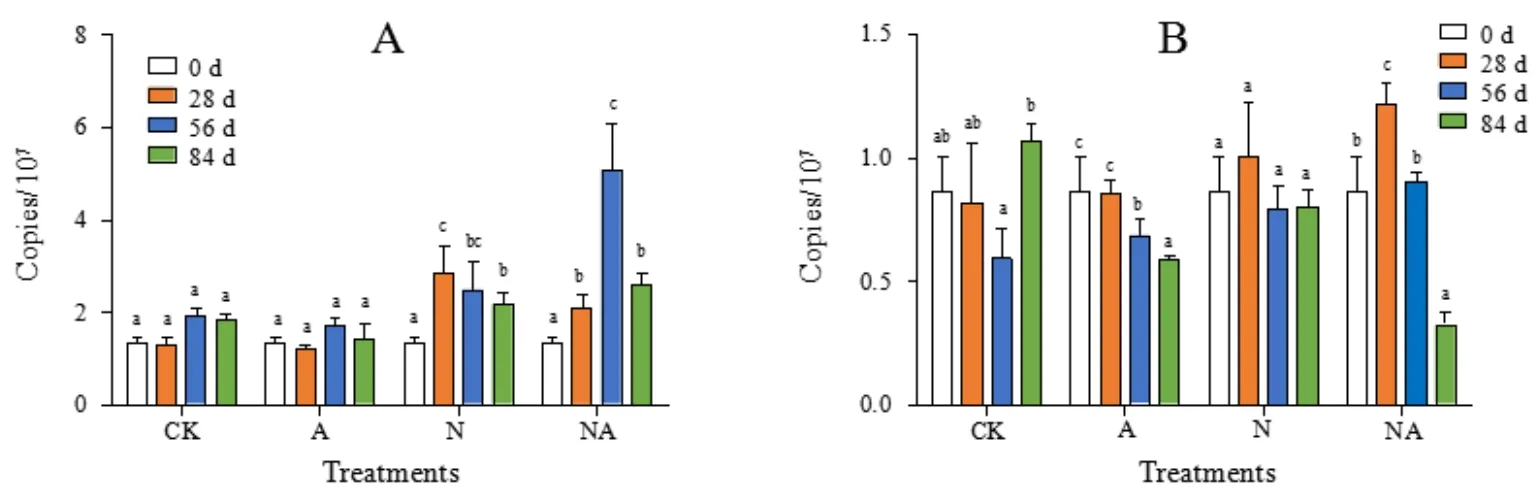
图2 培养过程中细菌(A)和古菌amoA基因(B)丰度的变化Fig. 2 Changes in the bacterial (A) and archaeal amoA gene copies (B) during the incubation
2.4 土壤细菌群落结构变化
随着培养的进行,土壤中细菌群落结构发生变化。NMDS分析(图4A)显示:28 d时,各处理土壤细菌群落相对聚集,未有明显区分;56 d起,添加尿素处理与不添加尿素处理形成了不同的细菌群落结构,N和NA处理与A和CK处理群落之间差异明显,但BaA对群落结构的影响相对较小;84 d时,细菌群落间的差异进一步增大。统计分析显示(图4B),培养28 d时,A、N及NA 3个处理与CK之间未有显著变化,到58 d加尿素处理中细菌群落结构已经与CK显著不同,而84 d时,各处理中细菌群落都有极显著变化且尿素的影响大于BaA。
在纲(Class)分类水平,土壤中相对丰度≥1%的主要细菌门类有14个(表1)。在此14个纲中,6个纲的相对丰度和土壤pH呈正相关关系,其中2个为显著相关,4个为极显著相关;4个纲和土壤pH均呈极显著负相关关系。此外,添加尿素显著增加了和土壤亚硝酸氧化相关的Nitrospirae的丰度(数据未显示)。这些结果表明,尿素很可能促进了相关的硝化微生物生长,但是土壤中细菌群落的整体变化则可能主要由尿素导致的pH变化引起。
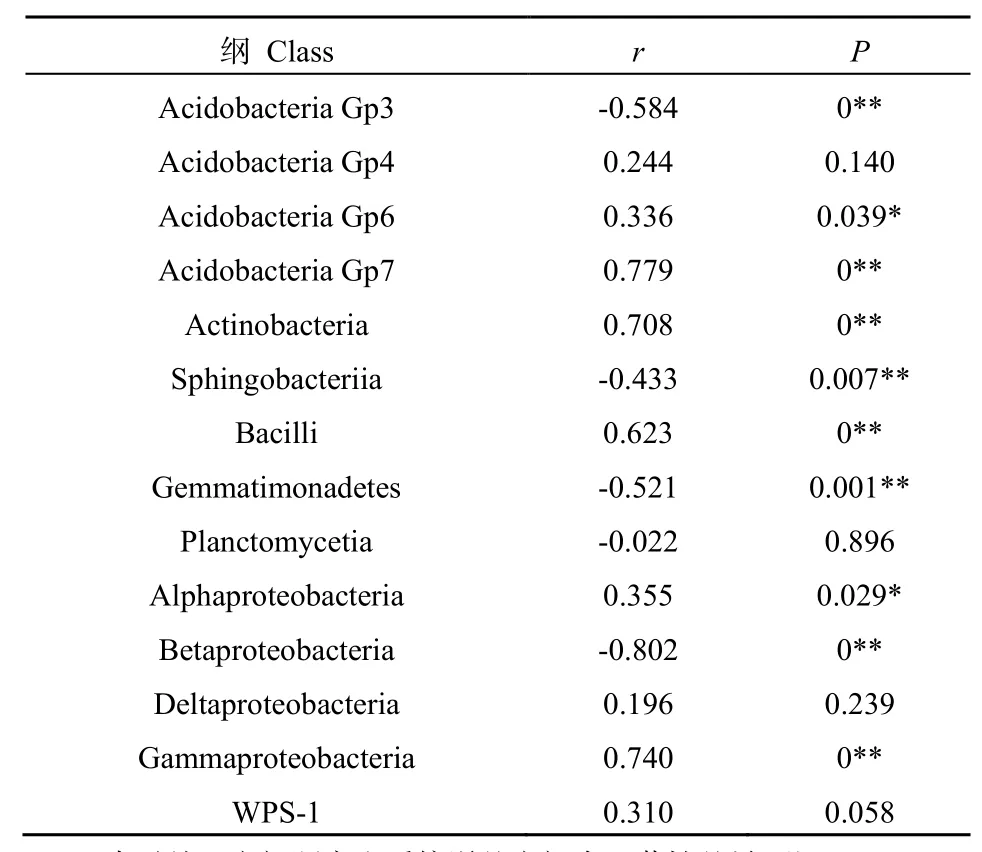
表1 纲水平土壤细菌相对丰度和pH之间相关性分析Table 1 Correlation between dominant bacterial class and soil pH

图3 培养过程中土壤多样性指数变化:Chao1指数(A)、观测到的物种数(B)、香农指数(C)Fig. 3 Change of soil diversity index: Chao 1 (A), Observed species (B), Shannon (C)
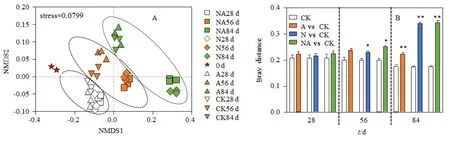
图4 土壤细菌群落间的NMDS(A)和布雷距离分析(B)Fig. 4 NMDS (A) and bray_distance (B) analysis of soil bacteria communities
3 讨论
3.1 尿素的微生物生态效应
大量研究发现,使用铵态氮肥会出现明显的硝酸盐积累同时显著降低土壤pH(Phillip et al.,1997;Bouman et al.,1995;Dlana et al.,2008)。本研究中,添加尿素处理中出现的此类现象,究其原因为底物刺激导致的土壤硝化活性增加。硝化过程由氨氧化和亚硝酸氧化两个步骤组成,其中氨氧化过程主要由氨氧化细菌和氨氧化古菌完成(Lisa et al.,2016),它们受到土壤pH值的强烈影响(He et al.,2012)。由于供试土壤为中性,氨分子浓度较高,有利于氨氧化细菌的生长,反映为相应微宇宙中细菌amoA基因拷贝数的增加;在此环境下,氨氧化古菌可能居于竞争劣势(Zhang et al.,2012),而未出现明显增殖。
土壤pH直接影响着微生物的多样性和组成结构(Wu et al.,2016;Kateryna et al.,2015;Lauber et al.,2009)。在本研究中,随着培养的进行,尤其是56 d之后,添加尿素微宇宙土壤的pH明显降低,对土壤微生物群落产生了巨大的影响。一方面,这可能导致了培养后期硝化微生物丰度的降低(图2),另一方面改变了土壤中的优势微生物(表1)、降低了土壤微生物的多样性(图3),并进一步导致细菌群落的整体变化(图4)。土壤酸化不仅影响微生物,还会导致土壤有毒重金属离子活性增加、土壤肥力降低、结构变差以及影响作物生长发育等一系列问题(Sutradhar et al.,2014;Baquy et al.,2017;Lofton et al.,2010)。本研究所模拟的施氮量与目前太湖流域部分稻田的综合施肥量相近(Zhao et al.,2012),因此,过量施用氮肥导致的土壤生态风险不可忽视。
3.2 苯并[a]蒽的微生物生态效应
有研究发现,高浓度的多环芳烃污染能显著改变土壤微生物的多样性(吴宇澄等,2016)、群落组成和生理活性(Sawulski et al.,2014;Demenezes et al.,2012)。对本研究采样区的原位调查结果显示(Wu et al.,2016;Wu et al.,2017),与 PAHs污染相比,pH是更重要的土壤微生物群落结构决定因素。本研究通过微宇宙培养所获得的结果与原位调查相似,初始质量分数为 100 mg∙kg-1的 BaA对土壤微生物多样性和微生物群落结构的影响相对较小。分析其原因,可能是由于BaA的矿化率只有10%左右(图1C),更多的污染物还是以各种形态存在于土壤中,而BaA是一种疏水性污染物,与土壤基质发生结合后,生物有效性降低。但是,长期PAHs作用的微生物群落效应依然存在。本研究中,84 d时CK与A处理下的细菌群落产生了较明显的分离(图4)。虽然目前这种改变的机制尚不清楚,但有文献报道,PAHs对微生物具有选择性(吴宇澄等,2016),导致降解功能细菌的富集与敏感细菌的下降(Cebron et al.,2008;Chen et al.,2015;Bengtsson et al.,2013);此外,许多PAHs降解的中间产物可能具有更高的生物毒性(Staffan et al.,2007),如我们发现BaA的降解中间产物苯并[a]蒽醌对一类氨氧化古菌有更强的抑制效果(Dai et al.,2018),这些中间产物也会形成一定的生态风险。考虑到 PAHs类污染物种类的多样与土壤的复杂性,需进一步探究PAHs的土壤微生物生态效应。
3.3 尿素和苯并[a]蒽对土壤微生物的交互作用
尿素和苯并[a]蒽的转化均是微生物作用的结果。土壤中氮循环和污染物降解过程是否存在相互作用,是污染生态学和污染土壤修复研究关注的重要科学问题。CO2是PAHs转化的最终形态,是污染土壤修复的最理想状态,矿化率是土壤中 PAHs修复效果的重要指标。一般而言,PAHs矿化率越高,表明解毒效果越好。本研究中,添加尿素未对BaA的矿化率产生显著影响。分析其原因,可能是由于供试土壤本身的理化性质、结构特征导致尿素或者硝化过程对 BaA的矿化影响本身就较小(Kästner et al.,1998)。但有研究发现,弱酸能够显著促进土壤中 PAHs的矿化(Bhabananda et al.,2017),硝化微生物(AOA)具有降解芳香性污染物的能力(Men et al.,2016)。在不同的土壤中,由于受微生物群落、土壤化学性质、物理结构以及尿素和 PAHs的浓度等因素影响,尿素是否影响PAHs的矿化还有待更深入的研究。
此外,供试土壤有较长的PAHs污染历史(Wu et al.,2016),这可能导致土壤硝化微生物产生抗性从而产生适应性(Griffiths et al.,2013),故添加BaA后,本研究未像其他研究(Cheng et al.,2014)一样出现土壤硝化活性的显著降低。但是,100 mg∙kg-1的BaA显著降低了土壤中古菌amoA基因拷贝数,并减缓了土壤硝化过程伴随的土壤酸化。由此推测,BaA可能对土壤中尿素的硝化产生影响,这与我们此前观察到PAHs对氨氧化古菌的抑制效应一致。
4 结论
本研究探究了尿素和苯并[a]蒽对农田土壤微生物群落的生态效应。结果显示,尿素显著刺激土壤硝化活性和硝化细菌生长,降低土壤 pH,并通过土壤酸化对微生物群落产生极大影响;苯并[a]蒽有抑制土壤硝化、改变土壤微生物组成和结构的潜在趋势,但作用相对较小;受试土壤中,尿素虽未抑制苯并[a]蒽的矿化,但苯并[a]蒽抑制了土壤中硝化古菌的生长,且减缓了硝化过程伴随的土壤pH降低。鉴于土壤间存在的理化性质和微生物群落差异,还需更深入地研究施肥和有机污染物的土壤生态效应及其相互作用。
致谢:感谢南京大学季荣教授对于本研究中多环芳烃矿化分析的大力支持!
