子娴前期患者血管生成调节因子和氧化应激标志物水平与不良妊娠结局的相关性
2018-09-03刘嗣超颜红丽
刘嗣超, 颜红丽
(西北妇女儿童医院产科,陕西 西安 710000)
子痫前期(preeclampsia,PE)是妊娠期特发性疾病,涉及多器官,并与不良妊娠结局相关,为妊娠期高血压(gestational hypertension,GH)最复杂的状况之一[1]。关于PE导致产妇不良妊娠结局的机制尚不完全清楚,这可能与妊娠期间内皮功能紊乱、高龄产妇和GH等相关联[2-3]。不良妊娠结局降低了健康婴儿拥有率,增加了死胎、早产、胎儿异常、胎儿宫内生长迟缓(intrauterine growth retardation,IUGR)、宫内胎儿死亡(intrauterine fetal death,IUFD)和小于胎龄儿(small for gestational age,SGA)的发生率。上述不良妊娠结局已证实与PE相关[3-4]。但目前还很少有研究探讨分娩前后不良妊娠结局与血管生成调节因子和氧化应激标志物水平之间的关系。为此,本研究拟探讨PE患者血管生成调节因子[可溶性血管内皮生长因子受体1(soluble fms-like tyrosine kinase-1,sFlt-1)、胎盘生长因子(placental growth factor,PLGF)]和氧化应激标志物[8-异构前列腺素F2(8-epiprostaglandin F2alpha,8-epi-PGF2α)、总抗氧化能力(total antioxidant capacity,TAC)]水平与不良妊娠结局的关系。
1 材料和方法
1.1 研究对象
选取2013年4月—2015年3月在西北妇幼儿童医院妇产科进行产前检查和分娩的女性。纳入标准:(1)单胎孕妇;(2)孕周20~40周;(3)未接受抗高血压治疗;(4)无慢性高血压、无心脏病、无糖尿病、无肾病史;(5)病历资料完整。本研究经西北妇幼儿童医院道德伦理委员会审核通过,所有对象均签署知情同意书。
根据上述标准纳入的研究对象中GH患者(GH组)65例、PE患者(PE组)84例,正常妊娠女性(对照组)50名。3组年龄、分娩次数、妊娠次数、流产史、剖宫产史、收缩压和舒张压及尿蛋白水平等一般情况和临床基本特征见表1。
GH定义:妊娠20周后只表现为高血压(收缩压>18.62或舒张压>11.97 kPa),未出现蛋白尿。PE定义:妊娠20周后高血压和蛋白尿同时出现(尿蛋白>0.3 g/L)。严重PE定义:间隔6 h 2次记录的收缩压≥21.28 kPa或舒张压≥14.63 kPa并伴有蛋白尿(尿蛋白≥3 g/L)。
1.2 观察和测定指标
采集GH、PE患者在确诊24 h内(妊娠期间)和分娩后48 h内空腹静脉血10 mL,同时采集正常妊娠女性空腹静脉血,置于乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝试管中,以1 000×g离心10 min,分离血清,将血清贮存于-80 ℃待测。
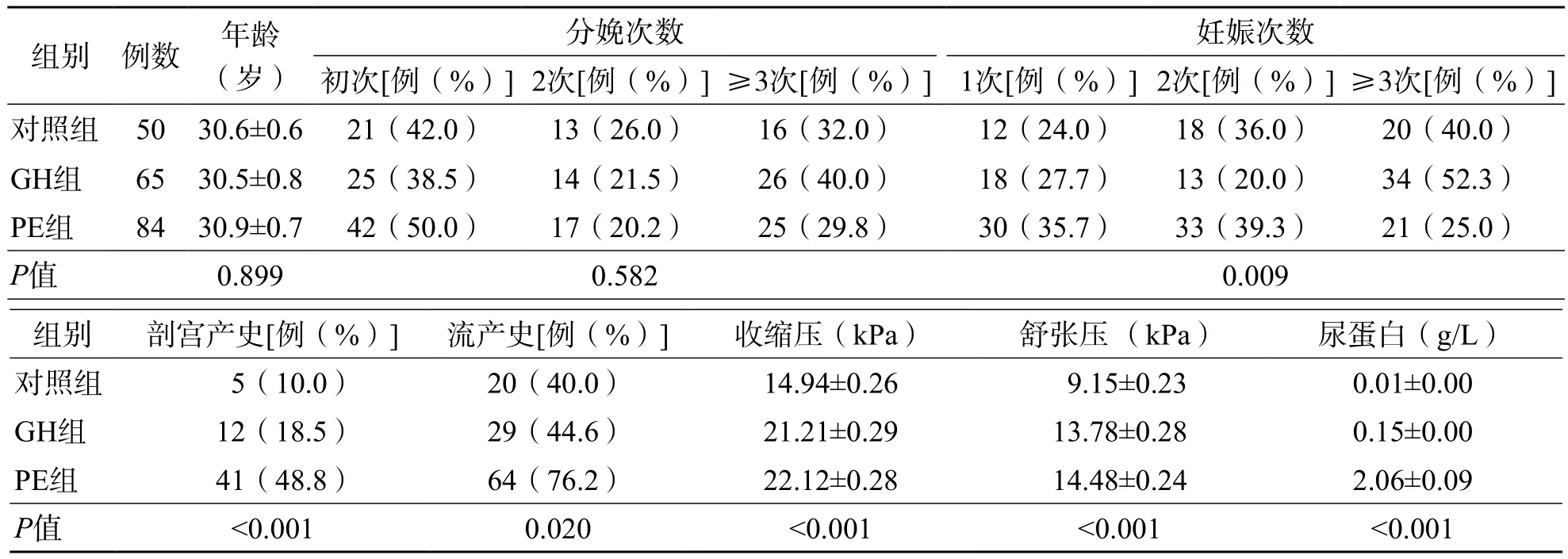
表1 研究对象的基本特征
血清sFlt-1、PLGF和8-epi-PGF2α水平采用双抗体夹心酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)测定,试剂盒购自美国R&D公司;TAC采用亚铁还原能力试验(ferric reducing antioxidant power,FRAP)测定,试剂盒购自上海碧云天生物技术有限公司。检测仪器为MULTISKAN ASCENT酶标仪(芬兰Thermo公司),每份样本至少重复检测3次。严格按仪器操作规程及试剂盒说明书进行操作。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析。呈正态分布的数据采用x ±s表示,多组间比较采用方差分析,两两比较采用q检验。呈非正态分布的数据采用中位数(范围)表示,组间比较采用Kruskal-Wallis H检验。计数资料采用率表示,组间比较采用χ2检验。血管生成调节因子和氧化应激标志物与不良妊娠结局的关系采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 分娩前后产科基本特征和不良并发症
PE组分娩时胎儿臀部先露的比例明显高于对照组和GH组(P<0.05)。PE组胎盘前置、胎盘剥落、IUFD、IUGR、产前出血(antepartum hemorrhage,APH)和未足月胎膜早破(preterm premature rupture of membranes,PPROM)比例明显高于对照组。PE组和GH组剖宫产率均高于对照组(P<0.05)。PE组死胎、早产、产后出血(postpartum hemorrhage,PPH)和产妇死亡比例均高于对照组(P<0.05)。见表2。
PE合并IUGR患者的新生儿平均出生体重[(1.25±0.19)kg]明显低于重度PE患者[(1.88±0.31)kg]、PE患者[(2.01±0.28)kg]、GH患者[(2.28±0.30)kg]和正常妊娠女性[(2.88±0.23)kg]的新生儿出生体重(P<0.001)。
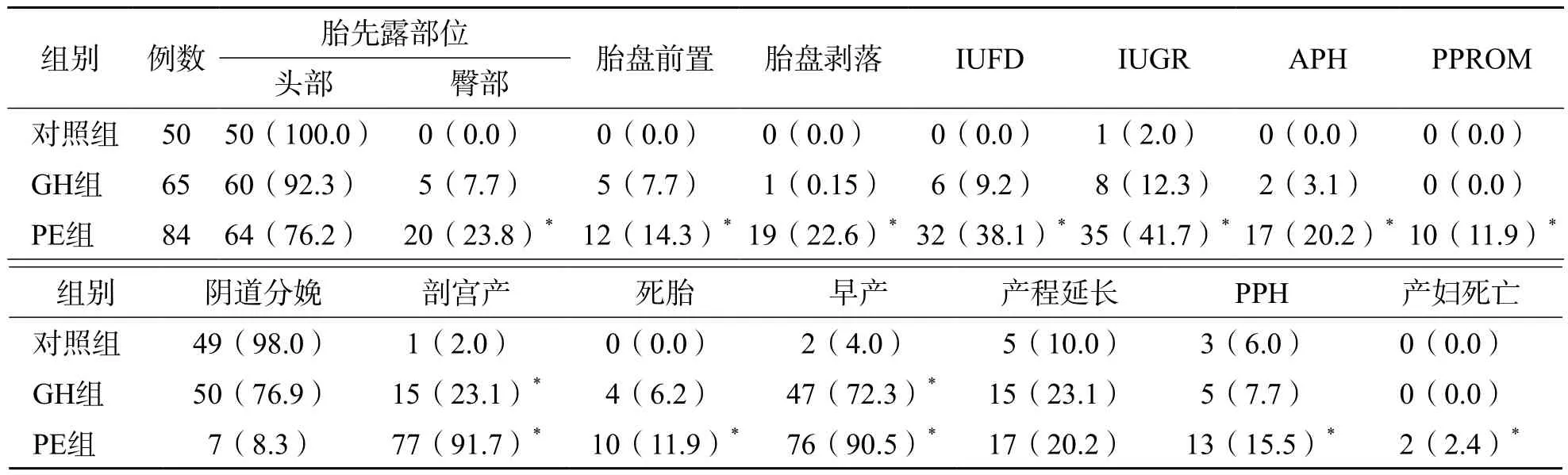
表2 分娩前后产科基本特征和不良并发症 [例(%)]
2.2 血管生成调节因子和氧化应激标志物基线和产后水平
基线时(纳入研究24 h内)对照组、GH组和PE组sFlt-1、8-epi-PGF2α水平和sFlt-1/PLGF比值依次升高(P<0.001),而PLGF和TAC水平依次降低(P<0.001)。与基线时相比,对照组、GH组和PE组分娩后48 h的TAC、PLGF水平明显升高(P<0.05、P<0.001),而sFlt-1、8-epi-PGF2α水平和sFlt-1/PLGF比值明显降低(P<0.001)。见表3。
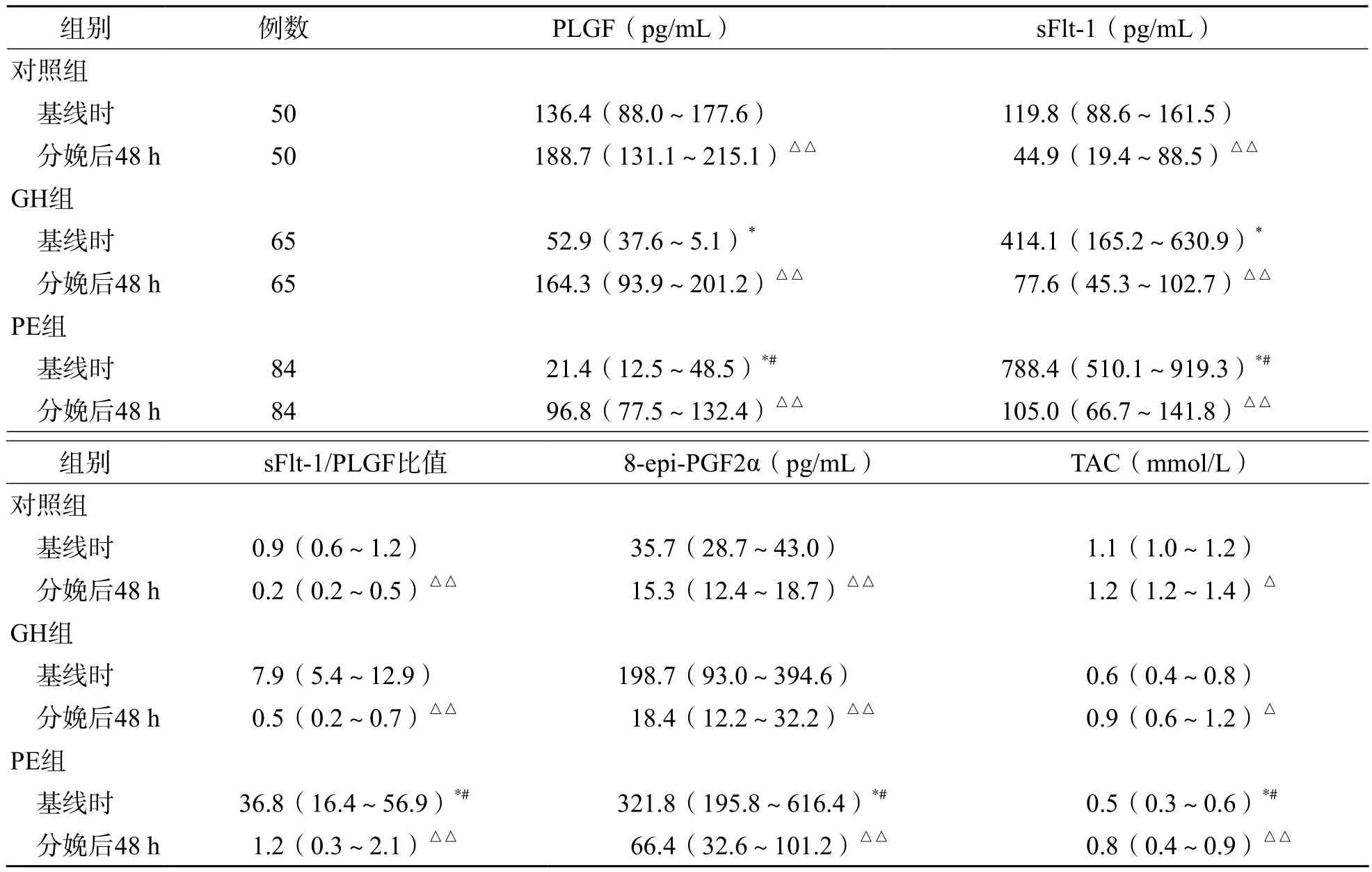
表3 GH组、PE组及对照组血管生成调节因子、氧化应激标志物基线和产后水平的比较 [中位数(范围)]
2.3 PE患者血管生成调节因子和氧化应激标志物水平与不良妊娠结局的关系
PE合并IUFD、PE合并胎盘剥落、PE合并IUGR和PE合并胎盘前置、溶血、肝酶升高、血小板减少(hemolysis,elevated liver enzymes and low platelet,HELLP)综合征患者PLGF、sFlt-1、8-epi-PGF2α、TAC水平和sFlt-1/PLGF比值明显高于PE患者(P<0.05),PE合并胎盘前置患者PLGF、8-epi-PGF2α水平明显高于PE患者(P<0.05)。见表4。
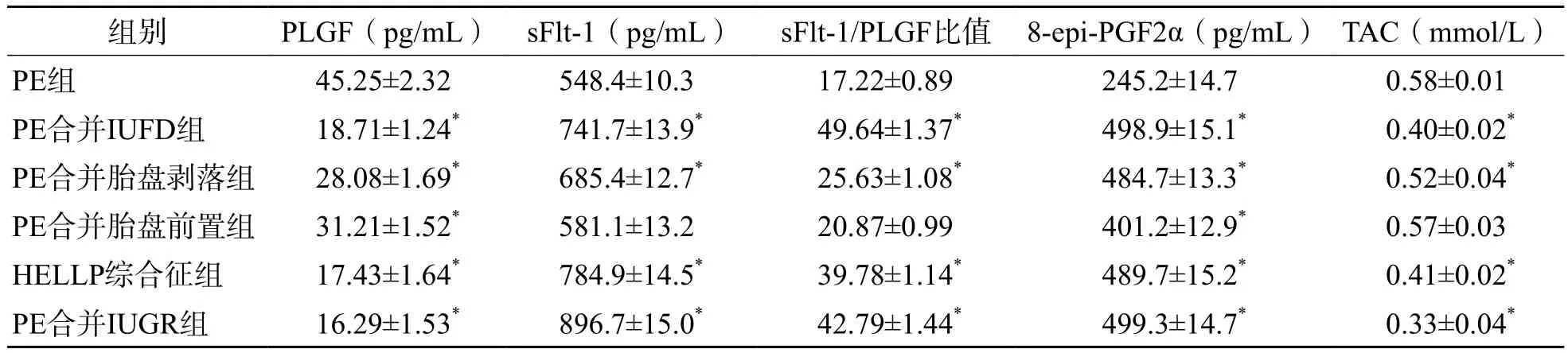
表4 PE与PE合并不良妊娠结局患者血管生成调节因子和氧化应激标志物水平的比较 (x±s)
2.4 PE患者分娩前并发症、分娩后不良妊娠结局与血管生成调节因子和氧化应激标志物水平的相关性
PE患者基线时PLGF和TAC水平与IUGR、胎盘剥落/前置、IUFD、死胎和PPH的发生呈显著负相关(P<0.05),而sFlt-1和8-epi-PGF2α与IUGR、胎盘剥落/前置、IUFD、死胎和PPH的发生呈显著正相关(P<0.05)。见表5。
GH患者基线时血管生成调节因子、氧化应激标志物水平与分娩前并发症、分娩后不良妊娠结局无相关性(P>0.05)。见表6。
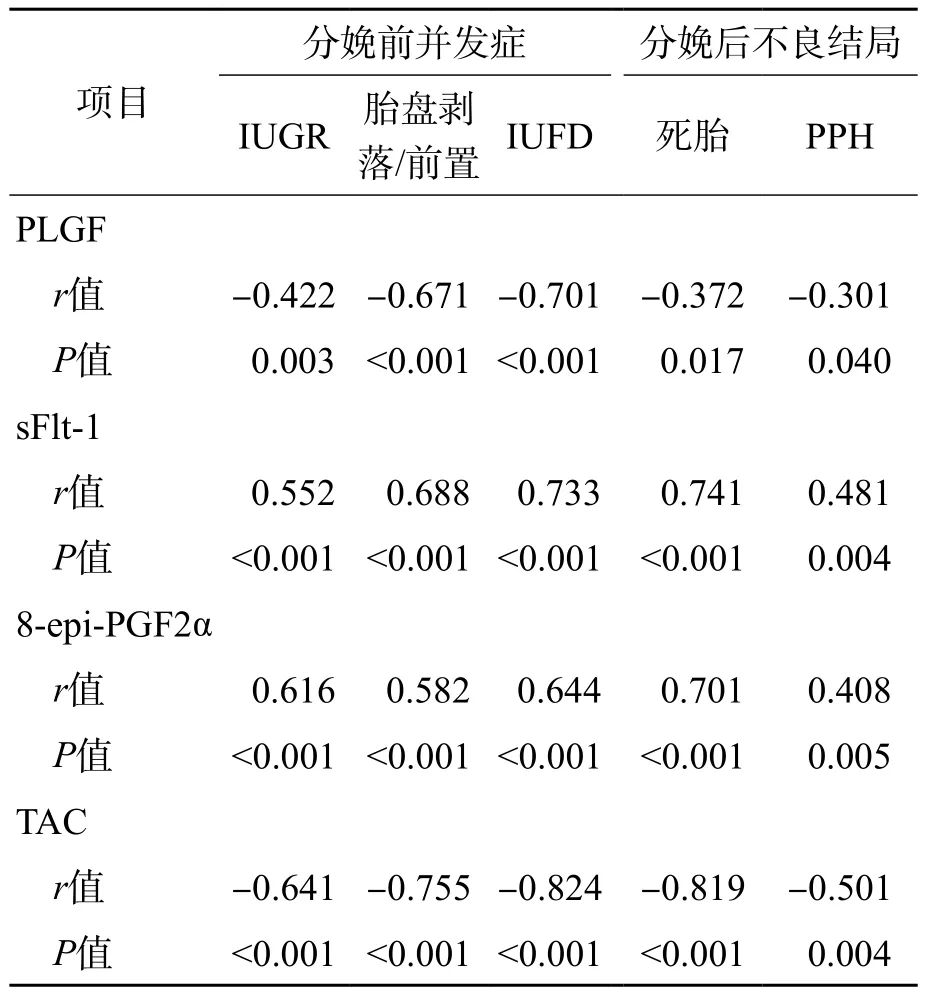
表5 PE患者血管生成调节因子和氧化应激标志物与分娩前并发症、分娩后不良妊娠结局的相关性
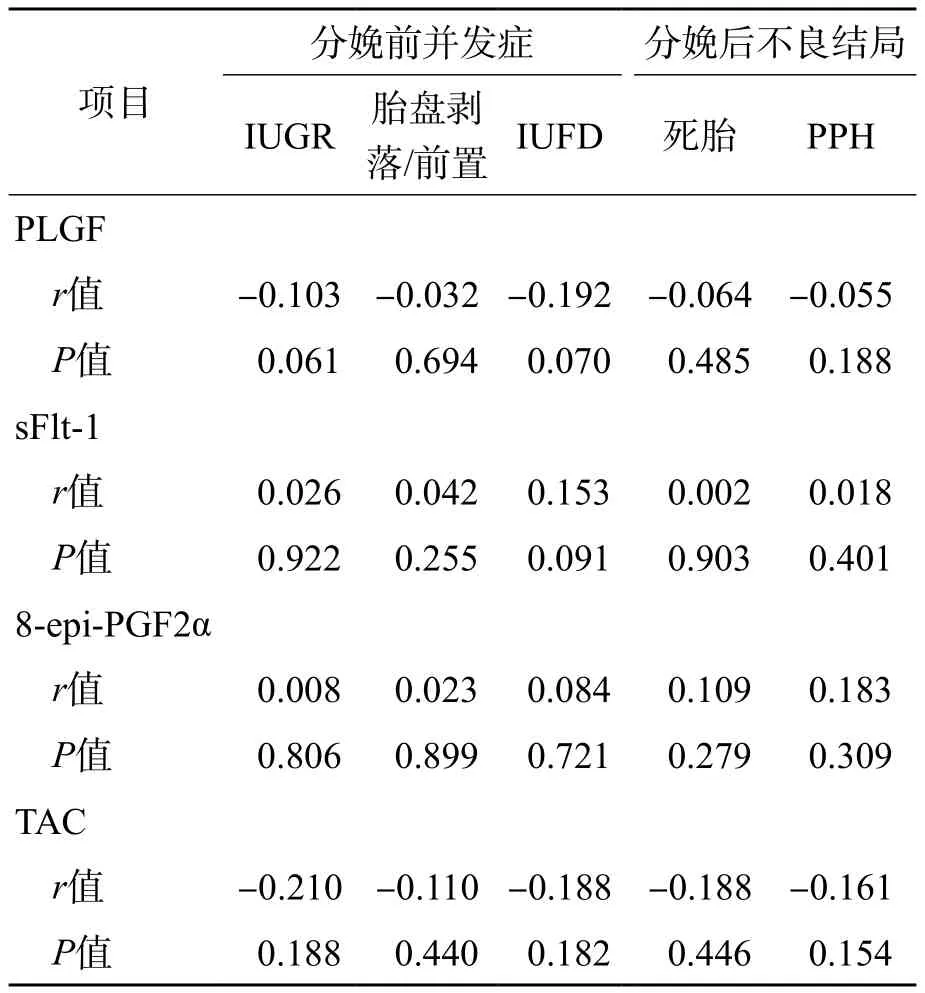
表6 GH患者血管生成调节因子和氧化应激标志物与分娩前并发症、分娩后不良妊娠结局的相关性
3 讨论
GH尤其是PE已被证实与孕产妇死亡、早产、IUGR、死胎和其他不良妊娠结局有关[3-4],但对于不良妊娠结局和PE之间的关联机制目前尚不清楚。本研究评估了PE和GH患者血管生成调节因子和氧化应激标志物水平与不良妊娠结局之间的相关性。在PE并伴有并发症的患者中,血管生成调节因子处于不平衡的状态,即sFlt-1水平升高、PLGF水平降低,氧化应激水平表现为促氧化能力升高和抗氧化能力降低;且血管生成调节因子和氧化应激标志物与IUGR、胎盘剥落/前置、IUFD、死胎和PPH明显相关。本研究结果还显示,与无并发症的PE患者和正常妊娠女性相比,合并IUGR的PE患者表现出明显的内皮功能紊乱,即sFlt-1水平明显升高、PLGF水平明显降低。GHOSH等[5]的研究结果显示,PE患者PLGF水平低于正常妊娠女性,血管生成调节因子处于不平衡的状态导致胎盘缺氧,随后引起的内皮功能紊乱可能最终导致IUGR。本研究结果也提示PE并发IUGR可能是孕妇分娩低出生体重儿的原因。李晓等[6]的研究结果显示,IUGR致使低出生体重儿的发生比例上升,而低出生体重也是导致新生儿生长发育迟缓的高危影响因素。因此,血管生成调节因子可作为预测不良妊娠结局(IUGR、胎盘剥落/前置、IUFD、死胎和PPH等)的可靠标志物。边旭明[7]的研究结果也显示血管生成调节因子可以作为先兆子痫的预测指标。RANA等[8]研究了616例疑似为PE的女性,测定其sFlt-1和PLGF水平,结果显示sFlt-1/PLGF比值≥85的女性有86.0%在2周内分娩,而sFlt-1/PLGF比值<85的女性仅有15.8%在2周内分娩,因此对于妊娠期不到34周且表现为疑似PE的女性,sFlt-1/PLGF比值可用于预测2周内孕妇不良妊娠和围产期结局。
PE患者生化指标不平衡与氧化应激水平升高相关,具体表现为脂质过氧化能力的升高,伴随抗氧化能力降低。此外,血管生成调节因子缺乏、8-epi-PGF2α水平升高和TAC降低与IUGR、胎盘剥落/前置、IUFD和HELLP综合征显著相关。PE患者促氧化(8-epi-PGF2α水平升高)和抗氧化处于不平衡状态,显著增高的脂质过氧化能力和降低的抗氧化水平表明氧化应激在不良妊娠结局的病因中发挥着至关重要的作用[9-11]。DUTTA等[12]的研究结果显示,氧化应激与决定不良妊娠结局的胎膜氧化损伤和细胞周期阻滞相关,是导致自发性早产和胎膜早破早产儿的重要影响因素。本研究结果显示,氧化应激与不良妊娠结局相关。氧化应激水平通过高8-epi-PGF2α水平[13]和低TAC水平体现[14],原因可能是在体循环代谢过程中耗尽了抗氧化蛋白,进而降低了TAC水平。不良妊娠结局多与PE患者而不是GH患者相关,提示妊娠期间并发高血压和尿蛋白水平升高是不良妊娠结局的风险因子。PE患者sFlt-1和8-epi-PGF2α水平升高表明这些标志物在PE的发病机制上发挥着协同性作用。
综上所述,PE患者血管生成调节因子和氧化应激标志物水平失衡,且与不良妊娠结局相关。因此,早期识别这些失衡状态或许可作为不良妊娠结局的预警,进而增加妊娠期间和分娩时的监督管理,为改善不良妊娠结局提供必要的预防措施。
