山羊疱疹病毒Ⅰ型的分离鉴定与致病性
2018-09-01李文良李基棕杨蕾蕾张纹纹钟纯燕刘茂军江杰元
郝 飞,毛 立,李文良*,李基棕,杨蕾蕾,张纹纹,孙 敏,钟纯燕,2,刘茂军,江杰元*
(1.江苏省农业科学院兽医研究所,农业部兽用生物制品工程重点实验室,南京 210014; 2.贵州大学动物科学学院,贵阳 550025)
山羊疱疹病毒Ⅰ型(caprine herpesvirus 1,CpHV-1)是疱疹病毒科疱疹病毒甲亚科水痘病毒属的双链DNA病毒[1-2]。该病毒感染成年山羊后表现为亚临床感染,可导致产生不同的症状,包括呼吸系统疾病、发热和白细胞减少,外阴阴道炎和包皮龟头炎[3]。怀孕3至4个月的山羊感染后可诱发流产。新生羔羊表现严重感染,主要症状为发热、结膜炎、眼分泌物增多、呼吸困难、肠道溃疡性和坏死性病变,并伴随着较高的发病率和死亡率[4]。1974年,CpHV-1首先在美国加利福尼亚表现为肠炎的新生羔羊病料中分离到[5],此后相继在欧洲、大洋洲和南美洲出现该病毒的流行[6-9]。此前我国一直没有该病报道。
2013年至2014年,江苏多地山羊养殖场育肥山羊陆续出现以呼吸道症状为主的疾病,发病率与死亡率较高,药物治疗效果较差。病羊主要表现为精神沉郁、流浆液或脓性鼻液、逐渐消瘦,剖检可见肺部出现不同程度病变。通过实际调查、多次采样,对样品中可能的相关病原进行了检测,在多数样品中检出山羊副流感病毒3型(CPIV3)[10],同时还检出了一种未知DNA病毒,通过对阳性样品进行病毒分离鉴定、纯化,获得一株CpHV-1中国分离株,将其命名为JSHA1405。采用山羊人工感染试验研究该病毒在本属动物体内的复制、排毒、临床症状等情况,以期为规模化养羊呼吸道疫病的病原学研究以及该病的防控技术研究提供理论依据。
1 材料与方法
1.1 病料与试剂
病料为2014年采自江苏某山羊养殖场具有呼吸道症状的鼻拭子样本(共12份),-80 ℃保存;牛肾传代细胞(MDBK)购自中国兽医药品监察所。病毒核酸提取试剂盒、胶回收试剂盒购自Axygen公司;DH5α感受态细胞、LATaq酶、pMD18-T载体购自TaKaRa公司;DMEM培养基和胎牛血清购自Gibco公司。
1.2 PCR检测
按试剂盒说明书提取鼻拭子总DNA,PCR扩增CpHV-1gB基因,PCR总体积20 μL,其中2×GC Buffer 10 μL,dNTP 2 μL,LATaq酶0.2 μL,上下游引物各1 μL(F:5′-TCGAAGGCCGAGTACCTGCG-3′,R:5′-CCAGTCCCAGGCCACGGTCAC-3′),DNA模板2 μL。扩增程序:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 1 min,72 ℃ 30 s,35个循环;72 ℃ 10 min。反应结束后取PCR产物于1.2%的琼脂糖凝胶中电泳检测,并拍照记录。
1.3 病毒的分离与纯化
将鼻拭子样本经0.22 μm滤膜过滤除菌,接种于MDBK单层细胞培养,于37 ℃、5% CO2细胞培养箱中培养,每天观察细胞病变(CPE)。无CPE则于4 d收毒,继续盲传直至出现稳定的CPE。按参考文献[11]中的方法进行病毒蚀斑纯化,经三轮纯化后将最后一次挑取的蚀斑接种于MDBK细胞上扩大培养,经鉴定后作为第一代纯化病毒。
1.4 病毒粒子的形态学鉴定
收获感染第4代病毒的MDBK细胞培养物200 mL,12 000 r·min-1离心30 min去除细胞碎片,上清经40 000 r·min-1超速离心2 h,沉淀用PBS溶解过夜。加样于铜网上,2%磷钨酸负染后,透射电子显微镜(Tecnai 12,PHILIPS)下观察病毒粒子形态。
1.5 gB基因克隆及进化分析
根据GenBank不同毒株基因序列设计引物分两段扩增完整的CpHV-1gB基因:F1 5′-GTGCCCCAGCGGCGTCTACCTAA-3′,R1 5′-CGCCAGGTACGTGTCCGTCTTCCC-3′;F2 5′-CGGGACGAA-AGTCGCGGAAAC-3′;R2 5′-TCATGCCCCCCCGA-CGTC-3′。PCR体系总体积20 μL,其中2×GC Buffer 10 μL,dNTP 2 μL,LATaq酶0.2 μL,上、下游引物各1 μL,DNA模板2 μL。扩增程序:95 ℃ 5 min;95 ℃ 1 min,52 ℃(F1、R1)/48 ℃(F2、R2) 1 min,72 ℃ 45 s,35个循环;72 ℃ 10 min。将PCR产物纯化后克隆至pMD18-T载体,阳性质粒送南京擎科生物科技有限公司进行测序。测序结果与GenBank上其他反刍动物α-疱疹病毒毒株的gB基因序列进行比对,用MEGA5.1软件采用Neighbor-joining(NJ)方法构建系统进化树,分析分离株与其他毒株的进化关系。
1.6 人工感染试验
将纯化后第4代病毒液(TCID50为 10-6.5·100 μL-1)以肌内注射3 mL的方式感染阴性山羊5只,另设5只 作为阴性对照组,按相同剂量和方法接种MDBK细胞培养上清。攻毒后两组分圈饲养,观察35 d,每天定时测定直肠温度,观察并记录各组山羊的临床症状。攻毒后第1、3、5、7、9、12、14、16、19、21、28、35天采集各组山羊的鼻拭子、肛拭子及血清样品。采用“1.2”中的方法检测鼻拭子、肛拭子排毒情况,并按“1.3”中方法将阳性样品在MDBK细胞上进行病毒分离。按照参考文献[12]中的方法进行血清中和抗体检测。
2 结 果
2.1 PCR检测与病毒分离
共采集12份鼻拭子样品,PCR检测到9份阳性。将阳性病料接种MDBK细胞后,盲传至第3代时,在接毒后24~48 h产生明显CPE。传至第5代后可出现稳定的CPE。接毒后24 h可见细胞肿胀,失去光泽,部分细胞出现折光性增强,变圆变亮;接毒后36 h,部分细胞发生脱落,死亡(图1B);接毒后48 h 80%细胞发生脱落。
2.2 分离毒株的形态学及核酸鉴定
电镜观察超离纯化后的病毒,可见直径约100 nm 球状有囊膜的病毒颗粒(图1C),符合反刍动物α-疱疹病毒的一般形态特征。
扩增分离毒株gB基因完整阅读框序列,测序得到2 763 bp的编码序列,将此gB基因序列与GenBank上山羊疱疹病毒Ⅰ型(CpHV-1)、牛疱疹病毒Ⅰ型不同基因型毒株(BoHV-1、BoHV-1.1、BoHV-1.2、BoHV-5、BuHV-1)及鹿疱疹病毒1型(CvHV-1)的相应基因序列进行相似性对比分析。结果表明:分离毒株JSHA1405gB基因与CpHV-1 E/CH株gB基因相似性最高,为99.2%;与BoHV-1 Salla82株相似性最低,为84.7%。进化分析结果表明JSHA1405株与CpHV-1 E/CH株同属一个分支,属于山羊疱疹病毒Ⅰ型,系统进化树如图2所示。
综上判定,分离毒株JSHA1405为山羊疱疹病毒Ⅰ型。

A.正常MDBK细胞(36 h);B.接毒后36 h细胞;C.电子显微镜下病毒粒子形态A. Normal MDBK cells for 36 hours; B. The MDBK cells inoculated virus for 36 hours; C. Virion observed by TEM图1 细胞及病毒粒子形态学观察Fig.1 Cells and virion morphology observation
2.3 人工感染试验
攻毒组山羊(CC)在感染病毒后第1天开始出现体温升高(>40 ℃),发热过程最长可持续至攻毒后10 d(图3),体温最高可达41.8 ℃。感染病毒后第3天攻毒组山羊开始出现呼吸道症状并持续到第12天,羊群表现为精神沉郁、流浆液性或脓性鼻涕(表1)。此外,攻毒组山羊可以通过鼻腔和粪便排毒,感染后3 d可在鼻拭子和肛拭子中检测到病毒,排毒可持续6 d左右(表1)。将检测为阳性的条带回收后测序,结果显示扩增毒株为CpHV-1。阳性样品接种MDBK细胞能产生稳定的细胞病变,PCR检测为CpHV-1。对照组山羊(NC)表现正常且未检出排毒(图3、表1)。中和试验结果显示,山羊在攻毒后第7天出现中和抗体,第28天达到最高峰,抗体效价最高可达1 024;对照组山羊未检测到中和抗体(表1)。
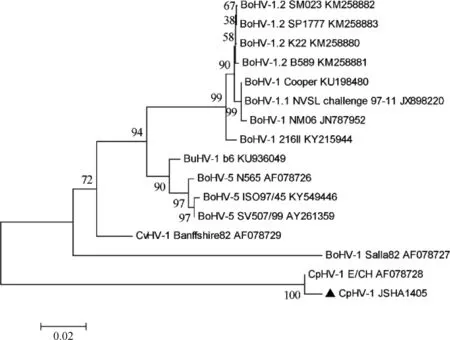
▲. 本试验分离毒株▲. Isolated strain图2 反刍动物疱疹病毒gB基因核苷酸系统进化树Fig.2 Phylogenetic tree inferred by nucleotide sequences from the gB regions of ruminant alphaherpesviruses

图3 羊群体温变化图Fig.3 Rectal temperature measurement in goats
3 讨 论
近年来,中国肉羊养殖业蓬勃发展,规模化舍饲已成为我国肉羊产业发展的主要模式之一。随着养殖规模的扩大,饲养密度的增加,疾病防控面临着越来越大的压力。呼吸道疾病是危害养羊业尤其是圈舍养羊的重要疫病之一[13],目前对相关致病病原的研究主要集中在小反刍兽疫病毒、支原体、山羊副流感病毒3型以及巴氏杆菌等方面[10,14-18]。山羊疱疹病毒Ⅰ型(CpHV-1)可引起羔羊出现致命全身性感染以及成年山羊亚临床呼吸道和生殖系统感染[3-4],该病于1974年首次在美国出现,5年后在瑞士也发现该病毒感染。虽然对该病毒的全球流行分布情况尚未进行系统研究,但是欧洲、澳大利亚、新西兰、加拿大和巴西已陆续报道该病毒感染的存在。本病在地中海沿岸国家分布比较广泛,在这些国家检测到了较高的抗体阳性率(希腊超过50%,西班牙为21%,意大利南部为60%),最新研究报道在法国本土南部地区也出现该病毒感染[9,19]。我国此前没有该病的报道,也没有对其进行相关调查。

表1 各组山羊临床症状、排毒情况和中和抗体滴度检测结果
a. 采样时间,数字是几就是指第几天所采样品;-.正常;+.轻度;++.中度
a. Sampling time, the number refers to the sample taken on that day. -. Normal; +. Mild; ++. Moderate
国外研究表明,高养殖密度、快速育肥的养殖模式以及与其他病毒共感染是引起CpHV-1感染的几大风险因素[19]。本研究采集具有呼吸道症状的育肥羊鼻拭子样本,经病原学检测发现存在CpHV-1感染,同时也检测到了CPIV3和绵羊肺炎支原体感染存在。该结果与国外研究相佐证,同时也提示导致2013—2014年江苏多地规模化舍饲快速育肥羊群产生严重呼吸道症状的病原是多样的,在高养殖密度压力下,一旦感染某种病原,其他病原可趁机导致继发感染,共同作用,导致发病羊群临床症状表现较以往严重,药物治愈率低下。
对此次成功分离的CpHV-1中国分离株JSHA1405的致病性进行了研究,结果表明:JSHA1405分离株可导致山羊急性发热,并持续一周以上,这与国外的研究结果[20]一致。攻毒组山羊在攻毒后出现严重的临床症状,且可通过鼻腔/粪便排毒。与国外研究相比,本研究第一次发现可以从肛拭子中检测到排毒。攻毒组山羊在攻毒后能够产生中和抗体,抗体效价最高可达1 024,而国外类似的研究中攻毒组山羊的中和抗体效价最高为64[20],这可能与不同毒株间毒力差异有关(国外研究中的研究对象为从潜伏感染山羊中分离到的毒株)。
这是首次检测到CpHV-1在我国的存在,随后本实验室又分别于2014年和2015年从省内另外两个山羊养殖场的育肥羊群检测到该病原的存在并分离到病毒(NJ1401和HA1501),gB基因相似性大于99%(数据略)。这表明该病毒在国内羊群中具有一定的流行率。基于此,本团队先后建立了荧光定量PCR检测方法和ELISA检测方法,正在对不同年龄段、不同性别羊群中CpHV-1的流行分布情况进行系统研究。
4 结 论
首次从国内具有呼吸道症状的发病羊中分离并鉴定山羊疱疹病毒Ⅰ型,经对其gB基因测序,病毒形态学鉴定和致病性试验证实分离到病毒,命名为JSHA1405。该研究为进一步预防和控制山羊疱疹病毒Ⅰ型感染的发生和流行提供了基础。
