自噬在骨保护素对破骨细胞及其前体凋亡过程的调控机制
2018-09-01刘庆羊孙自强赵鸿雁宋瑞龙顾建红刘宗平
刘庆羊,孙自强,赵鸿雁,宋瑞龙,顾建红,刘宗平*
(1.扬州大学兽医学院,扬州 225009; 2. 扬州大学比较医学研究院,扬州 225009;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009; 4. 扬州大学教育部农业与农产品安全国际合作联合实验室,扬州 225009)
破骨细胞(osteoclasts,OCs)是具有骨吸收功能的多核巨细胞。它不仅参与生理性骨改建,而且在病理性骨吸收过程中也具有重要作用。当OCs数量增加或活性增强,可导致骨质疏松、炎症性关节炎等代谢性骨病。骨保护素(osteoprotegerin,OPG)是由成骨细胞分泌,能抑制OCs的分化和OCs的活性[1-2]。研究发现,破骨细胞的骨吸收与自噬密切相关,DeSelm等[3]证明自噬相关蛋白Atg5、LC3等通过影响破骨细胞皱褶缘的形成和炎性物质的分泌调控OCs的骨骼重吸收功能。但OPG对OCs自噬的作用机制尚未阐明。本实验室前期研究发现,(0、20、40、80 ng·mL-1) OPG处理RAW264.7诱导的OCs 24 h后,OPG呈剂量依赖性地抑制OCs的形成和分化[4],也有文献报道,OPG可竞争性地结合肿瘤坏死因子(TNF) 相关凋亡诱导配体(TNF-related apoptosis inducing ligand,TRAIL),抑制TRAIL诱导的细胞凋亡[5-6]。研究表明,凋亡和自噬在不同的情况下存在密切和复杂的关系[7]。饥饿、低氧、感染和氧化应激等异常情况可诱导细胞发生死亡[8]。自噬一般被认为是细胞的自我保护机制,但自噬过度激活也会导致细胞死亡[9]。在OPG作用于OCs和 OCPs后,自噬对凋亡的调控机制尚不明确。本文以小鼠单核巨噬细胞系RAW264.7细胞诱导分化形成OCs和OCPs,研究OPG对OCs、OCPs自噬和凋亡的影响及自噬对细胞凋亡的调控作用。
1 材料与方法
1.1 细胞株
RAW264.7细胞株,购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库(ATCC Number:TIB-71)。
1.2 主要仪器与试剂
二氧化碳培养箱、超低温冰箱(Thermo,USA);DMI3000B倒置相差显微镜(Leica,Germany);电泳仪(Bio-Rad,USA);5810R型冷冻离心机(Eppendorf,Germany);CyAn ADP7型流式细胞仪(Beckman Coulter,USA);DMEM、α-MEM (Life Technologies,USA);10%胎牛血清(Gibco,USA),M-CSF、RANKL、OPG(Peprotech,USA);氯喹(MedChemExpress,USA);雷帕霉素(Sigma,USA);兔抗L3B(Sigma,#L7543,USA),兔抗Atg5(Cell Signaling,#12994s,USA),兔抗Beclin-1(Cell Signaling,#3495s,USA),兔抗β-actin(Cell Signaling,#4970L,USA);Annexin V-FITC 荧光染色试剂盒(BD,USA)。
1.3 RAW264.7 细胞培养与处理
将液氮冻存的RAW264.7 细胞37 ℃水浴融化转移至15 mL离心管,加入7 mL DMEM培养液室温1 000 r·min-1离心5 min后弃上清,加入5 mL培养液轻轻重悬,转移至细胞培养瓶,置于37 ℃、 5% CO2饱和湿度的恒温培养箱中培养10 h换液,继续培养待RAW264.7细胞铺满细胞培养瓶底80%~90% 时传代。RAW264.7培养至第5代,细胞重悬于α-MEM培养液(含10%FBS),将细胞以2×104·mL-1的浓度接种到6孔板培养,培养基中加入细胞因子M-CSF(25 ng·mL-1)和RANKL(30 ng·mL-1),培养3~5 d,每2 d 更换培养液一次,并添加同样浓度的细胞因子。
RAW264.7细胞诱导3或5 d后分化成OCPs或OCs,经CQ(50 μmol·L-1) 预处理30 min,或RAP(5 μmol·L-1) 预处理1 h,添加OPG(80 ng·mL-1)作用细胞6 h,试验分组:Con、OPG、CQ、CQ+OPG、RAP和RAP+OPG组。
1.4 Western blot检测OCs和OCPs自噬相关蛋白的表达
取处理过的细胞,弃去培养基,4 ℃PBS清洗2次 (去除不贴壁的细胞),加入含有蛋白酶抑制剂的RIPA裂解液,置于冰上裂解30 min,收集裂解液,于超声裂解20 s,冷冻离心机4 ℃ 1 200 r·min-1离心10 min,收集上清液。BCA蛋白浓度定量试剂盒测定各组蛋白浓度,并调整为一致浓度,按体积加入6× SDS-PAGE Loading Buffer(1∶5),隔水煮沸10 min ,-80 ℃冰箱储存备用。
取等量样品加入凝胶泳道,初始阶段恒压90 V电泳,待蛋白抵达分离胶恒压110 V电泳,电泳结束后,采用恒压湿转法将蛋白从SDS-PAGE胶转移至PVDF膜,转膜条件110 V恒压90 min,(转膜时间依据目的蛋白分子量的不同需适当调整),根据目的蛋白相对分子质量大小剪裁PVDF膜,用含5%脱脂牛奶的TBST封闭缓冲液室温振荡封闭2 h,加入含 5% BSA的TBST配制的一抗(1∶1 000),4 ℃ 孵育过夜,回收一抗,TBST缓冲液洗涤PVDF膜6次(5 min·次-1),辣根过氧化物酶HRP标记的二抗(1∶5 000)室温孵育2 h,回收二抗,TBST缓冲液洗涤PVDF膜6次(5 min·次-1),将PVDF膜与化学发光底物检测试剂混合液充分反应,然后将膜置于化学发光图像分析仪内,拍摄照片。用Image Lab软件计算灰度值。
1.5 Annexin V-FITC/PI双标记法检测OPG对OCs和OCPs凋亡率的影响
参照Annexin V-PI双染色试剂盒的说明进行细胞处理。收集上清,用0.25% 胰蛋白酶消化收集细胞,1 200 r·min-1,4 ℃离心5 min ,弃上清,加入1 mL PBS重悬细胞,1 200 r·min-1,4 ℃ 离心5 min ,弃上清,加100 μL Binding Buffer制备细胞悬液,再加入5 μL Annexin V-FITC和5 μL PI混匀,室温避光反应20~30 min,每5 min轻轻颠倒混匀,加入400 μL Binding Buffer缓冲液终止反应,细胞悬液经200目筛网过滤分装到流式管,立即用流式细胞仪检测。
1.6 数据分析
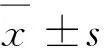
2 结 果
2.1 OPG对OCs及OCPs自噬的影响
2.1.1 OPG对OCPs自噬水平的影响 RAW264.7细胞诱导3 d后,经CQ或RAP预处理后,添加OPG(80 ng·mL-1)作用细胞6 h。Western blot结果显示(图1),与Con相比,OPG组OCPs的Atg5和Beclin-1蛋白水平极显著或显著上调(P<0.01或P<0.05),LC3-Ⅱ无显著差异(P>0.05) ,CQ组和CQ+OPG组的LC3-Ⅱ、Atg5和Beclin-1蛋白水平极显著或显著上调(P<0.01 或P<0.05),RAP和RAP+OPG组的LC3-Ⅱ、Atg5和Beclin-1水平极显著上调(P<0.01);与OPG组相比,CQ+OPG组的LC3-Ⅱ和Atg5水平极显著上调(P<0.01),RAP+OPG组的LC3-Ⅱ水平极显著上调(P<0.01)。提示OPG处理促进OCPs发生自噬。
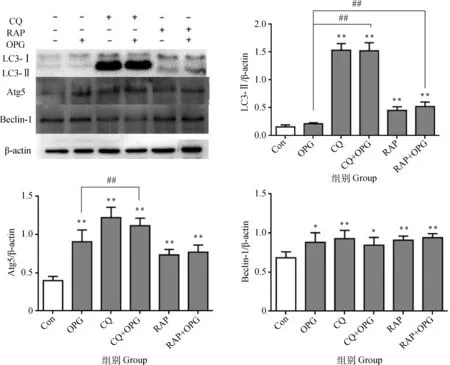
2.1.2 OPG对OCs自噬水平的影响 RAW264.7细胞诱导5 d后,经CQ或RAP预处理后,添加OPG(80 ng·mL-1)作用细胞6 h。Western blot结果显示(图2),与Con相比,OPG组OCs的 LC3-Ⅱ、Atg5和Beclin-1蛋白水平极显著下调(P<0.01),CQ和CQ+OPG组的LC3-Ⅱ蛋白极显著上调(P<0.01),Atg5和Beclin-1蛋白极显著下调(P<0.01),RAP和RAP+OPG组Atg5和Beclin-1蛋白极显著下调(P<0.01),RAP组LC3-Ⅱ蛋白极显著上调(P<0.01),RAP+OPG组LC3-Ⅱ无显著差异(P>0.05);与OPG组相比,CQ+OPG组的LC3-Ⅱ、Atg5和Beclin-1蛋白极显著上调(P<0.01), RAP+OPG组的LC3-Ⅱ显著上调(P<0.05), Atg5和Beclin-1蛋白极显著下调(P<0.01)。 提示OPG抑制了OCs的自噬产生。
与对照组相比, * *.P<0.01,*.P<0.05;与OPG组相比,## .P<0.01* *. P<0.01, *. P<0.05 versus control; ##.P<0.01 versus OPG图1 OPG对OCPs自噬水平的影响Fig.1 Effects of OPG on the autophagy in osteoclast precursors
与对照组相比, **.P<0.01;与OPG组相比,## .P<0.01,#.P<0.05**. P<0.01 versus control; ##. P<0.01, #. P<0.05 versus OPG图2 OPG对OCs自噬水平的影响Fig.2 Effects of OPG on the autophagy in osteoclasts
2.2 OPG对OCs和OCPs凋亡的影响
2.2.1 OPG对OCPs凋亡的影响 RAW264.7细胞诱导3 d后,经CQ或RAP预处理后,添加OPG(80 ng·mL-1)作用细胞6 h。流式细胞仪分析测定结果显示(图3),与Con相比,OPG、RAP 和RAP+OPG组早期凋亡率极显著上升(P<0.01),CQ组和CQ+OPG组早期凋亡率无显著差异(P>0.05);较OPG组,CQ+OPG组早期凋亡率极显著降低(P<0.01),RAP+OPG 组早期凋亡率极显著增强(P<0.01)。提示OPG能够引起OCPs凋亡,抑制自噬对OCPs凋亡的影响不明显,而促进自噬能够导致OCPs凋亡。
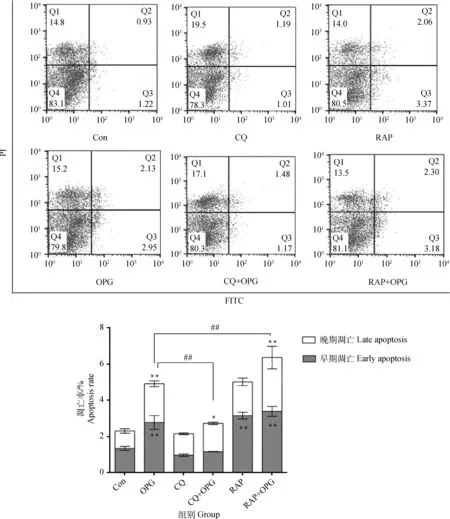
与对照组相比, * *.P<0.01,*.P<0.05;与OPG组相比,# # .P<0.01* *. P<0.01, *. P<0.05 versus control; ##.P<0.01 versus OPG图3 OPG对OCPs凋亡的影响Fig.3 Effects of OPG on the apoptotic ratio of osteoclast precursors
2.2.2 OPG对OCs凋亡的影响 RAW264.7细胞诱导5 d后,经CQ或RAP预处理后,添加OPG(80 ng·mL-1)作用细胞6 h。流式细胞仪分析测定结果显示(图4),与Con相比,OPG、CQ、CQ+OPG 、RAP和RAP+OPG组早期凋亡率极显著下降(P<0.01)。提示OPG处理使OCs凋亡率下降,抑制和促进自噬都能显著降低OCs的凋亡率。
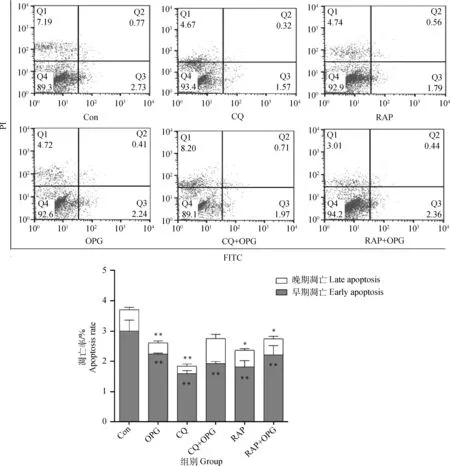
与对照组相比, * *.P<0.01,*.P<0.05* *. P<0.01, *. P<0.05 versus control图4 OPG对OCs凋亡的影响Fig.4 Effects of OPG on the apoptotic ratio of osteoclasts
3 讨 论
OPG是一种分泌型糖蛋白,能够抑制骨吸收、增加骨密度,它能够与细胞核因子-κB 受体活化因子(RANK)竞争性地结合RANK配体(RANKL),并抑制OCs的形成[10]。研究表明,OPG显著提高小鼠骨髓诱导的OCs的自噬水平[11],也能够抑制鸭胚OCs分化并促进其凋亡[12]。本文利用小鼠单核巨噬细胞系RAW264.7诱导分化形成OCPs和OCs,添加OPG处理,表明OPG能够促进OCPs发生自噬和凋亡,抑制OCs发生自噬与凋亡。
自噬是真核细胞中一种自我清除的过程,通过溶酶体介导的降解通路,主要降解细胞内多余或受损的蛋白及细胞器,而自噬过度激活会导致细胞死亡。研究表明,自噬相关基因LC3、Atg5、Beclin-1等在OCs分化过程中起到了重要的作用[13-14]。LC3有LC3-Ⅰ和LC3-Ⅱ两种亚型,分别定位于前自噬体和自噬体膜表面,LC3-Ⅱ的表达量在某种程度上反映了细胞的自噬活性[15]。Beclin-1在自噬起始阶段起到重要的作用,主要通过调节其他的自噬蛋白定位到前自噬体膜上[16]。在动物机体内,OCs的数量受严格的控制,以维持骨骼形成和发育,防止骨吸收过度所致的病理性骨丢失[17]。研究发现,RAP影响骨骼生长的功能,减少OCs的数量,破坏长骨的生长发育[18-19]。RAP通过抑制 mTOR的活化促进自噬的发生,添加RAP使OCs活性下降[20-21]。CQ能够提高溶酶体的pH,使溶酶体中的酸性水解酶失去活性,因此位于自噬体或自噬溶酶体膜上的 LC3不能被及时降解,继而LC3蛋白表达升高。还有研究表明,CQ通过抑制自噬来阻止OCs的分化,起到治疗骨质疏松症的作用[22]。本实验室前期研究发现[23],RAW264.7细胞培养1、3、5、7 d后,经80 ng·mL-1的OPG处理24 h,结果显示OPG对于分化早期的OCPs和分化中末期的OCs具有不同的调控作用,促进OCPs存活和黏附结构形成,抑制OCs活性。本研究在OCs分化至第3、5天,CQ或RAP预处理后,加入80 ng·mL-1OPG处理6 h,发现OPG促进OCPs的自噬水平,而抑制OCs的自噬水平。以上研究结果证明OPG对于OCs分化不同阶段的生物效应有所差异,在OCPs的分化过程中自噬起着正向调控作用,促进OCPs的分化;OPG阻止OCs向末期阶段分化,抑制OCs的活性,此时自噬主要发挥维持稳态的作用。
细胞凋亡是维持细胞稳态的另一种重要机制。发生凋亡时,细胞膜上的磷脂酰丝氨酸(phosphatidylserine,PS)发生外翻与钙磷脂结合蛋白结合,Annexin V利用一种对PS具有较高亲和性的磷脂结合蛋白作为敏感探针,检测PS的变化[24]。本课题组前期研究表明[25],40 ng·mL-1OPG处理RAW264.7细胞诱导的OCs,能够通过抑制OCs的分化过程而阻止细胞凋亡的发生。自噬与凋亡关系在不同的组织和细胞中存在较大差异,顺铂可以引起膀胱癌细胞T24发生自噬,并且促进自噬能促进顺铂诱导的细胞凋亡[26];联合应用乌苏酸与唑来膦酸,通过增强自噬与氧化应激水平,促进乌苏酸诱导的人成骨肉瘤细胞凋亡[27]。另外,饥饿诱导小鼠成骨细胞,前2 h自噬抑制凋亡,随饥饿时间延长自噬保护作用逐渐降低,最终细胞发生凋亡[28]。本研究采用流式细胞术Annexin V-FITC/PI双标记法检测OPG对RAW264.7诱导的OCs和OCPs凋亡率的影响,结果显示OPG促进OCPs凋亡,抑制OCs凋亡,此外,促进自噬能引起OCPs的凋亡,而抑制和促进自噬皆显著抑制OCs的凋亡。
4 结 论
OPG促进OCPs发生自噬和凋亡,抑制自噬对OCPs凋亡的影响不明显,而促进自噬能够导致OCPs凋亡。此外,OPG抑制了OCs的自噬发生和凋亡,而抑制和促进自噬都能显著降低OCs的凋亡率。OPG作为骨质代谢、炎症免疫调节以及细胞凋亡中的重要调节因子,通过干预自噬流对OCs和OCPs凋亡有相反的调控作用,这为骨质疏松、骨硬化症以及肿瘤等多种疾病的诊断、治疗提供了新的思路。
