AMPK激动剂干预瘢痕疙瘩形成过程的实验研究
2018-09-01蔡海丰殷嘉菲王琛周仁鹏王泽剑王丹茹
蔡海丰 殷嘉菲 王琛 周仁鹏 王泽剑 王丹茹
瘢痕疙瘩(Keloid)是指皮肤创面自愈时,局部组织受过度增生的胶原纤维的影响而呈现的瘢痕化的过度纤维化病理损伤。瘢痕疙瘩超出原有损伤范围而过度生长并侵犯周围皮肤,呈瘤样增生,这种瘢痕组织一般都呈现出较为活跃的生长代谢现象,且基本都不会进入成熟期[1-2]。目前的治疗方法主要为局部注射糖皮质激素、放疗、服用抗代谢药物或抗肿瘤药物等,但均无法根治。
瘢痕疙瘩的形成机制不明确。研究表明,瘢痕疙瘩具有与肿瘤相似的生物学特性,被认为是一种皮肤的良性肿瘤[3]。肿瘤中存在缺氧环境,存在Warburg现象,导致其能量代谢存在异常[4]。瘢痕疙瘩组织中也存在局部缺氧微环境,且瘢痕疙瘩成纤维细胞具有与肿瘤细胞类似的代谢方式[5],细胞表型与肿瘤类似,能量代谢存在异常,且具有干性。
腺苷酸活化蛋白激酶(AMPK)是细胞内的能量感受器,是重要的蛋白激酶,参与多个代谢过程,在真核细胞生物中广泛存在,主要负责调控细胞内的代谢和能量平衡。AMPK激动剂能通过促进葡萄糖摄取,抑制糖原合成,逆转Warburg现象,改善肿瘤细胞的能量代谢[6-8]。二甲双胍是一种常见的抗糖尿病药物,也是一种AMPK激动剂,Würth等[9]的研究表明,该药物具有抗肿瘤作用。但目前还没有针对AMPK激动剂在干预瘢痕疙瘩形成中的作用的研究。
肌成纤维细胞在创伤修复中起着重要的作用,病理情况下,肌成纤维细胞的持续存在可能引起病理性瘢痕[10]。过去认为,增生性瘢痕中存在肌成纤维细胞,而瘢痕疙瘩中不存在[11]。但是,新的研究表明,瘢痕疙瘩中α-SMA(肌成纤维细胞细胞的主要标志物)的表达与增生性瘢痕没有显著差异[12]。研究提示,皮肤成纤维细胞向肌成纤维细胞转化可能是瘢痕疙瘩形成和发展的重要机制[13-14],Zhao等[15]通过人羊膜上皮细胞抑制该过程,以此来控制瘢痕疙瘩的形成。本实验在此基础上进一步探讨肌成纤维细胞在瘢痕疙瘩形成过程中的作用。
本实验拟从AMPK改善能量代谢的角度来探究其对瘢痕疙瘩的形成过程的干扰,为今后的瘢痕疙瘩相关研究及临床治疗提供新的思路。
1 材料与方法
1.1 主要材料和试剂
人皮肤成纤维细胞 (Human skin fibroblasts,hSF)由上海交通大学殷明实验室赠予。
A769662(Targetmol,美国);TGF-β(Protein Tech,美国);磷酸酶抑制剂和复合蛋白酶抑制剂(Roche,美国);苯甲基磺酰氟PMSF和RIPA裂解液、BCA蛋白浓度测定试剂、蛋白变性试剂(碧云天生物技术研究所);Western blot相关试剂(Amersco,美国);ACTA2、E-cadherin、CollagenⅠ、Viementin、IRS-1、Glut4、PH2AX、H2AX、NANOG、OCT4、GAPDH、羊抗鼠 IgG、羊抗兔 IgG(Proteintech,美国),ELISA 试剂盒(XinlePcc,美国)。
1.2 实验方法
1.2.1 hSF培养、复苏、传代
将细胞冻存管从液氮内取出,快速置于37℃水浴中,反复轻摇解冻;将冻存管内的细胞悬液加入含4 mL DMEM培养基的15 mL离心管中,1 000 r/min离心5 min去除DMSO,将培养基吸取干净,加入含10%FBS的DMEM培养基,重悬细胞,最后将细胞悬液转移到细胞培养瓶内,于37℃、5%CO2条件下培养。待细胞融合达80%~90%后,0.25%Trypsin-EDTA消化传代,37℃、5%CO2细胞培养箱培养。取第3~5代细胞用于实验。
1.2.2 hSF表型转化环境的构建及验证
将培养有hSF的培养皿置入封箱,在培养皿边上放置蜡烛并点燃,同时封闭封箱。蜡烛自动熄灭,即表明低氧环境已构造完毕。将封箱置于37℃恒温培养,每6 h观察细胞形态变化,共72 h。上述方法有效后,取浓度为8×104cells/mL的细胞悬液接种于6孔板,每组设3个复孔,每孔2.5 mL,重复低氧环境,并加入不同浓度的 TGF-β1(0 ng/mL、2.5 ng/mL、5 ng/mL、10 ng/mL 和 20 ng/mL)以诱导炎症反应,并筛选最佳诱导浓度,通过细胞形态学观察及Western blot检测 (相关标志物包括 E-cadherin、Vimentin、ACTA2、Collagen I等)来验证诱导结果。
1.2.3 AMPK激动剂干预hSF表型转化
在以同一浓度TGF-β1诱导的细胞模型上,加入不同剂量(2.5 μmol、5 μmol、10 μmol和 20 μmol)AMPK激动剂(A769662),每组设3个复孔,每6 h光镜下观察细胞形态变化,48 h后取细胞样本进行Western blot及ELISA检测。
1.2.4 Western blot测定AMPK激动剂干预效果
收集单独缺氧状态下培养的hSF、缺氧及最佳TGF-β1浓度诱导下的hSF,以及加入不同浓度AMPK激动剂诱导后的hSF,分别以适量RIPA裂解液提取细胞总蛋白。BCA法测定蛋白浓度。蛋白提取液中加入等量电泳缓冲液电泳,电泳后转膜,5%BSA溶液室温封闭1 h;加入3 μL一抗,4℃孵育过夜;TBST洗膜5 min,3次;加相应的二抗室温孵育2 h;TBST洗膜10 min,3次;用化学发光法检测不同样品蛋白 (ACTA2、E-cadherin、CollagenⅠ、Vimentin、IRS-1、Glut4、P-H2AX、H2AX、NANOG、OCT4)的表达状况。
1.2.5 ELISA测定hSF表型转化的相关标志物表达
标准品溶液依次按倍数稀释至5~640 ng/mL。标准品孔加标准品和链霉素-HRP各50 μL,待测样品孔先加40 μL样本(细胞培养液上清),再加50 μL链霉素-HRP和10 μL抗IL-6抗体(或抗VEGF抗体),混匀。将酶标板存于37℃温箱内1 h,揭去封板膜,各孔洗涤5次,加入显色液显色,加入终止液,10 min后于450 nm处进行吸光度测定。
1.2.6 统计学处理
所有数据检测均重复3次,结果以(x±s)表示。采用SPSS21.0行统计学分析,组间比较采用t检验,若不满足正态分布则选用非参数检验,P<0.05为差异具有统计学意义。
2 结果
2.1 细胞形态学
2.1.1 无氧环境构造
细胞形态学观察发现,处于缺氧状态下的hSF形态改变,由典型纺锤形变为多边形(图1)。
2.1.2 TGF-β1诱导hSF表型转化
为验证TGF-β1在hSF向瘢痕疙瘩相关细胞表型转化过程中的诱导作用[16],并探讨其诱导转化效应的剂量关系,本实验在模拟缺氧条件下,加入不同浓度TGF-β1。结果显示,随着TGF-β1浓度提高,hSF纺锤形态丧失;当TGF-β1浓度达到10.0 ng/mL时,细胞呈现出团状结构(图2)。
2.2 Western blot检测
Western blot检测不同浓度的 TGF-β1对 hSF的 Vimentin、E-cadherin、ACTA2、CollagenⅠ蛋白表达的影响,实验选用GAPDH作为内参。
2.2.1 TGF-β1诱导hSF表型转化
Western blot结果显示,随TGF-β1浓度升高,E-cadherin表达逐渐受到抑制,至10 ng/mL后抑制作用减弱;Vimentin、ACTA、CollagenⅠ的表达则明显增强,随TGF-β1浓度升高,促进作用增强,直至10 ng/mL后,效果开始减弱。实验表明,在TGF-β1浓度不断增加至10 ng/mL的过程中,TGF-β1刺激hSF增殖并向瘢痕疙瘩相关细胞表型转化,而浓度继续增加时,效果出现停滞并呈现逆转迹象。因此,刺激hSF表型向瘢痕疙瘩相关细胞表型转化的最佳浓度应不超过10 ng/mL(图3)。
2.2.2 Western blot检测AMPK激动剂对hSF表型转化的干预作用
Western blot检测显示,加入AMPK激动剂后,E-cadherin的表达逐步上调;Vimentin、ACTA的表达则逐步下调,CollagenⅠ也逐步减少;而干性标志Nanong、Oct4的表达也随之下调;同时,H2AX磷酸化活化水平也被抑制,而Glut4和IRS-1的表达均逐步上调。以上结果说明,随着AMPK激动剂剂量的增加,hSF向瘢痕疙瘩相关细胞表型转化的过程被逐步干预(图4)。
2.3 ELISA测定
瘢痕疙瘩组织内存在低氧微环境,其中缺氧诱导因子1(HIF-1)是响应于低氧环境的主要转录因子。在缺氧环境下,HIF-1α高表达,通过转录激活机制来提高VEGF的合成[5,17]。ELISA测定显示,在缺氧环境下,hSF中的VEGF和IL-6的表达均明显提高,在TGF-β1诱导下,VEGF和IL-6的合成进一步增加,而随着AMPK激动剂的添加,VEGF及IL-6的表达逐步减少,从而达到抑制hSF向瘢痕疙瘩相关细胞表型转化的作用(图5)。
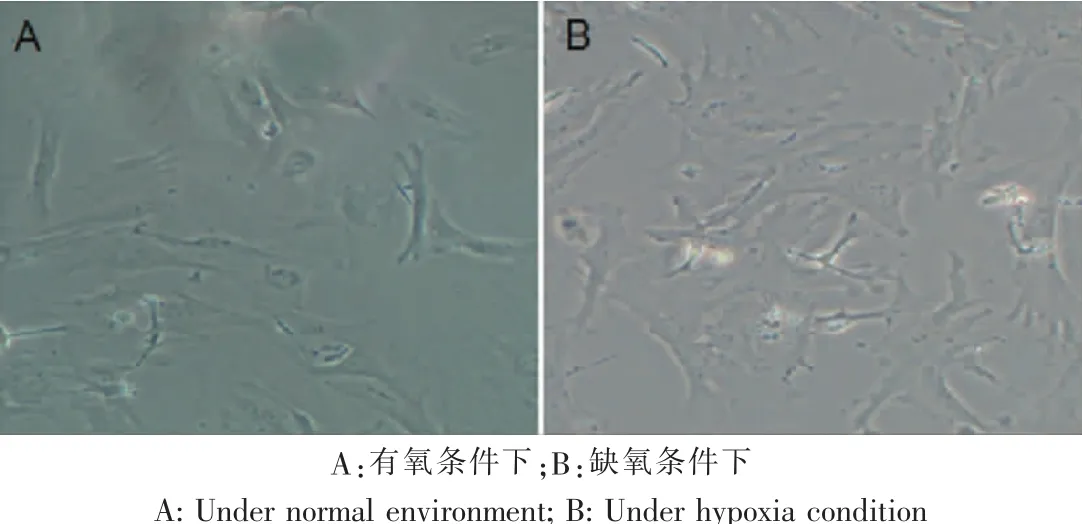
图1 人皮肤成纤维细胞形态学观察Fig.1 Morphology observation of human fibroblast
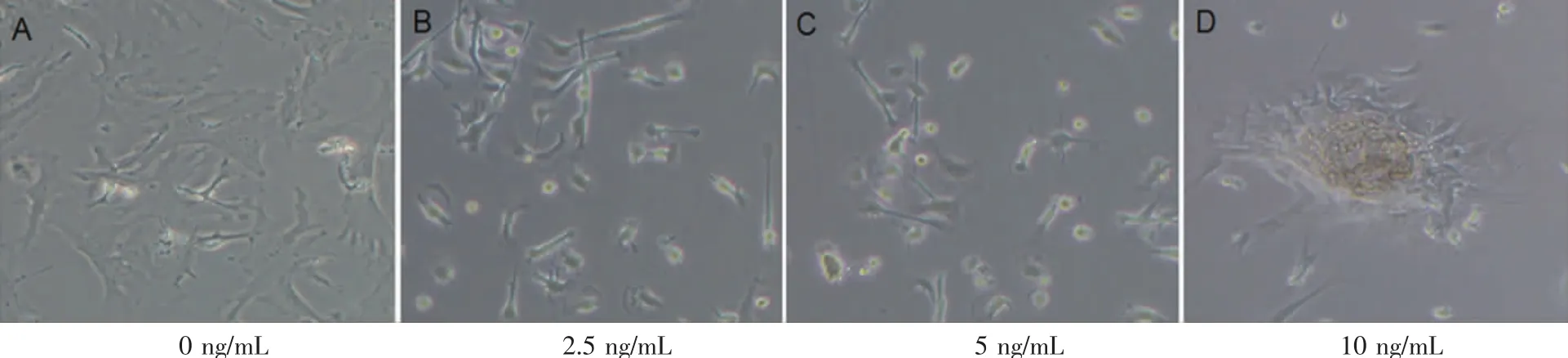
图2 缺氧条件下,加入不同浓度TGF-β1后hSF的细胞形态学观察Fig.2 Morphology observation of human fibroblasts after different concentrations of TGF-β1 added under hypoxia condition

图3 缺氧条件下,加入不同浓度的TGF-β1对hSF表型转化的影响Fig.3 The effects of different concentrations of TGF-β1 on phenotype transformation of human fibroblasts under hypoxia condition

图5 ELISA检测IL6和VEGF在不同剂量AMPK激动剂作用下的表达(*:P<0.05;**:P<0.01)Fig.5 The expression of IL-6 and VEGF after the addition of AMPK agonist tested by ELISA analysis(*:P<0.05;**:P<0.01)

图4 加入同一浓度的TGF-β1使hSF向瘢痕疙瘩相关细胞表型转化后,不同剂量的AMPK激动剂(A769662)对hSF表型向瘢痕疙瘩相关细胞表型转化的干预Fig.4 The intervention effect of different doses of AMPK agonist(A769662)on myofibrosis of human fibroblasts after adding the same concentration of TGF-β1 which induced myofibrosis of human fibroblasts
3 讨论
瘢痕疙瘩实际上是在机体皮肤创口恢复过程中出现的过度纤维化问题。正常情况下,人体胶原的分解和合成是相互协调和统一的,但皮肤损伤后,会导致胶原合成能力增强,进而打破胶原分解与合成的动态平衡,造成胶原异常堆积而导致瘢痕的出现。肌成纤维细胞在病理性愈合中起着重要作用,其持续出现是典型的异常愈合,如瘢痕疙瘩[10,18]。
本研究中,我们将瘢痕疙瘩中的主要细胞hSF作为研究目标,基于瘢痕疙瘩中主要存在缺氧及慢性炎症微环境的事实,构建了体外缺氧及TGF-β1诱导的炎症微环境,来建立hSF表型向瘢痕疙瘩相关细胞表型转化的体外模型。瘢痕疙瘩相关细胞表型可归纳为hSF向肌成纤维细胞细胞转化,能量代谢出现异常,细胞呈氧化应激状态,出现干性分化等。验证该模型后,再加入不同浓度的AMPK激动剂,以探讨其对hSF表型向瘢痕疙瘩相关细胞表型转化的干预作用。
本研究对瘢痕疙瘩的低氧微环境进行模拟。结果表明,hSF在不同的环境当中会发生较大的形态变化,处于无氧环境中的hSF会迅速变成多边形。TGF-β1能促进hSF内营养物质(如葡萄糖、氨基酸等)的代谢过程,使得细胞外基质的合成增加[19],还可促进hSF向肌成纤维细胞转化[20]。本研究结果表明,随着TGF-β1浓度增加,hSF形态发生变化,逐渐向肌成纤维细胞转变,并存在剂量效应。本研究在缺氧环境内不断增加TGF-β1浓度,hSF多数丧失了原来的纺锤形而呈现扁平化,并逐渐聚集成团。该结果说明,TGF-β1可诱导hSF表型向人肌成纤维细胞转化,并可提升hSF的迁移运动能力。
以往研究发现,AMPK具有改善肿瘤能量代谢,逆转Warburg现象的作用[6-8]。二甲双胍(AMPK激动剂)也已被证明具有抗肿瘤作用[9]。但AMPK激动剂在瘢痕疙瘩上的应用尚未见报道。我们在瘢痕疙瘩体外模型构建成功后,加入不同剂量的AMPK激动剂(A769662)来对其进行干预。结果显示,hSF出现显著的干性分化特点,细胞形态逐步趋向于向具有多触角的形态分化。随着AMPK激动剂剂量的增加,其分化程度也相应增加。这意味着AMPK激动剂可影响hSF表型向人肌成纤维细胞转化过程,进而对瘢痕疙瘩的形成过程进行干预。
本研究中,我们通过Western blot来定量分析瘢痕疙瘩体外模型相关标志物的表达与TGF-β1浓度的关系,同时探讨AMPK激动剂对hSF表型向瘢痕疙瘩相关细胞表型转化的干预作用。在对TGF-β1诱导hSF表型向瘢痕疙瘩相关细胞表型转化的干预作用进行定量定性分析用到的标记物主要有:①上皮源性标记物E-cadherin,②间叶源性标记物Vimentin,③标志性蛋白ACTA2,④胶原蛋白标志CollagenⅠ。在研究AMPK激动剂对瘢痕疙瘩体外模型干预作用时,进一步选用的目标蛋白监测因子有:①NANOG、OCT4细胞干性标志,②H2AX磷酸化标志,③胰岛素受体底物IRS-1,④葡萄糖转运蛋白Glut4。通过这些监测因子的使用,确定AMPK激动剂对H2AX活化程度、hSF表型向人肌成纤维细胞转化过程、细胞能量代谢,以及细胞永生化的影响,进而确定代谢在瘢痕疙瘩形成过程中所起的作用。首先,在缺氧条件及TGF-β1的作用下,hSF的E-cadherin表达呈明显下调趋势,Vimentin的表达上调;此外,肌成纤维细胞标志物ACTA2的表达也相应增强。说明hSF在向肌成纤维相关细胞表型转化,并且CollagenⅠ表达也明显提升。上述结果表明,TGF-β1可使hSF向肌成纤维细胞分化,其结果是造成细胞外基质含量提升,在hSF向肌成纤维细胞分化过程中扮演着重要角色,产生病理性愈合,进而导致瘢痕疙瘩的形成。
其次,在人为造成的缺氧和炎症微环境诱导的瘢痕疙瘩化hSF中加入不同剂量AMPK激动剂后,hSF的胶原表达被抑制,而且Vimentin和ACTA的表达都呈明显的下调趋势,同时hSF胶原表达也相应下降,而E-cadherin的表达被显著上调。由此推测,AMPK激动剂可减缓hSF向肌成纤维细胞转化,并且呈现明显的剂量依赖关系。此外,干性标志物Nanong、Oct4等的表达也呈明显的下调趋势。H2AX磷酸化水平也明显减弱,表明氧化应激导致的DNA损伤被逆转。IRS-1和Glut4都呈现出不同程度的上调,说明诱导模型对葡萄糖的摄取能力提升,能量代谢被改善。
TGF-β1和组织缺氧等因素均可直接激活AMPK。由Western blot结果分析可知,随着AMPK激动剂剂量增加,H2AX磷酸化程度降低,hSF表型向瘢痕疙瘩相关细胞表型的转化被抑制。DNA双链断裂标志物pH2AX/H2AX的表达降低,则提示受DNA损伤修复影响而产生的细胞周期停滞得到缓解。Glut4和IRS-1的表达上调,提示糖异生被降低,细胞糖原的合成减少;同时,IRS-1的表达上调,意味着hSF表型向瘢痕疙瘩相关细胞表型转化的过程被逐步抑制。在AMPK激动剂的作用下,细胞逐步衰老,表明细胞的永生化被逆转,从而达到抑制瘢痕疙瘩恶化的目的。
缺氧条件下,HIF-1α的表达增强,一旦被激活,可以极大提升VEGF的表达水平[17,21]。本研究进一步通过 ELISA检测来研究hSF表型向瘢痕疙瘩相关细胞表型的转化受AMPK激动剂的影响程度。结果表明,与正常状态下的机体细胞相比,hSF内的VEGF和IL-6的表达量增加,从而使得血管生长因子与抑制因子的动态平衡被打破,VEGF合成也会在缺氧状态中成倍增加而导致细胞迁移能力增强。随着AMPK激动剂浓度的增加,IL-6活性和VEGF的产生都会有所下降,进而达到抑制细胞纤维化的目标。
在后续研究中,我们将继续研究瘢痕疙瘩来源成纤维细胞在诱导环境下的表型,以及AMPK激动剂对其的作用。同时,可以研究在不同炎症的影响下,死亡细胞分泌Wnt3,从而诱导β-catenin介导的周围成纤维前体细胞增殖过程,以及AMPK、NF-B等因素是否会导致瘢痕疙瘩的出现。此外,AMPK激动剂能否进一步在活体实验上取得类似的效果也将是今后探索的方向。
